אנטומיה השראה תלת מימדי מיקרו רקמות מתוכנן רשתות עצביות עבור שחזור מערכת העצבים, אפנון, דוגמנות
Summary
כתב היד הזה מפרט את ייצור של רקמות מיקרו- רקמות מהונדסות ברשתות עצביות: מבנים תלת-מימדיים בגודל מיקרון המורכבים משטחים אקסונליים ארוכי טווח המקיפים אוכלוסייה נוירונית מצטברת (s), המצופים בהידרוגול צינורי. אלה הפיגומים החיים יכולים לשמש ממסרים תפקודית לשחזר או לווסת מעגלים עצביים או כמו מיטות בדיקה ביופידלית מחקה נוירונטומי חומר אפור לבן.
Abstract
התאוששות פונקציונלית לעיתים רחוקות מתרחשת בעקבות פציעה או ניוון מחלה המושרה בתוך מערכת העצבים המרכזית (CNS) בשל הסביבה מעכב ואת יכולת מוגבלת neurogenesis. אנו מפתחים אסטרטגיה בו זמנית כתובת נוירונים ואת הנתיב המסלול axonal בתוך CNS פגום. כתב יד זה מציג את פרוטוקול ייצור עבור מיקרו-רקמות מהונדסים רשתות עצביות (מיקרו- TENNs), בונה מושתל המורכב נוירונים ומסומנים axonal שטחים פורש לומן תאיים (ECM) לומן של צילינדרים הידרוג'ל preformed מאות מיקרון בקוטר שיכולים להרחיב סנטימטרים באורך. עצבים נוירונים הם תחומים לקיצוניות של תלת מימדי encasement ו הם מורחבת על ידי תחזיות axonal. Micro-TENNs מותאמים באופן ייחודי כאסטרטגיה לשיקום CNS, המדמה היבטים של cytoarchitecture במוח connectome ואפשרות לספק אמצעי להחלפת הרשת. הניאואגרגטים רונאליים עשויים סינפסה עם רקמות המארח ליצור ממסרים פונקציונליים חדשים כדי לשחזר ו / או לשנות את המעגל חסר או פגום. מבנים אלה עשויים לשמש גם "פרוגומים חיים" פרו – רגנרטיבית, המסוגלים לנצל מנגנוני התפתחות של נדידת תאים ומסלול דרכי אקונלי, המספקים רמזים מבניים ומסיסים סינרגיסטיים על בסיס מצב התחדשות. Micro-TENNs הם מפוברק על ידי שפוך נוזל הידרוג לתוך עובש גלילי המכיל מחט ממוקד longitudinally. לאחר הידרוג יש gelled, מחט מוסר, משאיר חלול מיקרו העמודה. פתרון ECM מתווסף לומן כדי לספק סביבה מתאימה להדבקה העצבית ואת תוצר axonal. נוירונים מנותקים הם מצטברים מכנית עבור זריעה מדויקת בתוך אחד או בשני הקצוות של המיקרו טור. מתודולוגיה זו מייצרת באופן אמין בונה מיניאטורי עצמאי עם ארוך הקרנת חלקים axonal שיכולים לשחזר תכונות של המוח neuroanatomy. סינפטיתUnlabeling ו מסומנת גנטית סידן מחוונים מצביעים על כך מיקרו- TENNs יש הפצה סינפטי נרחב ופעילות חשמל מהותי. כתוצאה מכך, Micro-TENNs מייצגים אסטרטגיה מבטיחה לשיקום נוירו-ניתוחי ממוקד של מסלולי מוח, ויכולים לשמש גם כמודלים ביופידליים כדי לחקור תופעות נוירוביולוגיות במבחנה .
Introduction
המאפיין השכיח של הפרעות ומחלות של מערכת העצבים המרכזית (CNS), כגון פגיעה מוחית טראומטית (TBI), פגיעה בחוט השדרה (SCI), שבץ, מחלת האלצהיימר ומחלת פרקינסון, הוא ניתוק מסלולי האקסון ותאי העצב הפסד 1 , 2 , 3 , 4 , 5 , 6 . לדוגמה, כאשר שבץ איסכמי הולך untreated, ההערכה היא כי האקסונים הם איבדו בקצב של 7 קילומטרים של אקסונים לדקה 5 . במקרה של TBI, אשר כ -1.7 מיליון אנשים חווים מדי שנה בארצות הברית לבדה, ניוון axonal עשוי להמשיך להתרחש שנים לאחר טראומה, כמו הפגיעה הראשונית מזרז מצב נוירודגנרטיבי לטווח ארוך 4 . מחריף השפעות אלה מזיקים, CNS יש capa מוגבלת מאודעיר עבור התחדשות 1 , 7 , 8 , 9 . לאחר הפציעה, מתפתחת סביבה מעכבת המאופיינת בחוסר הדרכה מכוונת למטרה רחוקה, נוכחות של מעכבים הקשורים במיאלין, המעכבים את צמיחת הנוריטים, ויצירת צלקת גלייה על ידי אסטרוציטים תגובתיים 8 , 10 , 11 , 12 . צלקת גלייה משמש כמחסום ביוכימי ופיזי התחדשות, עם מולקולות כגון chondroitin sulfate proteoglycans חסימת תוצר האקסון 8 , 11 . יתר על כן, למרות תאי גזע עצביים נמצאו CNS מבוגר, הייצור של נוירונים חדשים מוגבל, כמו עדות עקבית של neurogenesis רק נמצא הנורה חוש הריח, ההיפוקמפוסאזור subgranular, אזור periventricular, ואת התעלה המרכזית של חוט השדרה 13 , 14 . מכשולים אלה מונעים התאוששות תפקודית של נוירונים אבודים ואדריכלות החומר הלבן בעקבות פגיעה או מחלה, וכתוצאה מכך את החיים לעתים קרובות שינוי מתמשך ההשפעות של תנאים אלה.
למרות חוסר יכולת התחדשות CNS הבוגר, הוכח כי התחדשות axonal אפשרי אם רמזים סביבתיים נאותים מוצגים לארח נוירונים 15 , 16 , 17 , 18 . החוקרים ניסו לספק ולטפל בגורמי גדילה ( למשל, גורם גדילה עצבי , גורם גדילה באפידרמיס, גורם גדילה תלוי-גליה וגורם נוירוטרופי -3) ומולקולות הדרכה אחרות כדי לעורר את הפלסטיות ואת התחדשות האקסון 14 ,/ Sup> 18 , 19 . למרות שמחקרים אלו אישרו כי אקסונים מבוגרים מסוגלים להגיב לגורמי גדילה, אסטרטגיות אלו מוגבלות על ידי החדירות הנמוכה של מחסום הדם והמוח והדרגות הספציפיות והזמניות הנדרשות לקידום התחדשות 14 , 18 , 19 . גישות אחרות הסתמכו על hyperactivation של גורמים שעתוק הקשורים שיקום נוירונים CNS. לדוגמה, overexpression של גורם שעתוק Stat3 עוררה התחדשות axonal העצב האופטי 20 . עם זאת, הן ביומולקולה משלוח overexpression של גורמי שעתוק לא מצליחים להחליף אוכלוסיות איבוד נוירונים. אסטרטגיות מבוססות תאים התמקדו בעיקר בהשתלת תאי גזע עצביים (NSC) לתוך מערכת העצבים המרכזית, תוך ניצול יכולתם להחליף נוירונים במערכת העצבים המרכזית,ולתמוך בניסיונות נוירוגנזה המתרחשים לאחר הפציעה. למרות זאת, ישנם עדיין אתגרים דוחקים בגישה זו, כולל היכולת הקשה של תאים עצביים המושתלים לשרוד, להשתלב עם המארח, ולהישאר מוגבל מרחבית לאזור הפגוע 6 , 14 , 17 , 21 . בנוסף, משלוח תאים לבד אינו מסוגל להחזיר את cytoarchitecture של מסלולים axonal פגום או אבוד. גישה חלופית המטפלת בבעיות העומדות בפני אסטרטגיות של תאים ותרופות / תרופות כימיות היא שילוב של גישות אלה עם השימוש ביומטריאליות 14 , 22 , 23 . Biomaterials כגון הידרוג מסוגלים לחקות את המאפיינים ביוכימיים ופיזיים של המטריצה תאיים (ECM), המסייעים משלוח תאD החזקת באזור הפגוע, ומספק גורמי גדילה ומולקולות ביו אקטיביות אחרות עם שחרור מבוקר 22 . המאפיינים האטרקטיביים של אסטרטגיות אלו מבוססי ביו חומרים הובילו ראיות של התחדשות אקסונול vivo לאחר השתלת פיגומים לאזור lesioned 24 , 25 , 26 , 27 , 28 , 29 , 30 . עם זאת, אסטרטגיות biomaterial ביולוגי לא להחליף אוכלוסיות איבוד נוירונים; כאשר משמשים כלי הלידה עבור תאי עצב נוירונים, גליה, או נוירונים, biomaterials אינם מסוגלים לבנות מחדש רשתות ארוכות טווח axonal. האתגר של פיתוח גישה המתמודדת הן ניוון המסלול אקסונל ואובדן עצבי הקשורים הפציעה CNS המחלה עדיין נשאר <Sup class = "xref"> 31.
קבוצת המחקר שלנו דיווחה בעבר על פיתוח של רקמת מיקרו-רקמה מושתלת מהונדסת רשתות עצביות (מיקרו-טנס), שהן סוג של "פיגום חי" המורכב מגופי תא עצביים המוגבלים לאחד או לשני הקצוות של מיקרו-אגרוזה , עם שטחים axonal מיושר המשתרעת על פני השטח של זה תלת מימדי (3D) encasement 1 , 10 , 31 , 32 . אחד ההבדלים העיקריים בין טכניקה זו לבין גישות קודמות היא כי cytoarchitecture של מיקרו- TENNs נוצרת לחלוטין במבחנה ו מושתלים לאחר מכן 33 , 34 , 35 , 36 , 37 , 38 , <Sup class = "xref"> 39 , 40 , 41 . ייצור במבחנה מציעה שליטה מרחבית וטמפורלית רחבה על הפנוטיפ והתכוונות הסלולר, תכונות מכניות / פיסיקליות, רמזים ביוכימיים וגורמים אקסוגניים, אשר מרוויח שילוב של פיגומים אלה עם המארח לאחר ההשתלה 41 , 42 . Micro-TENNs הם בהשראת אנטומית כי הם לחקות neuroanatomy המוח, הצגת דרכי axonal דומים לאלה לגשר אזורים תפקודיים שונים של המוח ( איור 1 א ) 1 . לכן, אסטרטגיה זו עשויה להיות מסוגל פיזית להחליף את החומר הלבן איבד שטחים נוירונים בעקבות ההשתלה לאזור lesioned. טכניקה זו מושפעת גם ממנגנונים התפתחותיים שבהם "פיגומי חיים טבעיים" שנוצרו על ידי תאי גלייה רדיאליים ו אקסונים חלוציים לשמש מדריכי pathfinding עבור התאהגירה מן האזור subventricular ו תוצר axonal, בהתאמה 43 . מנגנונים אלה הם recapitulated ב axonal שטחים של micro-TENNs, אשר יכולים להציג נתיבים חיים עבור הגירה תאים עצביים התחדשות axonal ידי תוצר אקסון בתיווך אקסונל ( איור 1 ג ) 43 . יתר על כן, אסטרטגיה זו מנצלת אינטגרציה סינפטי בין נוירונים מיקרו TENN ו מעגל הילידים, יצירת ממסרים חדשים שעשויים לתרום התאוששות תפקודית ( איור 1 ב ) 43 . היכולת להיווצרות סינפסה עשויה גם להעניק גישה זו את היכולת לווסת את CNS ולהגיב רקמות המארח על פי משוב ברשת. לדוגמה, נוירונים פעילים optogenetically של פיגומים חיים עשוי להיות מגורה כדי לווסת את הנוירונים המארח באמצעות אינטראקציות סינפטי ( איור 1D ).
בנוסף, קונסטרוקטור ביולוגי מבוסס ביומטריUction של מיקרו- TENNs מציעה סביבה נאותה עבור הידבקות התא, צמיחה, הרחבת neurite, איתות, בעוד מימדים מיניאטורי של מבנים עשוי לאפשר השתלה פולשנית מינימלית לספק microenvironment חלקית חלקית עבור אינטגרציה הדרגתית לתוך המוח. ואכן, הפרסומים האחרונים הוכיחו את הפוטנציאל של מיקרו- TENNs לחקות מסלולים עצביים לאחר ההשתלה לתוך המוח חולדה. בעקבות microinjection stereotaxic, אנחנו בעבר דיווחו עדויות של הישרדות עצביים מיקרו-TENN, תחזוקה של ארכיטקטורת דרכי axonal, ואת הרחבת neurite לתוך הקורטקס המארחת עד לפחות 1 חודש in vivo 10 , 31 . יתר על כן, תיוג עם סינאפסין סיפק ראיות היסטולוגית של אינטגרציה סינפטי עם רקמות יליד 10 , 31 . בסך הכל, Micro-TENNs עשוי להיות מתאים באופן ייחודי לשחזר ולפגוע פגוםCNS על ידי החלפת נוירונים אבודים, שילוב סינפטי עם המעגלים המארחת, שחזור אבודים cytoarchitecture axonal, ובמקרים מסוימים, מתן אקסונים התחדשות עם רמזים pathfinding המתאים.
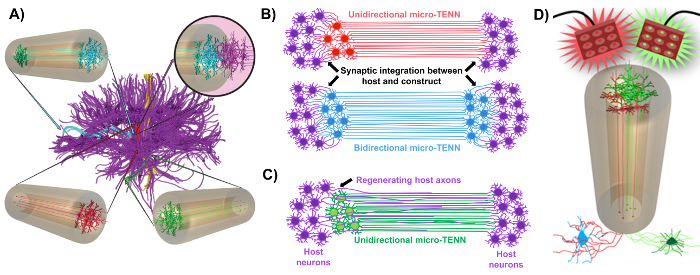
איור 1: עקרונות השראה מאחורי פיתוח של רקמות מיקרו מהונדסים רשתות עצביות (מיקרו- TENNs). ( A ) Micro-TENNs לחקות את cytoarchitecture של המוח connectome (סגול), שבו אזורים נפרדים מבחינה תפקודית מחוברים על ידי ארוך, מיושר axonal tracts ב חד כיווני (אדום, ירוק) או דו כיווני (כחול) באופן. לדוגמה, מיקרו- TENNs יכול לשחזר חיבורים אבודים במסלולים קורטיקוטלמיים ו nigrostriatal או במסלול perforant מן קליפת המוח אל ההיפוקמפוס (מותאם struzyna et al. , 2015) 1 . ( ב ) תרשים של חד-כיווניותL ו חד כיווני micro-TENN (אדום וכחול, בהתאמה) שילוב סינפטי עם המעגל המארח (סגול) לשמש כמסר פונקציונלי בין שני הקצוות של הנגע. ( C ) סכמטי של שטחי axonal של חד כיווני מיקרו TENN (ירוק) משמש כמדריך התחדשות מאופקת האקסון של האקסונים המארח (סגול) לעבר מטרה שבה micro-TENN אינטראקציה. ( D ) תרשים תפיסתי של השימוש מיקרו-TENNS פעיל optogenetically כמו neuromodulators, תוך ניצול אינטגרציה סינפטי עם נוירונים מעוררים או מעכבים (התחתון). אנא לחץ כאן כדי להציג גרסה גדולה יותר של דמות זו.
כתב היד הנוכחי מפרט את המתודולוגיה שנוצלה כדי לפברק מיקרו- TENNs באמצעות נוירונים קליפתיים מוחיים הנגזרים עובריים. יש לציין, מיקרו- TENNs יכול להיות מפוברק עם סוגים אחרים של תאים עצביים. לדוגמהבשפע, הדוחות הראשונים של מוצלח מיקרו פיתוח TENN מובלט גנגליון השורש הגבי (DRG) נוירונים 32 . הידרוג'ל מיקרו עמודות ניתן להפיק ( איור 2 א ) על ידי הוספת agarose נוזלי כדי אישית, לחתוך לייזר מערך ערוץ גלילי או צינורות נימי, שניהם המכילים מחטים אקופונקטורה מיושר. המחט יוצרת את לומן וקובעת את הקוטר הפנימי (ID) של המיקרו טור, ואילו מזהה צינור נימי ואת קוטר של צילינדרים ב לייזר לחתוך התקן להכתיב את הקוטר החיצוני (OD) של מבנים. OD ו ID ניתן לבחור על פי היישום הרצוי על ידי בחירת בקטרים שונים עבור המכשיר / צינורות נימי ואת מחטי דיקור, בהתאמה. אורכו של עמודות המיקרו יכול גם להיות מגוונים; עד כה, יש לנו דיווחו על בניית מיקרו TENNs עד 20 מ"מ אורך 10 והם פעיל רודף אפילו אורכים ארוכים יותר. לאחר ג'ל agarose ואת דיקור nEedles מוסרים, פתרון ECM בדרך כלל המורכב סוג אני קולגן laminin מתווסף לומן של בונה ( איור 2 ג ). הליבה ECM מספק פיגום לתמוך הידבקות התא העצבית ותוצר axonal. בתחילה, ראשי נוירונים קליפת המוח עכברוש היו מצופה בעמודות מיקרו באמצעות השערות תא מנותקים 10 , 31 , 32 . עם זאת, גישה זו לא ייצרה את cytoarchitecture היעד בכל המקרים, אשר הוגדר כמו תא תאים עצביים מוגבל לקצוות של עמודות מיקרו, עם לומן מרכזי המורכב טהור מיסודות axonal. מאז, השימוש בשיטת צבירה נוירונים כפויה (המבוססת על פרוטוקולים המותאמים מ- Ungrin et al ) אפשרה ייצור אמין יותר ועקבי של מיקרו-טנס עם המבנה האידיאלי ( איור 2 ב ) 44 . בנוסף לתיאור הנוכחימתודולוגיה, מאמר זה יראה נציג בניגוד שלב ו confocal תמונות של מיקרו- TENNs המדגימים את היווצרות של שטחי axonal לאורך זמן, כמו גם את cytoarchitecture היעד הסופי. כתב היד הזה ירחיב גם על היבטים ראויים לציון של הפרוטוקול ואתגרים נותרו ואת הכיוונים העתידיים של הטכנולוגיה מיקרו- TENN.
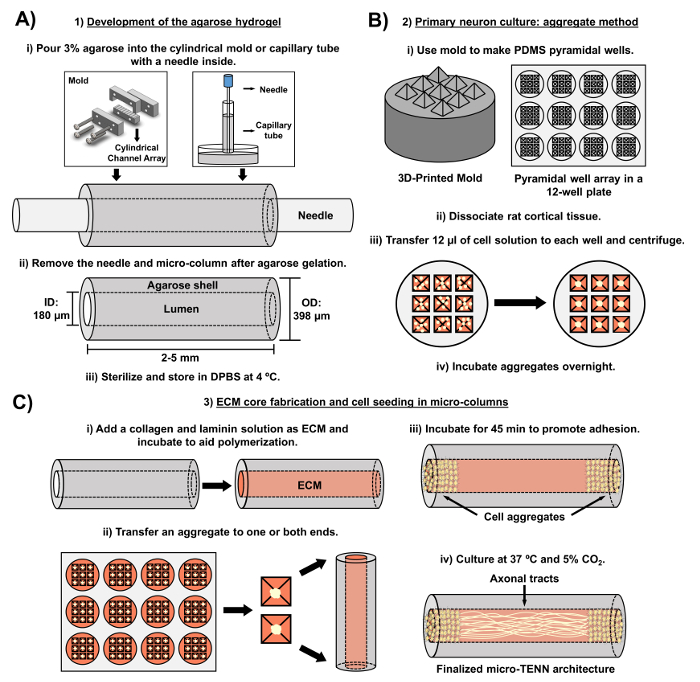
איור 2: דיאגרמה סכמטית של תהליך ייצור מיקרו-TENN תלת-שלבי. ( א ) פיתוח של hydroel agarose: (i) בתחילה, מחט אקופונקטורה קטנה ( למשל , 180-350 מיקרומטר קוטר) מוכנס לתוך ערוצי גלילי של מותאם אישית, לייזר לחתוך עובש או צינור נימי ( למשל , 380-700 מיקרומטר בקוטר). בשלב הבא, agarose נוזלי DPBS הוא הציג לתוך צינורות גליליים או צינורות נימי. (2) לאחר ג'ל agarose, המחט מוסרהתבנית מפורקת להניב את האגרוזה החלולה מיקרו-עמודות. (ג) מבנים אלה מעוקרים ומאוחסנים ב- DPBS. ( ב ) תרבות נוירון העיקרי בשיטה המצטברת: (i) צבירה העצבית מבוצעת מערכים פירמידליים מיקרו היטב, יצוק מ -3 מודפסים בקבוצה זו, שמתאימים בארות של צלחת 12 היטב תרבות. (II) מיקרו TENNs כוללים נוירונים עכברוש הראשי ניתק מ המוח העוברי של עובריים יום 18 חולדות. בעקבות דיסוציאציה רקמות עם טריפסין- EDTA ו DNase אני, פתרון התא עם צפיפות של 1.0-2.0 x 10 6 תאים / מ"ל מוכן. (Iii) 12 μL של פתרון זה מועברים היטב כל במערך פירמידה מיקרו היטב. הצלחת המכילה אלה מיקרו בארות הוא centrifuged לייצר אגרגטים התא. (IV) אלה מודגרת אז לילה לפני ציפוי בעמודים מיקרו. ( C ) ייצור הליבה ECM ו זריעת תאים: (i) לפני זריעת תאים, פתרון ECM המכיל 1 מ"ג / מ"ל סוג קולגן אני 1 מ"ג / מ"לLaminin מועבר הפנים של מיקרו- TENNs מותר לפלמר. (Ii) תלוי אם חד-כיווני או חד-כיווני מיקרו-טנס מפוברקים, צבירה ממוקמת באחד או בשני הקצוות של המיקרו-טור, בהתאמה. (ג) לאחר תקופה של הדגירה כדי לקדם הידבקות, מיקרו- TENNs מתורבת בצלחות פטרי מוצף בינוני בינוני העצבית הבסיסית העצבית. (Iv) לאחר 3-5 ימים בתרבות, מבנה המיקרו-טין הסופי אמור להפגין אגרגטים של תאים בקצוות המיקרו-טור, עם שטחי אקסונים המשתרעים לאורכו. אנא לחץ כאן כדי להציג גרסה גדולה יותר של דמות זו.
Protocol
Representative Results
Discussion
פציעה ומחלה של מערכת העצבים המרכזית בדרך כלל גורמות לאובדן או לתפקוד לקוי של המסלולים האקסונליים למרחקים ארוכים שמרכיבים את המוח, עם או בלי התנוונות העצבית. זה מורכב על ידי יכולת מוגבלת של CNS לקדם neurogenesis והתחדשות. למרות המרדף אחר אסטרטגיות תיקון כגון גורם הגדילה, התא,…
Declarações
The authors have nothing to disclose.
Acknowledgements
תמיכה כספית סופקה על ידי המכונים הלאומיים לבריאות U01-NS094340 (Cullen), T32-NS043126 (האריס) ו- F31-NS090746 (Katiyar), קרן מייקל ג'יי. פוקס (תוכנית טיפולית מס '9998, Cullen) (Cullen), הקרן הלאומית למדע (DBA-1321851), המחלקה לענייני יוצאי צבא (RR & D Merit Review # B1097-I (Cullen)), האגודה האמריקאית של המנתחים הנוירולוגים והקונגרס של המנתחים הנוירולוגים (מלגה 2015) בקודמן (Neurotrauma and Care Care) (פטרוב)), והמחקר הרפואי של צבא ארצות הברית ומפקדת המטריאל (# W81XWH-13-207004 (Cullen) ו- W81XWH-15-1- 0466 (קאלן)).
Materials
| Laser cutter | Universal Laser Systems | PLS4.75 | Used to fabricate the laser-cut micro-channel mold. |
| Laser-cut micro-column fabrication device | Custom-made | ————– | Contact our research group if interested. Dimensions and blueprints provided in the manuscript. |
| Screws | ————– | ————– | #4-40 with a thread diameter of 3.05 mm |
| Nuts | ————– | ————– | #4-40 with a thread diameter of 3.05 mm |
| Acupuncture needle (180 µm diameter) | Lhasa Medical | sj.16X40 | The diameter may be varied according to the desired size for the micro-column lumen. |
| Petri dish | Fisher | 08772B | |
| Dulbecco's phosphate buffered saline (DPBS) | Invitrogen | 14200075 | |
| Polystyrene disposable serological pipet | Fisher | 13-678-11D | |
| Agarose | Sigma | A9539-50G | |
| Capillary tube (398 µm diameter) | Fisher | 21170D | The diameter may be varied according to the desired size for the micro-column shell. |
| Hot plate | Fisher | SP88857200 | |
| Magnetic bar | Fisher | 1451352 | |
| Micropipette | Sigma | Z683884-1EA | |
| 25 mm gauge needle | Fisher | 14-826-49 | |
| Microscalpel | Roboz Surgical | RS-6270 | |
| Scissors | Fine Science Tools | 14081-09 | |
| Forceps | World Precision Instruments | 501985 | |
| Hot bead sterilizer | Sigma | Z378550-1EA | |
| Stereoscope | Nikon | SMZ800N | Used for all dissection steps and for micro-TENN fabrication. |
| Rat tail type I collagen | Corning | 354236 | Maintain at 4 ºC and remove only when needed. Use ice to preserve its temperature when in use. |
| Microcentrifuge tube | Fisher | 02-681-256 | |
| Mouse laminin | Corning | 354232 | Maintain at 4 ºC and remove only when needed. Use ice to preserve its temperature when in use. |
| Neurobasal medium | Invitrogen | 21103049 | Basal medium for the culture of pre-natal and embryonic neuronal cells. Store at 4ºC and warm at 37 ºC before use. |
| Sodium hydroxide (NaOH) | Fisher | SS2661 | |
| Hydrochloric acid (HCl) | Fisher | SA48-1 | |
| Litmus paper | Fisher | 09-876-18 | |
| Hank's balanced salt solution (HBSS) | Invitrogen | 14170112 | Store at 4 ºC. |
| 0.25% Trypsin-EDTA | Invitrogen | 25200056 | Store at -20 ºC and warm at 37 ºC before use. |
| Bovine pancreatic deoxyribonuclease (DNase) I | Sigma | 10104159001 | Store at -20 ºC and warm at 37 ºC before use. |
| B-27 Supplement | Invitrogen | 12587010 | Supplement added to Neurobasal medium for the culture of hippocampal and cortical neurons. Store at -20 ºC and warm at 37 ºC before use. |
| L-glutamine | Invitrogen | 35050061 | Store at -20 ºC and warm at 37 ºC before use. |
| Sprague Dawley embryonic day 18 rats | Charles River | Strain 001 | |
| Pasteur pipette | Fisher | 22-042816 | |
| 15 mL centrifuge tube | EMESCO | 1194-352099 | |
| Vortex | Fisher | 02-215-414 | |
| Centrifuge | Fisher | 05-413-115 | |
| Hemocytometer | Fisher | 02-671-6 | |
| Objet30 3D-Printer | Stratasys | ————– | Used to fabricate the pyramidal micro-well molds. |
| 3D-printed pyramidal well mold | Custom-made | ————– | Contact our research group if interested. Dimensions and blueprints provided in the manuscript. |
| Polydimethylsiloxane (PDMS) and curing agent | Fisher | NC9285739 | Comes as kit with elastomer and curing agent. Use inside a chemical fume hood. |
| Funnel | Fisher | 10-348C | |
| 1 ml pipette bulb | Sigma | Z509035 | |
| Micro-spatula | Fisher | S50821 | |
| 12-well culture plate | EMESCO | 1194-353043 | |
| Oven | Fisher | 11-475-154 | |
| Incubator | Fisher | 13 998 076 | |
| AAV1.Syn.GCaMP6f.WPRE.SV40 | UPenn Vector Core | 36373 | Store at -80ºC. Commercially available adeno-associated virus (AAV) with the GCaMP6f calcium indicator. |
| Formaldehyde 40% | Fisher | F77P-4 | Formaldehyde is a toxic compound known to be carcinogenic, and must be disposed of in a separate container. |
| Triton X-100 | Sigma | T8787 | Non-ionic surfactant used to permeabilize cell membranes. |
| Horse serum | Gibco | 16050-122 | |
| Mouse anti-Tuj-1/beta-III tubulin primary antibody | Sigma | T8578-200UL | Store at -20ºC. |
| Rabbit anti-synapsin 1 primary antibody | Synaptic Systems | 106-001 | Store at -20ºC. |
| Donkey anti-mouse 568 secondary antibody | Invitrogen | A10037 | Store at 4ºC. |
| Donkey anti-rabbit 488 secondary antibody | Invitrogen | A21206 | Store at 4ºC. |
| Hoechst 33342, Trihydrochloride | Invitrogen | H3570 | Store at 4ºC. Hoechst is a known mutagen that should be treated as a carcinogen. Therefore, it must be disposed of in a separate container. |
| A1RSI Laser Scanning Confocal Microscope | Nikon | ————– | Used for taking the confocal reconstructions of immunolabeled constructs. |
| Eclipse Ti-S Microscope | Nikon | ————– | Used for taking the phase-contrast images. With digital image acquisition using a QiClick camera interfaced with Nikon Elements Basic Research software (4.10.01). |
| High-speed Fluorescence Microscope | Nikon | ————– | Nikon Eclipse Ti microscope paired with an ANDOR Neo/Zyla camera for calcium imaging. |
| NIS Elements AR 4.50.00 Software | Nikon Instruments | ————– | Used to identify calcium transients from the recordings taken with the high-speed fluorescence microscope. |
Referências
- Struzyna, L. A., Harris, J. P., Katiyar, K. S., Chen, H. I., Cullen, D. K. Restoring nervous system structure and function using tissue engineered living scaffolds. Neural Regen. Res. 10 (5), 679-685 (2015).
- Tallantyre, E. C., Bø, L., et al. Clinico-pathological evidence that axonal loss underlies disability in progressive multiple sclerosis. Mult. Scler. 16 (4), 406-411 (2010).
- Cheng, H. C., Ulane, C. M., Burke, R. E. Clinical Progression in Parkinson Disease and the Neurobiology of Axons. Ann. Neurol. 67 (6), 715-725 (2010).
- Johnson, V. E., Stewart, W., Smith, D. H. Axonal pathology in traumatic brain injury. Exp. Neurol. 246, 35-43 (2013).
- Hinman, J. D. The back and forth of axonal injury and repair after stroke. Curr. Opin. Neurol. 27 (6), 615-623 (2014).
- Li, X., Katsanevakis, E., Liu, X., Zhang, N., Wen, X. Engineering neural stem cell fates with hydrogel design for central nervous system regeneration. Prog. Polym. Sci. 37 (8), 1105-1129 (2012).
- Horner, P. J., Gage, F. H. Regenerating the damaged central nervous system. Nature. 407 (6807), 963-970 (2000).
- Yiu, G., He, Z. Glial inhibition of CNS axon regeneration. Nat. Rev. Neurosci. 7 (8), 617-627 (2006).
- Montani, L., Petrinovic, M. M. Targeting Axonal Regeneration: The Growth Cone Takes the Lead. J. Neurosci. 34 (13), 4443-4444 (2014).
- Struzyna, L. A., Wolf, J. A., et al. Rebuilding Brain Circuitry with Living Micro-Tissue Engineered Neural Networks. Tissue Eng. Part A. 21 (21-22), 2744-2756 (2015).
- Huebner, E. a., Strittmatter, S. M. Axon Regeneration in the Peripheral and Central Nervous Systems. Results Probl. Cell Differ. 48, 339-351 (2009).
- Benowitz, L. I., Yin, Y. Combinatorial Treatments for Promoting Axon Regeneration in the CNS: Strategies for Overcoming Inhibitory Signals and Activating Neurons’ Intrinsic Growth State. Dev. Neurobiol. 67 (9), 1148-1165 (2007).
- Lie, D. C., Song, H., Colamarino, S. A., Ming, G., Gage, F. H. Neurogenesis in the Adult Brain: New Strategies for Central Nervous System Diseases. Annu. Rev. Pharmacol. Toxicol. 44, 399-421 (2004).
- Gao, Y., Yang, Z., Li, X. Regeneration strategies after the adult mammalian central nervous system injury-biomaterials. Regen. Biomater. 3 (2), 115-122 (2016).
- Benfey, M., Aguayo, A. J. Extensive elongation of axons from rat brain into peripheral nerve grafts. Nature. 296 (11), 150-152 (1982).
- David, S., Aguayo, A. J. Axonal Elongation into Peripheral Nervous System “Bridges” after Central Nervous System Injury in Adult Rats. Science. 214 (4523), 931-933 (1981).
- Shoichet, M. S., Tate, C. C., Baumann, M. D., LaPlaca, M. C. Strategies for Regeneration and Repair in the Injured Central Nervous System. Indwelling Neural Implant. Strateg. Contend. with Vivo Environ. , (2008).
- Lu, P., Tuszynski, M. H. Growth factors and combinatorial therapies for CNS regeneration. Exp. Neurol. 209 (2), 313-320 (2008).
- Curinga, G., Smith, G. M. Molecular/genetic manipulation of extrinsic axon guidance factors for CNS repair and regeneration. Exp. Neurol. 209 (2), 333-342 (2008).
- Mehta, S. T., Luo, X., Park, K. K., Bixby, J. L., Lemmon, V. P. Hyperactivated Stat3 boosts axon regeneration in the CNS. Exp. Neurol. 280, 115-120 (2016).
- Elliott Donaghue, I., Tam, R., Sefton, M. V., Shoichet, M. S. Cell and biomolecule delivery for tissue repair and regeneration in the central nervous system. J. Control. Release. 190, 219-227 (2014).
- Tam, R. Y., Fuehrmann, T., Mitrousis, N., Shoichet, M. S. Regenerative therapies for central nervous system diseases: a biomaterials approach. Neuropsychopharmacology. 39 (1), 169-188 (2014).
- Cullen, D. K., Wolf, J. A., Smith, D. H., Pfister, B. J. Neural Tissue Engineering for Neuroregeneration and Biohybridized Interface Microsystems In vivo (Part 2). Crit. Rev. Biomed. Eng. 39 (3), 243-262 (2011).
- Han, Q., Jin, W., et al. The promotion of neural regeneration in an extreme rat spinal cord injury model using a collagen scaffold containing a collagen binding neuroprotective protein and an EGFR neutralizing antibody. Biomaterials. 31 (35), 9212-9220 (2010).
- Suzuki, H., Kanchiku, T., et al. Artificial collagen-filament scaffold promotes axon regeneration and long tract reconstruction in a rat model of spinal cord transection. Med. Mol. Morphol. 48 (4), 214-224 (2015).
- Silva, N. A., Salgado, A. J., et al. Development and Characterization of a Novel Hybrid Tissue Engineering-Based Scaffold for Spinal Cord Injury Repair. Tissue Eng. Part A. 16 (1), 45-54 (2009).
- Moore, M. J., Friedman, J. A., et al. Multiple-channel scaffolds to promote spinal cord axon regeneration. Biomaterials. 27 (3), 419-429 (2006).
- Tsai, E. C., Dalton, P. D., Shoichet, M. S., Tator, C. H. Synthetic hydrogel guidance channels facilitate regeneration of adult rat brainstem motor axons after complete spinal cord transection. J. Neurotrauma. 21 (6), 789-804 (2004).
- Chen, B. K., Knight, A. M., et al. Axon regeneration through scaffold into distal spinal cord after transection. J. Neurotrauma. 26 (10), 1759-1771 (2009).
- Jain, A., Kim, Y. -. T., McKeon, R. J., Bellamkonda, R. V. In situ gelling hydrogels for conformal repair of spinal cord defects, and local delivery of BDNF after spinal cord injury. Biomaterials. 27 (3), 497-504 (2006).
- Harris, J. P., Struzyna, L. A., Murphy, P. L., Adewole, D. O., Kuo, E., Cullen, D. K. Advanced biomaterial strategies to transplant preformed micro-tissue engineered neural networks into the brain. J. Neural Eng. 13 (1), 16019-16037 (2016).
- Cullen, D. K., Tang-Schomer, M. D., et al. Microtissue engineered constructs with living axons for targeted nervous system reconstruction. Tissue Eng. Part A. 18 (21-22), 2280-2289 (2012).
- Tate, M. C., Shear, D. A., Hoffman, S. W., Stein, D. G., Archer, D. R., LaPlaca, M. C. Fibronectin promotes survival and migration of primary neural stem cells transplanted into the traumatically injured mouse brain. Cell Transplant. 11 (3), 283-295 (2002).
- Denham, M., Parish, C. L., et al. Neurons derived from human embryonic stem cells extend long-distance axonal projections through growth along host white matter tracts after intra-cerebral transplantation. Front. Cell. Neurosci. 6 (11), (2012).
- Fawcett, J. W., Barker, R. A., Dunnet, S. B. Dopaminergic neuronal survival and the effects of bFGF in explant, three dimensional and monolayer cultures of embryonic rat ventral mesencephalon. Exp. Brain Res. 106 (2), 275-282 (1995).
- Mine, Y., Tatarishvili, J., Oki, K., Monni, E., Kokaia, Z., Lindvall, O. Grafted human neural stem cells enhance several steps of endogenous neurogenesis and improve behavioral recovery after middle cerebral artery occlusion in rats. Neurobiol. Dis. 52, 191-203 (2013).
- Ren, H., Chen, J., Wang, Y., Zhang, S., Zhang, B. Intracerebral neural stem cell transplantation improved the auditory of mice with presbycusis. Int. J. Clin. Exp. Pathol. 6 (2), 230-241 (2013).
- Sinclair, S. R., Fawcett, J. W., Dunnett, S. B. Dopamine cells in nigral grafts differentiate prior to implantation. Eur. J. Neurosci. 11 (12), 4341-4348 (1999).
- Tate, C. C., Shear, D. A., Stein, D. G., Tate, M., LaPlaca, M. C., Archer, D. R. Laminin and fibronectin scaffolds enhance neural stem cell transplantation into the injured brain. J. Tissue Eng. Regen. Med. 3 (3), 208-217 (2009).
- Yoo, S. J., Kim, J., Lee, C. -. S., Nam, Y. Simple and novel three dimensional neuronal cell culture using a micro mesh scaffold. Exp. Neurobiol. 20 (2), 110-115 (2011).
- Chen, H. I., Jgamadze, D., Serruya, M. D., Cullen, D. K., Wolf, J. A., Smith, D. H. Neural Substrate Expansion for the Restoration of Brain Function. Front. Syst. Neurosci. 10, (2016).
- Cullen, D. K., Wolf, J. A., Vernekar, V. N., Vukasinovic, J., LaPlaca, M. C. Neural tissue engineering and biohybridized microsystems for neurobiological investigation in vitro (Part 1). Crit. Rev. Biomed. Eng. 39 (3), 201-240 (2011).
- Struzyna, L. A., Katiyar, K., Cullen, D. K. Living scaffolds for neuroregeneration. Curr. Opin. Solid State Mater. Sci. 18 (6), 308-318 (2014).
- Ungrin, M. D., Joshi, C., Nica, A., Bauwens, C., Zandstra, P. W. Reproducible, ultra high-throughput formation of multicellular organization from single cell suspension-derived human embryonic stem cell aggregates. PLoS One. 3 (2), (2008).
- Dahotre, N. B., Harimkar, S. . Laser fabrication and machining of materials. , (2008).
- Kutter, J. P., Klank, H., Snakenborg, D. Microstructure fabrication with a CO2 laser system. J. Micromechanics Microengineering. 14 (2), (2004).
- Spicar-Mihalic, P., Houghtaling, J., Fu, E., Yager, P., Liang, T., Toley, B. CO2 laser cutting and ablative etching for the fabrication of paper-based devices. J. Micromechanics Microengineering. 23 (6), (2013).
- Pacifici, M., Peruzzi, F. Isolation and culture of rat embryonic neural cells: a quick protocol. J. Vis. Exp. (63), (2012).
- Cullen, D. K., Gilroy, M. E., Irons, H. R., Laplaca, M. C. Synapse-to-neuron ratio is inversely related to neuronal density in mature neuronal cultures. Brain Res. 1359, 44-55 (2010).
- Huang, J. H., Cullen, D. K., et al. Long-Term Survival and Integration of Transplanted Engineered Nervous Tissue Constructs Promotes Peripheral Nerve Regeneration. Tissue Eng. Part A. 15 (7), 1677-1685 (2009).
- Katiyar, K. S., Winter, C. C., Struzyna, L., Harris, J. P., Cullen, D. K. Mechanical elongation of astrocyte processes to create living scaffolds for nervous system regeneration. J. Tissue Eng. Regan. Med. , (2016).
- Howard, M. A., Baraban, S. C. Synaptic integration of transplanted interneuron progenitor cells into native cortical networks. J. Neurophysiol. 116 (2), 472-478 (2016).
- Wernig, M., Benninger, F., et al. Functional Integration of Embryonic Stem Cell-Derived Neurons In Vivo. J. Neurosci. 24 (22), 5258-5268 (2004).
- Ganguly, K., Poo, M. Activity-dependent neural plasticity from bench to bedside. Neuron. 80 (3), 729-741 (2013).
- Dancause, N. Extensive Cortical Rewiring after Brain Injury. J. Neurosci. 25 (44), 10167-10179 (2005).
- Winter, C. C., Katiyar, K. S., et al. Transplantable living scaffolds comprised of micro-tissue engineered aligned astrocyte networks to facilitate central nervous system regeneration. Acta Biomater. 38, 44-58 (2016).
- Adewole, D. O., Serruya, M. D., et al. The Evolution of Neuroprosthetic Interfaces. Crit. Rev. Biomed. Eng. 44 (1-2), 123-152 (2016).
- Cullen, D. K., Patel, A., Doorish, J. F., Smith, D. H., Pfister, B. J. Developing a tissue-engineered neural-electrical relay using encapsulated neuronal constructs on conducting polymer fibers. J. Neural Eng. 5 (4), 374-384 (2008).
- Cullen, D. K., Stabenfeldt, S. E., Simon, C. M., Tate, C. C., LaPlaca, M. C. In Vitro Neural Injury Model for Optimization of Tissue-Engineered Constructs. J. Neurosci. Res. 85, 3642-3651 (2007).
- Irons, H. R., Cullen, D. K., Shapiro, N. P., Lambert, N. A., Lee, R. H., Laplaca, M. C. Three-dimensional neural constructs: a novel platform for neurophysiological investigation. J. Neural Eng. 5 (3), 333-341 (2008).
- Morrison, B. I., Cullen, D. K., LaPlaca, M. In Vitro Models for Biomechanical Studies of Neural Tissues. Stud. Mechanobiol. Tissue Eng. Biomater. 3, 247-285 (2011).
- Vukasinovic, J., Cullen, D. K., Laplaca, M. C., Glezer, A. A microperfused incubator for tissue mimetic 3D cultures. Biomed. Microdevices. 11 (6), 1155-1165 (2009).
- Cullen, D. K., Lessing, M. C., Laplaca, M. C. Collagen-dependent neurite outgrowth and response to dynamic deformation in three-dimensional neuronal cultures. Ann. Biomed. Eng. 35 (5), 835-846 (2007).
- LaPlaca, M. C., Vernekar, V. N., Shoemaker, J. T., Cullen, D. K. Three-dimensional neuronal cultures. Methods Bioeng. 3D Tissue Eng. , (2010).
- Chwalek, K., Tang-Schomer, M. D., Omenetto, F. G., Kaplan, D. L. In vitro bioengineered model of cortical brain. Nat. Protoc. 10 (9), 1362-1373 (2015).

