酶联反应合成 l-赖氨酸手性氨基醇的研究
Summary
手性氨基醇是在有机合成中用作支架的多功能分子。从 l-赖氨酸开始, 用酶催化的酶联反应合成氨基醇, 然后将相应羟基氨基酸的羧酸基团 diastereoselective羧.
Abstract
氨基醇是具有广泛应用范围的多功能化合物。例如, 它们在有机合成中被用作手性支架。它们通过常规有机化学合成通常需要繁琐的多步法合成过程, 难以控制立体化学结果。我们提出了一个协议, 酶合成氨基醇开始从现成的 l-赖氨酸在48小时。该协议结合了两种化学反应, 这是很难进行常规有机合成。在第一步, diastereoselective 氧化处于草稿的赖氨酸侧链的 c-H 键, 由酶催化;regiodivergent 酶催化的第二个 diastereoselective 氧化作用可能导致 12-二醇的形成。在最后一步, 阿尔法氨基酸的羧酸组被吡哆醛磷酸脱羧酶 (DC) 所劈裂。这一 decarboxylative 步骤只影响氨基酸的α碳, 保留羟基取代 stereogenic 中心在β/伽玛位置。由此产生的氨基醇因此光学上丰富。该协议成功地应用于四氨基醇的 semipreparative 级合成。采用高效液相色谱 (HPLC) 对 1-氟-24-硝基苯进行衍生反应监测。固相萃取 (SPE) 直接纯化, 为氨基醇提供了优良的产量 (93% 至 > 95%)。
Introduction
尽管生物催化提供了好处, 催化步骤在合成通路或总催化路线中的整合仍然主要限于酶动力学的决议。这些路线被广泛地用作不对称的化学酶合成的第一步, 但生物催化在功能组 interconversions 中提供了更多的可能性高立体选择性 1, 2, 3.此外, 由于催化反应是在类似的条件下进行的, 因此在一壶式的4,5中执行级联反应是可行的。
手性氨基醇是在有机合成中用作辅助剂或支架的多功能分子6。氨基醇基团经常见于次生代谢物和活性药物成分 (API)。通过常规的化学合成, 可以从相应的α氨基酸中获得初级β氨基醇, 但接触手性γ氨基醇或二次氨基醇通常需要繁琐的合成通路以及敏感控制立体7,8,9,10。由于其高立体选择性, 生物催化可能提供了一个优越的合成路线, 这些手性构建块 11, 12, 13, 14.
我们以前报告了由铁 (II)/α ketoacid 依赖氧合酶家族 (αKAO) (图 1)15dioxygenases 催化的 diastereoselective 酵素羟基化合成单羟基-l-lysines。特别是, 从 l-赖氨酸开始, KDO1 酶催化形成 (3S)-羟基衍生物 (1), 而 (4R)-衍生物 (2) 由反应形成与 KDO2 酶。连续的 regiodivergent hydroxylations 由 KDO1 和 KDO2 导致形成 (3r, 4r)-二羟基-l-赖氨酸 (3) 在光学上纯净的形式。然而, 这些酶的有限基底范围阻碍了它们在化学合成中的大量使用, 特别是在简单胺的羟基化中, 因为在氨基基团α位置的羧酸基团对于活动16是必不可少的。
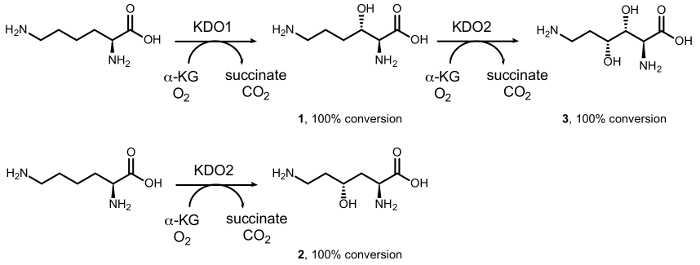
图 1: l-赖氨酸的催化转换.转换成 (3S)-羟基-l-赖氨酸 (1) 由 KDO1 酶催化;(4R)-羟基-l-赖氨酸 (2) 由 KDO2 酶催化;和 (3r, 4R)-二羟基-l-赖氨酸 (3) 由 KDO1 和 KDO2 dioxygenases 连续催化的级联反应。请单击此处查看此图的较大版本.
脱羧反应是新陈代谢的一个共同的反应17。特别是, 氨基酸 DCs (EC 4.1.1) 是无余子的 (pyruvoyl 依赖) 或与进工党相关的酶, 并催化氨基酸脱羧反应到相应多胺的细菌和更高的有机体18, 19,20,21,22. 单和二羟基化合物 (图 3) 4–7, 10–11对应于羟基尸胺, 由 l-赖氨酸脱羧反应获得的二胺。尸胺是化学工业的关键构件, 特别是它是聚酰胺和聚氨酯聚合物的组成部分。因此, 从可再生资源中以生物为基础生产这二胺, 已引起人们的注意, 作为一种替代石油的途径, 并为此目的设计了各种微生物。在这些代谢通路中, 赖氨酸 DC (最不发达国家) 是关键酶。土发公司是属于丙氨酸 racemase (AR) 结构家族23的一项与工党相关的酶。与工党相关的 dcs (进工党-dcs) 被称为高度基底特异。然而, 一些酶拥有轻微的滥交的能力, 积极地对 l-鸟氨酸和 l-赖氨酸氨基酸, 例如土发公司从Selenomonas rumirantium (最不发达国家的Srum), 有相似的动力学常数为赖氨酸和鸟氨酸脱羧反应24, 25.这种扩展的基质特异性使这种酶成为一个良好的候选脱羧反应的单和二羟基-l-赖氨酸。此外, 为了找到对赖氨酸羟基衍生物有积极作用的 DCs, 我们研究了αKAO 酶编码基因的遗传学背景。事实上, 在原核基因组中, 同一生物合成通路中所涉及的酶的基因在基因簇中通常是相互定位的。KDO2 (从Chitinophaga pinensis) 基因被发现与一个基因编码的假定的中工党 (图 2) 联合本地化。相比之下, 在分析 KDO1 酶的基因组背景时, 没有发现 DC 的基因编码。因此, 从C. pinensis (dcCpin) 中的中进-dc 蛋白被选为一个有希望的候选分子, 以催化级联反应的脱羧反应步骤。
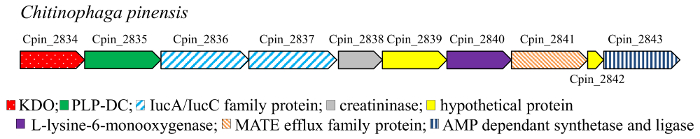
图 2: KDO2 基因的基因组上下文C. pinensis.请单击此处查看此图的较大版本.
因此, 我们设计了涉及 dioxygenases 和 DCs 的酶联反应, 以实现从氨基酸中合成脂肪族手性β和γ氨基醇 (图 3)。如前所述, αKAO 催化的 C H 氧化反应引入了全 diastereoselectivity 的羟基取代 stereogenic 中心;Cβ/γ手性将保留在 decarboxylative 步骤, 这只影响 cα-cα碳的氨基酸基团16。
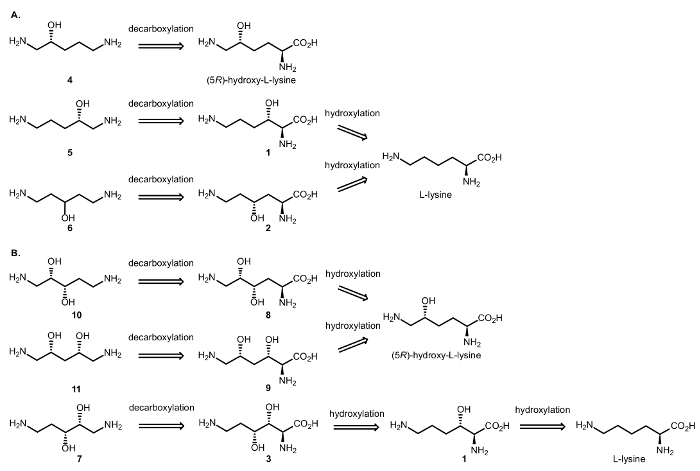
图 3: Retrosynthetic 分析.(A) Retrosynthesis β和γ氨基醇 (R)-15-diaminopentan-2-ol (4) (5R)-羟基-l-赖氨酸, 并且 (S)-15-diaminopentan-2 ol (5) 和 15-diaminopentan-3 ol (6) 从l-赖氨酸。(B) Retrosynthesis β、γ和β、δ氨基二醇 (2 S, 3S)-15-diaminopentane-23-二醇 (10) 和 (2R, 4S)-15-diaminopentane-24-二醇 (11) 从 (5R) 开始-羟基-l-赖氨酸和 (2r, 3r)-15-diaminopentane-23-二醇 (7) 从 l-赖氨酸开始。请单击此处查看此图的较大版本.
从 l-赖氨酸及其 (5R)-羟基衍生物开始, 本文报告了两个/三步, 一锅, 酶法结合 dioxygenases 和进工党-DCs, 以获得目标氨基醇。在靶分子的实验室尺度合成之前, 该方法是在分析尺度上发展起来的, 以调整反应条件,例如, 酶浓度, 要求允许完全转化的起始材料;我们也提出这个程序。
Protocol
Representative Results
Discussion
手性氨基醇和衍生物具有广泛的应用范围, 从手学助剂到有机合成到药物治疗。常规有机合成制备氨基醇的多步法合成方法很多, 但由于繁琐的保护/脱步骤以及对立体16的敏感控制, 可能并不总是有效的。一个催化的方法, 免除了保护/脱步骤, 通常是高度立体是一个很好的选择。
以往的研究报告了通过动态动力学不对称转化 (DYKAT) 合成各种β氨基醇的 2-phenyletha…
Declarações
The authors have nothing to disclose.
Acknowledgements
作者感谢 Véronique de Berardinis 为卓有成效的讨论和阿兰佩雷, 克里斯汀 Pellé和佩奇 Sirvain 的技术支持。
Materials
| HEPES | Sigma Aldrich | H3375 | |
| L-lysine hydrochloride | Sigma Aldrich | L5626 | |
| (5S)-hydroxy-L-lysine | Sigma Aldrich | GPS NONH | Out sourcing |
| α-ketoglutaric acid | Sigma Aldrich | 75892 | |
| Sodium ascorbate | Sigma Aldrich | A7631 | |
| Ammonium Iron(II) sulfate hexahydrate | Acros | 201370250 | |
| Pyridoxal phosphate (PLP) | Sigma Aldrich | 82870 | |
| 3,4-dimercaptobutane-1,2-diol (DTT) | Sigma Aldrich | D0632 | |
| 1-fluoro-2,4-dinitrobenzene (DNFB) | Sigma Aldrich | D1529 | |
| Ethanol | VWR | 20825.290 | |
| Sodium hydrogen carbonate | Sigma Aldrich | 71631 | |
| HCl 37% | Sigma Aldrich | 435570 | |
| HCl 0.1M | Fluka | 35335 | |
| Acetonitrile HiPerSolv CHROMANORM for LC-MS | VWR | 83640.320 | |
| 2,2,2-trifluoroacetic acid | VWR | 153112E | |
| Ammonia 28% | VWR | 21182.294 | |
| Methanol HiPerSolv CHROMANORM for LC-MS | VWR | 83638.32 | |
| Formic acid | Acros | 270480010 | |
| Phosphoric acid 85% | Acros | 201145000 | |
| Deuterium oxide | Acros | 320,710,075 | |
| NaOH | Sigma Aldrich | S5881 | |
| C18 HPLC column | Phenomenex | 00F-4601-Y0 | |
| Accela UHPLC System | ThermoFisher Scientific | ||
| Accela PDA detector | ThermoFisher Scientific | ||
| 4mm syringe filters – 0,22µm – PVDF | Merck | SLGVR04NL | |
| Single-use tuberculin syringe with ml graduation, Luer tip | VWR | HSWA5010.200V0 | |
| Cation exchange resin 100-200 mesh | Sigma Aldrich | 217506 | |
| Mixed mode cation-exchange solid-phase extraction cartridge 6 mL | Waters | 186000776 | |
| Extraction manifold | Waters | WAT200609 | |
| Rotary evaporator | Büchi | 531-0103 | |
| Lyophilizer alpha 1-2 LDplus | Christ | L083302 | |
| Micropipette 20 µL | Eppendorf | 3121000031 | |
| Micropipette 100 µL | Eppendorf | 3121000074 | |
| Micropipette 500 µL | Eppendorf | 3121000112 | |
| Micropipette 1000 µL | Eppendorf | 3121000120 | |
| 300 MHz spectrometer | Bruker | ||
| 2 mL microtube | CLEARLine | CL20.002.0500 | |
| 50 mL conical-bottom centrifuge tube | Fischer Scientific | 05-539-8 | |
| 25 mL round-bottom flask 14/23 | Fischer Scientific | 10353331 | |
| 100 mL round-bottom flask 29/32 | Fischer Scientific | 11786183 | |
| 250 mL round-bottom flask 29/32 | Fischer Scientific | 11786183 | |
| 250 mL erlenmeyer flask | Fischerbrand | 15496143 |
Referências
- Nestl, B. M., Hammer, S. C., Nebel, B. A., Hauer, B. New Generation of Biocatalysts for Organic Synthesis. Ang. Chem. Int. Ed. 53 (12), 3070-3095 (2014).
- Reetz, M. T. Biocatalysis in Organic Chemistry and Biotechnology: Past, Present, and Future. J. Am. Chem. Soc. 135 (34), 12480-12496 (2013).
- Turner, N. J., O’Reilly, E. Biocatalytic retrosynthesis. Nat. Chem. Biol. 9 (5), 285-288 (2013).
- Oroz-Guinea, I., Garcia-Junceda, E. Enzyme catalysed tandem reactions. Curr. Opin. Chem. Biol. 17 (2), 236-249 (2013).
- Ricca, E., Brucher, B., Schrittwieser, J. H. Multi-Enzymatic Cascade Reactions: Overview and Perspectives. Adv. Syn. Catal. 353 (13), 2239-2262 (2011).
- Ager, D. J., Prakash, I., Schaad, D. R. 1,2-Amino Alcohols and Their Heterocyclic Derivatives as Chiral Auxiliaries in Asymmetric Synthesis. Chem. Rev. 96 (2), 835-876 (1996).
- Abiko, A., Masamune, S. An improved, convenient procedure for reduction of amino acids to aminoalcohols: Use of NaBH4-H2SO4. Tet. Lett. 33 (38), 5517-5518 (1992).
- McKennon, M. J., Meyers, A. I., Drauz, K., Schwarm, M. A convenient reduction of amino acids and their derivatives. J. Org. Chem. 58 (13), 3568-3571 (1993).
- Singh, P., Samanta, K., Das, S. K., Panda, G. Amino acid chirons: a tool for asymmetric synthesis of heterocycles. Org. Biomol. Chem. 12 (33), 6297-6339 (2014).
- Colomer, I., et al. Aminomethylhydroxylation of alkenes: Exploitation in the synthesis of scaffolds for small molecule libraries. Bioorg. Med. Chem. 23 (11), 2736-2740 (2015).
- Steinreiber, J., et al. Synthesis of Aromatic 1,2-Amino Alcohols Utilizing a Bienzymatic Dynamic Kinetic Asymmetric Transformation. Adv. Syn. Catal. 349 (8-9), 1379-1386 (2007).
- Steinreiber, J., et al. Overcoming Thermodynamic and Kinetic Limitations of Aldolase-Catalyzed Reactions by Applying Multienzymatic Dynamic Kinetic Asymmetric Transformations. Ang. Chem. Int. Ed. 46 (10), 1624-1626 (2007).
- Kohls, H., et al. Selective Access to All Four Diastereomers of a 1,3-Amino Alcohol by Combination of a Keto Reductase- and an Amine Transaminase-Catalysed Reaction. Adv. Syn. Catal. 357 (8), 1808-1814 (2015).
- Sehl, T., Maugeri, Z., Rother, D. Multi-step synthesis strategies towards 1,2-amino alcohols with special emphasis on phenylpropanolamines. J. Mol. Cat. B: Enzymatic. 114, 65-71 (2015).
- Martinez, S., Hausinger, R. P. Catalytic Mechanisms of Fe(II)- and 2-Oxoglutarate-dependent Oxygenases. J. Biol. Chem. 290 (34), 20702-20711 (2015).
- Baud, D., et al. Synthesis of Mono‐and Dihydroxylated Amino Acids with New α‐Ketoglutarate‐Dependent Dioxygenases: Biocatalytic Oxidation of C-H Bonds. ChemCatChem. , (2014).
- Suzuki, H., Kurihara, S., Kusano, T., Suzuki, H. Ch. 4. Polyamines. 4, 47-59 (2015).
- Kind, S., Wittmann, C. Bio-based production of the platform chemical 1,5-diaminopentane. Appl. Microbiol. Biotechnol. 91 (5), 1287-1296 (2011).
- Schneider, J., Wendisch, V. F. Biotechnological production of polyamines by bacteria: recent achievements and future perspectives. Appl. Microbiol. Biotechnol. 91 (1), 17-30 (2011).
- Qian, Z. -. G., Xia, X. -. X., Lee, S. Y. Metabolic engineering of Escherichia coli for the production of cadaverine: A five carbon diamine. Biotechnol. Bioeng. 108 (1), 93-103 (2011).
- Shin, J. H., Lee, S. Y. Metabolic engineering of microorganisms for the production of L-arginine and its derivatives. Microb. Cell. Fact. 13, (2014).
- Nguyen, A., Schneider, J., Reddy, G., Wendisch, V. Fermentative Production of the Diamine Putrescine: System Metabolic Engineering of Corynebacterium Glutamicum. Metabolites. 5 (2), 211 (2015).
- Kidron, H., Repo, S., Johnson, M. S., Salminen, T. A. Functional Classification of Amino Acid Decarboxylases from the Alanine Racemase Structural Family by Phylogenetic Studies. Mol. Biol. Evol. 24 (1), 79-89 (2007).
- Takatsuka, Y., Onoda, M., Sugiyama, T., Muramoto, K., Tomita, T., Kamio, Y. Novel Characteristics of Selenomonas ruminantium Lysine Decarboxylase Capable of Decarboxylating Both L-Lysine and L-Ornithine. Biosci. Biotechnol. Biochem. 63 (6), 1063-1069 (1999).
- Takatsuka, Y., Tomita, T., Kamio, Y. Identification of the Amino Acid Residues Conferring Substrate Specificity upon Selenomonas ruminantium Lysine Decarboxylase. Biosci. Biotechnol. Biochem. 63 (10), 1843-1846 (1999).
- Baud, D., et al. Biocatalytic Approaches towards the Synthesis of Chiral Amino Alcohols from Lysine: Cascade Reactions Combining alpha-Keto Acid Oxygenase Hydroxylation with Pyridoxal Phosphate- Dependent Decarboxylation. Adv. Syn. Catal. 359 (9), 1563-1569 (2017).
- Ilisz, I., Berkecz, R., Peter, A. Application of chiral derivatizing agents in the high-performance liquid chromatographic separation of amino acid enantiomers: a review. J. Pharm. Biomed. Anal. 47 (1), 1-15 (2008).
- . Organic Chemistry. Nuclear Magnetic Resonance (NMR) Spectroscopy Available from: https://www.jove.com/science-education/5680/nuclear-magnetic-resonance-nmr-spectroscopy (2017)
- Hibi, M., Ogawa, J. Characteristics and biotechnology applications of aliphatic amino acid hydroxylases belonging to the Fe(II)/alpha-ketoglutarate-dependent dioxygenase superfamily. Appl. Microbiol. Biotechnol. 98 (9), 3869-3876 (2014).
- Hüttel, W. Biocatalytic Production of Chemical Building Blocks in Technical Scale with α-Ketoglutarate-Dependent Dioxygenases. Chem. Ing. Tec. 85 (6), 809-817 (2013).
- Kourist, R., Guterl, J. -. K., Miyamoto, K., Sieber, V. Enzymatic Decarboxylation-An Emerging Reaction for Chemicals Production from Renewable Resources. ChemCatChem. 6 (3), 689-701 (2014).
- Lee, J., Michael, A. J., Martynowski, D., Goldsmith, E. J., Phillips, M. A. Phylogenetic diversity and the structural basis of substrate specificity in the beta/alpha-barrel fold basic amino acid decarboxylases. J. Biol. Chem. 282 (37), 27115-27125 (2007).
- Porter, J. L., Rusli, R. A., Ollis, D. L. Directed Evolution of Enzymes for Industrial Biocatalysis. ChemBiochem. 17 (3), 197-203 (2016).

