Titrage ELISA comme une méthode pour déterminer la constante de Dissociation de l’Interaction Ligand du récepteur
Summary
Un protocole détaillé pour effectuer un titrage ELISA est décrite. En outre, un nouvel algorithme est présenté afin d’évaluer le titrage des tests ELISA et d’obtenir une constante de dissociation de liaison d’un ligand soluble à un récepteur immobilisée plaque de microtitration.
Abstract
La constante de dissociation décrit l’interaction entre les deux partenaires dans l’équilibre de liaison et est une mesure de leur affinité. C’est un paramètre crucial pour comparer différents ligands, par exemple, des inhibiteurs compétitifs, isoformes protéiques et mutants, pour leur force de la liaison à un partenaire de liaison. Constantes de dissociation sont déterminés en fonction des concentrations de lié contre ligand libre comme les courbes de liaison. En revanche, les courbes de titration, dans lequel un signal qui est proportionnel à la concentration de ligand lié est comploté contre la concentration totale de ligand ajouté, sont beaucoup plus faciles à enregistrer. Le signal peut être détecté par spectroscopie et par dosage immunoenzymatique (ELISA). Ceci est illustré dans un protocole pour un titrage ELISA qui mesure la liaison de la rhodocetin dérivé de venin de serpent à son domaine cible immobilisé de l’intégrine α2β1. Titrage des tests ELISA sont polyvalents et largement utilisé. N’importe quelle paire de protéines qui interagissent utilisable comme récepteur immobilisé et ligand soluble, pourvu que les deux protéines sont purs, et leurs concentrations sont connues. Jusqu’à présent, la difficulté a été de déterminer la constante de dissociation d’une courbe de titrage. Dans cette étude, une fonction mathématique qui sous-tend les courbes de titrage est introduite. Sans aucune estimation Erreurs graphique d’un rendement de saturation, cet algorithme permet le traitement des données brutes (intensité de signal à différentes concentrations du ligand ajouté) directement par l’évaluation mathématique par régression non linéaire. Ainsi, plusieurs courbes de titration peuvent être enregistrés simultanément et transformés en un ensemble de paramètres caractéristiques, dont la constante de dissociation et la concentration de liaison active du récepteur, et elles peuvent être évaluées statistiquement. Lorsqu’il est combiné avec cet algorithme, titrage ELISA bénéficier de l’avantage de présenter directement la constante de dissociation. Donc, ils peuvent être utilisés plus efficacement dans l’avenir.
Introduction
La constante de dissociation K est un paramètre clé pour décrire l’affinité d’un récepteur (R) pour son ligand (L). Se fondant sur la Loi d’action de masse, K est défini pour l’équilibre, dans lequel la RL complexe récepteur-ligand dissocie le récepteur R et le ligand l :
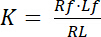 Équation 1
Équation 1
avec les indices f indiquant l’État libre/non consolidé de récepteurs et ligands. La concentration du complexe récepteur-ligand, RL, est identique à la concentration de ligand lié aux récepteurs Lb. Comme la concentration totale de récepteur Rt est la somme du récepteur libre Rf et liaison ligand du récepteur Rb = Lb, la constante de dissociation peut également s’écrire :
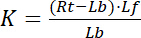 Équation 2
Équation 2
Par conséquent, la saturation rendement Y, définie comme la fraction de ligand lié Lb en fonction de la concentration totale de récepteur Rt,
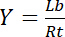 Équation 3
Équation 3
dépend de la concentration de ligand libre Lf:
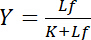 Équation 4
Équation 4
Cette relation hyperbolique décrit la courbe de liaison d’une interaction ligand-récepteur et son intrigue montre la concentration de ligand lié Lb en fonction de la concentration de ligand libre Lf. De la courbe de liaison, la constante de dissociation K peut être dérivée comme la concentration de ligand libre au rendement de saturation maximale. En outre, différents algorithmes de linéariser les courbes de liaison ont été établis, tels que le tracé à double réciprocité par Klotz1,2, ou des transformations selon Scatchard ou Hanes (évaluée par Bisswanger3). Cependant, tous les algorithmes souffrent du problème que le rendement de saturation, qui l’on approche asymptotiquement à des concentrations élevées de ligand libre dans la courbe de liaison, la valeur maximale doit être estimée dans une pré-évaluation graphique et est donc sujette aux erreurs.
En outre, la détermination d’une courbe de liaison nécessite la quantification du ligand libre et liée au cours de l’équilibre de liaison. À cette fin, le ligand libre doit être séparé du ligand lié aux récepteurs et quantifiée. Par conséquent, le ligand et le récepteur doivent se distinguent par leurs propriétés, comme un ligand non protéique par opposition à un récepteur de protéine. Si les deux partenaires de liaison sont des protéines, ils doivent être distingués dans leurs tailles, frais ou autres caractéristiques moléculaires. Néanmoins, la quantification des concentrations de ligand dans les approches contraignantes à petite échelle est une tâche difficile. Marquage radioactif du ligand a souvent été nécessaire pour détecter la faible concentration de ligand lié, surtout si des quantités substantielles de récepteurs n’étaient pas disponible ou accessible. En outre, le ligand lié aux récepteurs peut dissocier pendant et après l’isolement d’une manière non négligeable. Par conséquent, les méthodes complexes, tels que l’équilibre gel filtration4, électrophorèse capillaire5et impulsion protéolyse6, sont tenus de quantifier lié aux récepteurs ligand et séparer de ligand libre.
Contrairement à ces essais de liaison, les expériences de titrage ne nécessitent pas la séparation quantitative du ligand lié et libre. À cette fin, un récepteur à une concentration constante est titré avec différentes concentrations de ligand ajouté. En se liant au récepteur, le ligand lié a une propriété biophysique qui distingue le ligand libre et celles-ci sont mesurables selon, par exemple, photométrie, fluorométrie ou détection d’anticorps. Ainsi, un signal S, qui est proportionnelle à la saturation rendement Y et par conséquent aussi à la concentration de ligand lié aux récepteurs (Lb), est détecté en fonction de la concentration totale de ligand ajouté (L,t). Les deux paramètres, le signal S et la concentration totale de ligand ajouté sont quantifiées de manière directe et plus facile que les concentrations du ligand lié et libre. Surtout, la détection du ligand lié aux récepteurs par dosage immunoenzymatique (ELISA) a permis la réduction du volume des échantillons à au-dessous de 100 µL, ainsi que des mesures parallèles de plusieurs concentrations de ligand en microplaques multipuits. Dans un titrage ELISA, un récepteur est physiquement adsorbé sur une plaque de microtitrage à la même concentration et titré par ligand soluble. Le récepteur est immobilisé à la surface en plastique essentiellement par adsorption hydrophobe. La concentration de surface du récepteur immobilisé corrélats avec la concentration de revêtement du récepteur dans une relation non linéaire, probable selon Langmuir´s adsorption isotherme7. Outre le nombre total de molécules adsorbées du récepteur, leur état d’activité est un autre paramètre important pour des dosages de titrage. Seulement immobilisé les récepteurs qui ont conservé l’activité de liaison ligand, sont pertinentes pour la détermination du titrage et éventuellement contribuent à la concentration totale de récepteurs actifs Rt de l’essai de titrage, qui ne peut être déterminée directement.
Sites sur la surface en plastique, qui ne sont pas couverts par le récepteur immobilisé ont tendance à s’adsorber les autres protéines, tels que le ligand. L’adsorption physique du ligand vers ces sites de surface en plastique se traduirait en un signal analogue comme le ligand lié aux récepteurs, mais de façon non spécifique. Pour réduire ce signal non spécifique, les sites de surface en plastique des plaques microtitration qui n’ont pas été enduits de protéine mais seront bloqués avec l’albumine sérique bovine (BSA). Toutefois, pour certains tests de titrage de récepteur-ligand, les signaux de fond non spécifiques peuvent être observées. Ensuite, les autres agents de blocage, comme une solution de gélatine de 0,2 % ou de 0,04 % Tween 20, sont recommandés.
Après liaison au récepteur, le ligand libre est éliminé par deux étapes de lavage. Ligand lié reste avec le récepteur, qui est immobilisé sur la surface en plastique du puits microplaques et éventuellement renforcé par fixation chimique. Pour la suivante Croix-liaison covalente du ligand lié et récepteur immobilisé au glutaraldéhyde, la substance tampon TRIS est remplacée pour HEPES, sans aucune modification de liaison du ligand. HEPES, contrairement aux TRIS, ne pas inactiver glutaraldéhyde. La Croix-liaison covalente au glutaraldéhyde corrige le ligand lié avec son récepteur et empêche sa dissociation au cours des étapes ultérieures de lavage et d’incubation. Ainsi, l’interaction de récepteur-ligand est chimiquement gelée et garantit une courbe de titrage, qui n’est pas affectée par les étapes suivantes de lavage et d’incubation. Cependant, la fixation de glutaraldéhyde peut modifier chimiquement le ligand et le récepteur de telle sorte que leur interaction est réduite ou supprimée. En outre, modification des épitopes dans le ligand peut changer l’affinité de l’anticorps de détection, surtout si un anticorps monoclonal est utilisé pour quantifier le ligand lié. Bien qu’aucun de ces effets indésirables de la fixation de glutaraldéhyde se produit dans ce titrage ELISA, la sensibilité du test vers le glutaraldéhyde seront essayée lors de chaque interaction ligand-récepteur avant l’expérience de titrage. Après fixation, glutaraldéhyde excès est éliminé en trois étapes de lavage avec le tampon TRIS contenant. TRIS inactive groupes aldéhyde restants, qui pourraient réagir de façon non spécifique avec détection d’anticorps dans l’étape ultérieure.
Doser le ligand lié avec des anticorps-enzymatique, qui fournissent un signal photométrique de ELISA S. C’est tracé par rapport à la concentration L de ligand totalt ajouté à chaque puits. Malgré son acquisition plus facile, la courbe de titrage n’est pas une fonction hyperbolique, contrairement à la courbe de liaison. En outre, on sait pas comment calculer la constante de dissociation K d’une courbe de titrage. Bien que les algorithmes de linéariser des courbes de titrage par spectroscopie acquis ont été rapportés indépendamment de Stockell8 et Heyn et Weischet9, ils sont tombés courts en raison de leur incertitude de l’estimation du signal maximum valeur que le rendement de saturation s’approche à des concentrations élevées de ligand ajouté.
Ici, un titrage ELISA et un algorithme de régression non linéaire sont décrits pour calculer la constante de dissociation K d’interaction ligand du récepteur d’une courbe de titrage. Ce protocole est illustré pour l’interaction de l’A-domaine de collagène-fixation de l’intégrine α2β1 avec un inhibiteur de dérivés de venin de serpent. Les intégrines sont des molécules d’adhérence cellulaire, qui négocient l’ancrage des cellules de la matrice extracellulaire environnante ou les membrane basale sous-jacente10,11. Par ailleurs, les intégrines transmettent des signaux importants entre les cellules et la matrice extracellulaire en recrutant d’autres molécules de signalisation et formant de nouveaux organites de la cellule, adhesomes, sur la cellule-matrice interaction12,13, 14. collagène, le ligand de l’intégrine α2β1, est la protéine la plus abondante du corps humain et est une composante cruciale d’échafaudage du tissu conjonctif15. L’interaction entre l’intégrine α2β1 et collagène est médiée par l’A-domaine de la sous-unité α2 de l’intégrine. L’intégrine α2A-domaine contienne un cation divalent, qui est requise pour la liaison de collagène et stabilise sa structure. La forme sauvage, mais aussi les mutants du domaine α2A, telle que celle dans laquelle les résidus de surface exposée Y216 avaient été remplacé pour une glycine, peuvent être facilement produits inoculation dans un système d’expression bactérienne et isolés par l’intermédiaire de leurs oligo-son-tags avec un NiNTA colonne de SuperFlow avec une dialyse ultérieur contre tampon TRIS salin (SCT, 50 mM TRIS/HCl, pH 7,4, NaCl 150 mM), contenant 2 mM MgCl216. Leurs concentrations ont été mesurées avec le dosage d’acide bicinchoninic (BCA) et leur pureté est testées par SDS-PAGE conventionnelle et colorées au bleu de Coomassie-Brilliant Blue R250.
L’interaction entre l’intégrine α2β1 et collagène est bloquée par la liaison de la composante de venin de serpent, rhodocetin, de la Malayan pit viper (Calloselasma rhodostoma)16,17. Utilisé comme un ligand soluble dans ce titrage, ELISA, rhodocetin a été purifiée à partir du pétrole brut venin comme décrit plus haut16. Il est dissous dans une solution saline tamponnée HEPES (HBS ; 10 mM HEPES/NaOH, pH 7,4, NaCl 150 mM) et est conservé congelés à-20 ° C. Sa concentration a été déterminée par BCA et sa pureté a été prouvée par SDS-PAGE. Comme antagoniste, rhodocetin bloque non seulement collagène liant à l’intégrine α2β1 A-domaine, mais aussi se stabilise la conformation inactive de l’intégrine, empêchant ainsi toute signalisation de collagène dans les cellules ou les plaquettes sanguines18. Il est d’une grande importance biomedical pour déterminer la constante de dissociation de rhodocetin avec son objectif de récepteur et ainsi éclaircir son mécanisme moléculaire et pharmaceutiques potentiels par exemple, un agent antithrombotique. À cette fin, un titrage ELISA est décrite, y compris son évaluation, qui s’applique à presque n’importe quelle interaction de récepteur-ligand avec une stoechiométrie d’interaction 1:1.
Protocol
Representative Results
Discussion
Le titrage ELISA est un système polyvalent de test afin de déterminer la dissociation d’une interaction de récepteur-ligand. Comme le titrage ELISA contourne la nécessité de distinguer nettement les ligands libres et liées et d’analyser leurs concentrations quantitativement, sensiblement plus d’études et de publications ont employé le titrage ELISA au lieu d’enregistrer des courbes de liaison . En outre, titrage ELISA sont faciles à effectuer et ont besoin de quantités relativement basses des récepteur…
Declarações
The authors have nothing to disclose.
Acknowledgements
Le protocole et l’algorithme ont été développés au sein d’un projet financé par la Deutsche Forschungsgemeinschaft (DFG grant SFB1009 A09 et EB177/13-1). L’auteur remercie Barbara Schedding et Felix Schmalbein pour le support technique et Dr Niland pour la lecture critique du manuscrit.
Materials
| TRIS | neoFrox | 1125KG001 | |
| HEPES | Sigma-Aldrich | H4034 | |
| NaCl | Applichem | 1,316,591,214 | |
| MgCl2 | Merck | 172571 | |
| integrin a2A, wild-type and mutant, recombinant | isolated in author's lab | ||
| NiNTA superflow column | Qiagen, Germany | 30821 | |
| Coomassie-Brilliant Blue R250 | Serva | 35050 | |
| bicinchoninic acid assay (BCA), protein concentration determination kit | Fisher Scientific | 23225 | |
| bovine serum albumine (BSA), fraction V | Applichem | A1391 | |
| 25 % solution of glutaraldehyde | Merck | 354400 | |
| anti-rabbit immunglobulin-antibodies from goat, conjugated with alkaline phosphatase | Sigma-Aldrich | A9919 | |
| Glycine | Applichem | A1377 | |
| Zn(II)-acetate | Applichem | A4324 | |
| NaOH | Applichem | A1551 | |
| Alkaline phosphatase substrate tablet (5 mg) | Sigma-Aldrich | S0942 | |
| Costar half-area microtiter plate | Thermo Scientific | Corning 3690 | |
| micro reaction tubes | Eppendorf | 30120086 | |
| Microplate ELISA reader | BioTek | Synergy HT |
Referências
- Klotz, I. M. The application of the law of mass action to binding by proteins; interactions with calcium. Arch Biochem. 9, 109-117 (1946).
- Klotz, I. M. Ligand-receptor complexes: origin and development of the concept. J Biol Chem. 279 (1), 1-12 (2004).
- Bisswanger, H. Ch. 1: Multiple Equilibria, Principles and Derivations. Enzyme Kinetics: Principles and Methods. , 1-26 (2017).
- Shimura, K., Kasai, K. Affinity gel titration: quantitative analysis of the binding equilibrium between immobilized protein and free ligand by a continuous titration procedure. Anal Biochem. 149 (2), 369-378 (1985).
- Gong, M., Nikcevic, I., Wehmeyer, K. R., Limbach, P. A., Heineman, W. R. Protein-aptamer binding studies using microchip affinity capillary electrophoresis. Electrophoresis. 29 (7), 1415-1422 (2008).
- Hanes, M. S., Ratcliff, K., Marqusee, S., Handel, T. M. Protein-protein binding affinities by pulse proteolysis: application to TEM-1/BLIP protein complexes. Protein Sci. 19 (10), 1996-2000 (2010).
- Latour, R. A. The Langmuir isotherm: a commonly applied but misleading approach for the analysis of protein adsorption behavior. J Biomed Mater Res A. 103 (3), 949-958 (2015).
- Stockell, A. The binding of diphosphopyridine nucleotide by yeast glyceraldehyde-3-phosphate dehydrogenase. J Biol Chem. 234 (5), 1286-1292 (1959).
- Heyn, M. P., Weischet, W. O. Circular dichroism and fluorescence studies on the binding of ligands to the α subunit of tryptophan synthase. Biochem. 14 (13), 2962-2968 (1975).
- Campbell, I. D., Humphries, M. J. Integrin structure, activation, and interactions. Cold Spring Harb Perspect Biol. 3 (3), (2011).
- Zeltz, C., Gullberg, D. The integrin-collagen connection–a glue for tissue repair?. J Cell Sci. 129 (4), 653-664 (2016).
- Kanchanawong, P., et al. Nanoscale architecture of integrin-based cell adhesions. Nature. 468 (7323), 580-584 (2010).
- Luo, B. H., Carman, C. V., Springer, T. A. Structural basis of integrin regulation and signaling. Annu Rev Immunol. 25, 619-647 (2007).
- Luo, B. H., Springer, T. A. Integrin structures and conformational signaling. Curr Opin Cell Biol. 18 (5), 579-586 (2006).
- Ricard-Blum, S. The collagen family. Cold Spring Harb Perspect Biol. 3 (1), a004978 (2011).
- Eble, J. A., Tuckwell, D. S. The α2β1 integrin inhibitor rhodocetin binds to the A-domain of the integrin α2 subunit proximal to the collagen-binding site. Biochem J. 376 (Pt 1), 77-85 (2003).
- Eble, J. A., et al. The α2β1 integrin-specific antagonist rhodocetin is a cruciform, heterotetrameric molecule. FASEB J. 23 (9), 2917-2927 (2009).
- Eble, J. A., et al. Dramatic and concerted conformational changes enable rhodocetin to block α2β1 integrin selectively. PLoS Biol. 15 (7), e2001492 (2017).
- Bracht, T., Figueiredo de Rezende, F., Stetefeld, J., Sorokin, L. M., Eble, J. A. Monoclonal antibodies reveal the alteration of the rhodocetin structure upon α2β1 integrin binding. Biochem J. 440 (1), 1-11 (2011).
- Harlow, E., Lane, D. Chapter 5: Immunizations. Antibodies, a laboratory manual. 5, 53-138 (1988).
- Lu, D. Analyzing interactions between SSB and proteins by the use of fluorescence anisotropy. Methods Mol Biol. 922, 155-159 (2012).
- Fielding, L. NMR methods for the determination of protein-ligand dissociation constants. Curr Top Med Chem. 3 (1), 39-53 (2003).
- Leavitt, S., Freire, E. Direct measurement of protein binding energetics by isothermal titration calorimetry. Curr Opin Struct Biol. 11 (5), 560-566 (2001).
- McDonnell, J. M. Surface plasmon resonance: towards an understanding of the mechanisms of biological molecular recognition. Curr Opin Chem Biol. 5 (5), 572-577 (2001).
- Rich, R. L., Myszka, D. G. Advances in surface plasmon resonance biosensor analysis. Curr Opin Biotechnol. 11 (1), 54-61 (2000).
- Pesquero, N. C., et al. Real-time monitoring and kinetic parameter estimation of the affinity interaction of jArtinM and rArtinM with peroxidase glycoprotein by the electrogravimetric technique. Biosens Bioelectron. 26 (1), 36-42 (2010).
- Scheuermann, T. H., Padrick, S. B., Gardner, K. H., Brautigam, C. A. On the acquisition and analysis of microscale thermophoresis data. Anal Biochem. 496, 79-93 (2016).

