Титрование ELISA как метод, чтобы определить константу диссоциации взаимодействия лигандов рецепторов
Summary
Описан подробный протокол для выполнения титрования ELISA. Кроме того представлен Роман алгоритм оценки титрования ELISAs и получить Константа диссоциации связывание растворимых лигандом микротитровальных рецепторами пластины прикол.
Abstract
Константа диссоциации описывает взаимодействие между двумя партнерами в уравновешении привязки и является мерой их сходства. Это решающее значение параметра для сравнения различных лигандов, например, конкурентные ингибиторы, изоформ белка и мутантов, для прочности их привязки для привязки партнера. Константы диссоциации определяются путем построения концентрации связанных против свободного лиганд как привязки кривых. В отличие от кривых титрования, в которых сигнал, который пропорционален концентрации связанных лигандов заговор против общую концентрацию дополнительной ligand, гораздо проще для записи. Сигнал может быть обнаружен спектроскопически и энзим соединенный assay иммуносорбента (ELISA). Это проявляется в протокол для титрования ELISA измеряет привязки змея яд производные rhodocetin его подвижности конечный домен Интегрин α2β1. Титрование ELISAs универсальным и широко используется. Любая пара взаимодействующих белков может использоваться как иммобилизованных рецепторов и растворимых лиганд, условии, что оба белки являются чистыми, и известны их концентрации. Трудности пока определить константу диссоциации от кривой титрования. В этом исследовании лежащие в основе кривых титрования математическая функция вводится. Без каких-либо ошибок графического оценки доходности насыщения этот алгоритм позволяет обработку необработанных данных (сигнал интенсивности в различных концентрациях дополнительной ligand) непосредственно в математической оценки через нелинейной регрессии. Таким образом несколько кривых титрования могут быть записаны одновременно и превращается в набор характерных параметров, среди них Константа диссоциации и концентрации рецепторов привязки активные, и они могут быть оценены статистически. В сочетании с этим алгоритмом, титрование ELISAs получить преимущество непосредственно представления Константа диссоциации. Таким образом они могут использоваться более эффективно в будущем.
Introduction
Константа диссоциации K является ключевым параметром для описания сродства рецепторов (R) для его лиганда (L). На основе закона о массовых действий, K определяется для равновесия, в котором RL комплекс рецептор лиганд диссоциирует в рецептор R и лигандом L:
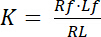 Уравнение 1
Уравнение 1
с показатели f/несвязанные состояние рецепторов и лигандом. Концентрация комплекс рецептор лиганд, RL, идентичен концентрации рецепторов прыгните лигандом Lb. Как общая концентрация рецептор Rt сумма свободного рецептор Rf и лиганд прыгните рецептор Rb = Lb, Константа диссоциации также может быть записана как:
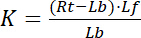 Уравнение 2
Уравнение 2
Таким образом насыщение выход Y, определяется как доля связанных лигандов Lb в отношении общей концентрации рецепторов Rt,
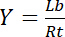 Уравнение 3
Уравнение 3
зависит от концентрации свободного лигандом Lf:
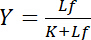 Уравнение 4
Уравнение 4
Это гиперболических отношение описывает кривую привязки рецептор лиганд взаимодействия и его график показывает концентрация связанных лигандов Lb как функция концентрации свободного лигандом Lf. От привязки кривой Константа диссоциации K могут быть получены как концентрация свободного лигандов на половину максимального насыщения урожайности. Кроме того были созданы различные алгоритмы для линеаризации кривых привязки, такие как двойной взаимные сюжет Klotz1,2, или преобразования согласно Scatchard или Хейнс (рассмотрены Bisswanger3). Однако все алгоритмы страдают от этой проблемы, что максимальное значение насыщенности доходности, который асимптотически приближается при высоких концентрациях бесплатные лиганд в кривой привязки, должен оцениваться в графической предварительной оценки и поэтому ошибкам.
Кроме того определение привязки кривой требует количественного определения свободного и связанными лиганда во время привязки равновесия. С этой целью бесплатно лигандом должна быть отделена от лигандов рецепторов прыгните и количественно. Таким образом лигандом и рецептор должны отличаются в их свойств, таких как не протеинового лиганд в отличие от белка рецептора. Если оба партнера привязки являются белки, они должны быть различимы в их размеров, обвинения или другие молекулярные особенности. Тем не менее количественная оценка концентраций лигандов в мелких привязки подходов является трудной задачей. Радиоактивные маркировки лигандом часто необходимо было обнаружить низкой концентрации связанных лигандов, особенно, если значительные количества рецепторов были не доступны или доступным. Кроме того рецептор прыгните лиганд может отмежеваться во время и после изоляции не незначительным образом. Таким образом сложные методы, такие как равновесия гель фильтрации4, капиллярного электрофореза5и импульсный протеолиза6, необходимы для количественной оценки лигандов рецепторов прыгните и отделить его от свободного лиганда.
В отличие от этих анализов привязки титрование эксперименты не требуют количественные разделения связанные и свободные лиганда. С этой целью с различными концентрациями дополнительной ligand является титруют рецепторов при постоянной концентрации. Связываясь с рецепторами, связанных лигандов имеет биофизические свойства, которое отличает его от свободного лиганда и измеримые путем, например, фотометрия, флюометрия или обнаружения антител. Таким образом сигнал S, который пропорциональн к насыщению выход Y и следовательно также концентрации рецепторов прыгните лиганда (Lb), определяется как функция общую концентрацию дополнительной ligand (Lt). Параметры, сигнал S и общую концентрацию дополнительной ligand количественная оценка на основе прямого и проще чем концентрации связанные и свободные лиганда. Особенно обнаружение лигандов рецепторов привязкой, энзим соединенный assay иммуносорбента (ELISA) допускается сокращение объемов выборки для ниже 100 мкл, а также проводить параллельные измерения концентрации нескольких лигандов в нескольких хорошо микротитровальных пластины. При титровании ELISA рецептор физически адсорбированные микротитровальных пластины на такой же концентрации и титруют с растворимых лиганда. Рецептор иммобилизованных на пластиковую поверхность по существу гидрофобные адсорбция. Поверхности концентрация иммобилизованных рецепторов коррелирует с концентрацией покрытие рецептора в нелинейных отношение, скорее всего, по словам изотермы адсорбции Langmuir´s7. В дополнение к общее количество рецепторов адсорбированных молекул их деятельность государства является другим важным параметром для титрования анализов. Только прикол рецепторов, которые сохранили активность Связывание лиганда, актуальны для assay титрования и в конечном итоге способствовать общая концентрация активных рецепторов Rt титрования анализа, которые не могут быть определены непосредственно.
Сайты на пластиковой поверхности, которые не охватываются иммобилизованных рецептор подвержены адсорбировать другие белки, такие как лиганд. Физическая адсорбция лигандом такие пластиковые поверхности сайты приведет в аналогичный сигнал как лигандов рецепторов привязкой, но неспецифических образом. Чтобы уменьшить неспецифических сигнал, пластиковые поверхности сайты микротитровальных пластин, которые не были покрыты с белком, но будет заблокирована с бычьим сывороточным альбумином (БСА). Однако для некоторых анализов титрования рецептор лиганд, может наблюдаться неспецифические фон сигналы. Затем, других блокирующих агентов, таких как раствор 0,2% желатина или 0,04% рекомендуется анимации 20,.
После связывания с рецепторами, свободный лигандом удаляется две стиральные шаги. Связанные лигандом остается с рецепторами, который иммобилизован на пластиковой поверхности хорошо микротитровальных и дополнительно подкрепляется химической фиксации. Для последующих ковалентных кросс связь связанных лигандов и иммобилизованные рецепторов с глютаральдегид содержание буфера TRIS заменяется на HEPES, без каких-либо изменений в Связывание лиганда. HEPES, в отличие от трис, не инактивирует низкотемпературном растворе глютаральдегида. Ковалентный кросс связь с глютаральдегид исправления связанных лигандов с его рецептор и предотвращает ее диссоциации в ходе последующих этапов мойки и инкубации. Таким образом взаимодействие рецептор лиганд химически замораживается и ордеров на кривой титрования, которая не влияет на последующие шаги мытья и инкубации. Однако, глютаральдегид фиксации может химически лиганда и изменить рецептор таким образом, что их взаимодействие снижены или отменены. Кроме того модификация epitopes в лиганд может изменить сродство антитела детектирования, особенно если моноклональное антитело используется для количественного определения связанных лигандов. Хотя ни один из этих побочных эффектов глютаральдегид фиксация происходит в этом титрования ELISA, чувствительность теста к глютаральдегид необходимо проверить каждый рецептор лиганд взаимодействия до титрования эксперимента. После фиксации в трех шагах Стиральная с буфера TRIS-содержащих удаляется избыток глютаральдегид. Трис инактивирует оставшиеся альдегидными группами, которые могут nonspecifically реагируют с обнаружения антител на последующем шаге.
Количество связанных лигандов количественно с энзим соединенный антител, которые обеспечивают фотометрических ELISA сигнала S. Это заговор против всего лигандом концентрация Lt добавил к каждой скважины. Несмотря на его проще приобретения кривая титрования является не гиперболические функции в отличие от кривой привязки. Кроме того он был неясным как рассчитать Константа диссоциации K от кривой титрования. Хотя алгоритмы для линеаризации кривых титрования спектроскопически приобретенных самостоятельно сообщили Стокель8 и9Heyn и Weischet, они потерпели неудачу из-за их неопределенности оценки максимальный сигнал значение насыщенность доходность подходов при высоких концентрациях дополнительной ligand.
Здесь для получения константы диссоциации K для взаимодействия лигандов рецепторов от кривой титрования описаны титрования ELISA и алгоритм нелинейной регрессии. Этот протокол является примером взаимодействия коллаген привязки A-домен Интегрин α2β1 с змея яд производного ингибитора. Интегринов являются молекулы адгезии клеток, которые посредником Анкоридж клеток, окружающих внеклеточная матрица или базовой базальной мембраны10,11. Кроме того интегринов передать важные сигналы между клетками и внеклеточного матрикса путем найма дополнительных сигнальных молекул и формирования новых клеток органеллы, adhesomes, после ячейки матрицы взаимодействия12,13, 14. коллаген, лигандом α2β1 Интегрин, является наиболее распространенным белок, человеческого тела и является компонентом соединительной ткани15важнейших леса. Взаимодействие между α2β1 Интегрин и коллагена при посредничестве A-домен Интегрин α2 субъединицы. Интегрин α2A-домен содержит двухвалентной катион, которая требуется для привязки коллагена и стабилизирует его структуры. Одичал тип формы, а также мутантов α2A домена, как, например, в котором открытые поверхности остатки Y216 были заменены на глицин, легко могут быть произведены recombinantly в системе бактериальной выражения и изолированные через их oligo его метки с NiNTA SuperFlow столбец с последующим диализа против трис амортизированное saline (TBS; 50 мм трис/HCl, рН 7,4, 150 NaCl), содержащий 2 мм MgCl216. Их концентрации были определены с bicinchoninic кислоты assay (BCA) и их чистоты проверены обычных SDS-PAGE и витражи с Бриллиантово-Кумасси синий R250.
Взаимодействие между α2β1 Интегрин и коллаген заблокирован привязки компонента змея яд, rhodocetin,16,Малайский Ямкоголовые (Calloselasma rhodostoma)17. Используется как растворимые лиганд в этом титрования ELISA, rhodocetin был очищен от сырой яд, как описано ранее,16. Он растворяется в HEPES-амортизированное saline (HBS; 10 мм HEPES/NaOH, рН 7,4, 150 мм NaCl) и хранится в замороженном виде при температуре-20 ° C. Его концентрация определяется BCA и его чистоты был доказан SDS-PAGE. Как антагонист, rhodocetin не только блокирует коллагена, привязка к Интегрин α2β1 A-домен, но также стабилизирует неактивной конформации Интегрин, тем самым предотвращая любой сигнализации из коллагена в клетках или тромбоциты18. Это большое биомедицинское значение для определения Константа диссоциации rhodocetin с его целевой рецепторы и таким образом разгадать ее молекулярный механизм и фармацевтический потенциал например, как антитромботические агента. С этой целью, титрование, ELISA описан, включая свою оценку, которая применима к почти любой рецептор лиганд взаимодействие с 1:1 взаимодействия стехиометрии.
Protocol
Representative Results
Discussion
Титрование ELISA является универсальный тест-системы для определения диссоциации рецептор лиганд взаимодействия. Как титрования ELISA обходит необходимость эффективно отделить свободных и связанных лигандов и анализа их концентрации количественно, существенно больше исследований и пуб…
Declarações
The authors have nothing to disclose.
Acknowledgements
Протокол и алгоритм были разработаны в рамках проекта, финансируемого Deutsche Forschungsgemeinschaft (DFG Грант SFB1009 A09 и EB177/13-1). Автор благодарит Барбара Schedding и Феликс Schmalbein для технической поддержки и доктор Ниланд для критически читать рукопись.
Materials
| TRIS | neoFrox | 1125KG001 | |
| HEPES | Sigma-Aldrich | H4034 | |
| NaCl | Applichem | 1,316,591,214 | |
| MgCl2 | Merck | 172571 | |
| integrin a2A, wild-type and mutant, recombinant | isolated in author's lab | ||
| NiNTA superflow column | Qiagen, Germany | 30821 | |
| Coomassie-Brilliant Blue R250 | Serva | 35050 | |
| bicinchoninic acid assay (BCA), protein concentration determination kit | Fisher Scientific | 23225 | |
| bovine serum albumine (BSA), fraction V | Applichem | A1391 | |
| 25 % solution of glutaraldehyde | Merck | 354400 | |
| anti-rabbit immunglobulin-antibodies from goat, conjugated with alkaline phosphatase | Sigma-Aldrich | A9919 | |
| Glycine | Applichem | A1377 | |
| Zn(II)-acetate | Applichem | A4324 | |
| NaOH | Applichem | A1551 | |
| Alkaline phosphatase substrate tablet (5 mg) | Sigma-Aldrich | S0942 | |
| Costar half-area microtiter plate | Thermo Scientific | Corning 3690 | |
| micro reaction tubes | Eppendorf | 30120086 | |
| Microplate ELISA reader | BioTek | Synergy HT |
Referências
- Klotz, I. M. The application of the law of mass action to binding by proteins; interactions with calcium. Arch Biochem. 9, 109-117 (1946).
- Klotz, I. M. Ligand-receptor complexes: origin and development of the concept. J Biol Chem. 279 (1), 1-12 (2004).
- Bisswanger, H. Ch. 1: Multiple Equilibria, Principles and Derivations. Enzyme Kinetics: Principles and Methods. , 1-26 (2017).
- Shimura, K., Kasai, K. Affinity gel titration: quantitative analysis of the binding equilibrium between immobilized protein and free ligand by a continuous titration procedure. Anal Biochem. 149 (2), 369-378 (1985).
- Gong, M., Nikcevic, I., Wehmeyer, K. R., Limbach, P. A., Heineman, W. R. Protein-aptamer binding studies using microchip affinity capillary electrophoresis. Electrophoresis. 29 (7), 1415-1422 (2008).
- Hanes, M. S., Ratcliff, K., Marqusee, S., Handel, T. M. Protein-protein binding affinities by pulse proteolysis: application to TEM-1/BLIP protein complexes. Protein Sci. 19 (10), 1996-2000 (2010).
- Latour, R. A. The Langmuir isotherm: a commonly applied but misleading approach for the analysis of protein adsorption behavior. J Biomed Mater Res A. 103 (3), 949-958 (2015).
- Stockell, A. The binding of diphosphopyridine nucleotide by yeast glyceraldehyde-3-phosphate dehydrogenase. J Biol Chem. 234 (5), 1286-1292 (1959).
- Heyn, M. P., Weischet, W. O. Circular dichroism and fluorescence studies on the binding of ligands to the α subunit of tryptophan synthase. Biochem. 14 (13), 2962-2968 (1975).
- Campbell, I. D., Humphries, M. J. Integrin structure, activation, and interactions. Cold Spring Harb Perspect Biol. 3 (3), (2011).
- Zeltz, C., Gullberg, D. The integrin-collagen connection–a glue for tissue repair?. J Cell Sci. 129 (4), 653-664 (2016).
- Kanchanawong, P., et al. Nanoscale architecture of integrin-based cell adhesions. Nature. 468 (7323), 580-584 (2010).
- Luo, B. H., Carman, C. V., Springer, T. A. Structural basis of integrin regulation and signaling. Annu Rev Immunol. 25, 619-647 (2007).
- Luo, B. H., Springer, T. A. Integrin structures and conformational signaling. Curr Opin Cell Biol. 18 (5), 579-586 (2006).
- Ricard-Blum, S. The collagen family. Cold Spring Harb Perspect Biol. 3 (1), a004978 (2011).
- Eble, J. A., Tuckwell, D. S. The α2β1 integrin inhibitor rhodocetin binds to the A-domain of the integrin α2 subunit proximal to the collagen-binding site. Biochem J. 376 (Pt 1), 77-85 (2003).
- Eble, J. A., et al. The α2β1 integrin-specific antagonist rhodocetin is a cruciform, heterotetrameric molecule. FASEB J. 23 (9), 2917-2927 (2009).
- Eble, J. A., et al. Dramatic and concerted conformational changes enable rhodocetin to block α2β1 integrin selectively. PLoS Biol. 15 (7), e2001492 (2017).
- Bracht, T., Figueiredo de Rezende, F., Stetefeld, J., Sorokin, L. M., Eble, J. A. Monoclonal antibodies reveal the alteration of the rhodocetin structure upon α2β1 integrin binding. Biochem J. 440 (1), 1-11 (2011).
- Harlow, E., Lane, D. Chapter 5: Immunizations. Antibodies, a laboratory manual. 5, 53-138 (1988).
- Lu, D. Analyzing interactions between SSB and proteins by the use of fluorescence anisotropy. Methods Mol Biol. 922, 155-159 (2012).
- Fielding, L. NMR methods for the determination of protein-ligand dissociation constants. Curr Top Med Chem. 3 (1), 39-53 (2003).
- Leavitt, S., Freire, E. Direct measurement of protein binding energetics by isothermal titration calorimetry. Curr Opin Struct Biol. 11 (5), 560-566 (2001).
- McDonnell, J. M. Surface plasmon resonance: towards an understanding of the mechanisms of biological molecular recognition. Curr Opin Chem Biol. 5 (5), 572-577 (2001).
- Rich, R. L., Myszka, D. G. Advances in surface plasmon resonance biosensor analysis. Curr Opin Biotechnol. 11 (1), 54-61 (2000).
- Pesquero, N. C., et al. Real-time monitoring and kinetic parameter estimation of the affinity interaction of jArtinM and rArtinM with peroxidase glycoprotein by the electrogravimetric technique. Biosens Bioelectron. 26 (1), 36-42 (2010).
- Scheuermann, T. H., Padrick, S. B., Gardner, K. H., Brautigam, C. A. On the acquisition and analysis of microscale thermophoresis data. Anal Biochem. 496, 79-93 (2016).

