Titulação ELISA como um método para determinar a constante de dissociação de interação do ligante do Receptor
Summary
Um protocolo detalhado para executar uma titulação ELISA é descrito. Além disso, um algoritmo de romance é apresentado para avaliar a titulação ELISAs e obter uma constante de dissociação de ligação de um ligante solúvel a um receptor de imobilizado-placa de microtitulação.
Abstract
A constante de dissociação descreve a interação entre os dois parceiros em equilíbrio a ligação e é uma medida de sua afinidade. É um parâmetro fundamental para comparar diferentes ligantes, por exemplo, inibidores do competidor, isoformas de proteínas e mutantes, para sua força de ligação a um parceiro de vinculação. Constantes de dissociação são determinados pela plotagem concentrações de limite contra o ligante livre como curvas de ligação. Em contraste, curvas de titulação, em que um sinal que é proporcional à concentração de ligante ligado é plotado contra a concentração total de ligante adicionado, são mais fáceis de gravar. O sinal pode ser detectado espectroscopicamente e por ensaio imunoenzimático (ELISA). Isto é exemplificado em um protocolo para uma titulação ELISA que mede a ligação do rhodocetin derivado de veneno de cobra para seu domínio alvo imobilizado da integrina α2β1. Titulação ELISAs são versáteis e amplamente utilizado. Qualquer par de interação de proteínas pode ser usado como receptor de imobilizado e solúvel ligante, desde que ambas as proteínas são puras, e as respectivas concentrações são conhecidas. Até agora, a dificuldade tem sido determinar a constante de dissociação de uma curva de titulação. Neste estudo, é introduzida uma função matemática subjacente de curvas de titulação. Sem qualquer estimativa propenso gráfica de um rendimento de saturação, este algoritmo permite o processamento dos dados brutos (intensidades de sinal em diferentes concentrações de ligante adicionado) diretamente pela avaliação matemática através de regressão não-linear. Assim, várias curvas de titulação podem ser gravadas simultaneamente e transformadas em um conjunto de parâmetros característicos, entre elas a constante de dissociação e a concentração de vinculação-ativo do receptor, e elas podem ser avaliadas estatisticamente. Quando combinado com este algoritmo, titulação ELISAs ganhar a vantagem de apresentar diretamente a constante de dissociação. Portanto, eles podem ser usados mais eficientemente no futuro.
Introduction
A constante de dissociação K é um parâmetro chave para descrever a afinidade de um receptor (R) para seu ligante (L). Com base na lei de ação das massas, K é definido para o equilíbrio, no qual a RL complexo ligante-receptor dissocia-se para o receptor R e o ligante l:
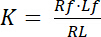 Equação 1
Equação 1
com os índices f indicando o estado livre/desacoplado do receptor e ligante. A concentração do complexo receptor-ligante, RL, é idêntica à concentração do ligante do receptor-limite Lb. Como a concentração total de receptores Rt é a soma do receptor livre Rf e ligados a ligante receptor Rb = Lb, a constante de dissociação também pode ser escrita como:
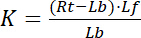 Equação 2
Equação 2
Portanto, a saturação rendimento Y, definido como a fração do limite ligante Lb em relação a concentração total de receptores Rt,
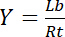 Equação 3
Equação 3
depende da concentração do ligante livre Lf:
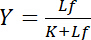 Equação 4
Equação 4
Esta relação hiperbólica descreve a curva de ligação de uma interação receptor-ligante e seu enredo mostra a concentração de ligante limite Lb em função da concentração de ligante livre Lf. A partir da curva de ligação, a constante de dissociação K pode ser derivada, como a concentração de ligante livre no escoamento de metade-máximo de saturação. Além disso, diferentes algoritmos para linearizar curvas de ligação foram estabelecidos, tais como o enredo de duplo recíproco por Klotz1,2, ou transformações de acordo com Scatchard ou Hanes (revisto por Bisswanger3). No entanto, todos os algoritmos sofrem com o problema que o valor máximo do rendimento de saturação, que é assintoticamente aproximou-se em concentrações elevadas de ligante livre na curva de ligação, tem de ser estimada em uma gráfica pré-avaliação e, portanto, é sujeito a erros.
Além disso, a determinação de uma curva de ligação requer a quantificação de ligante livre e ligado durante o equilíbrio da ligação. Para este fim, o ligante livre deve ser separada do ligante-receptor-limite e quantificado. Portanto, o ligante e receptor tem que diferem em suas propriedades, tais como um ligante não proteico em oposição a um receptor de proteína. Se ambos os parceiros de ligação são proteínas, eles precisam ser distinguíveis em seus tamanhos, encargos ou outras características moleculares. No entanto, a quantificação das concentrações de ligante em abordagens de pequena escala de vinculação é uma tarefa difícil. Etiquetar radioativo do ligante tem sido muitas vezes necessário para detectar a baixa concentração de ligante acoplado, especialmente se quantidades substanciais de receptores não estavam disponíveis ou acessíveis. Além disso, o ligante-receptor-limite pode dissociar durante e após o isolamento de forma não negligenciável. Daí, métodos complexos, tais como equilíbrio gel filtração4, eletroforese capilar5e pulso proteólise6, são necessários para quantificar o ligante do receptor ligado e separá-lo de ligante livre.
Em contraste com estes ensaios obrigatórios, experimentos de titulação não requerem a separação quantitativa de ligante ligado e livre. Para este fim, um receptor em uma concentração constante é titulado com diferentes concentrações de ligante adicionado. Pela ligação ao receptor, o ligante ligado tem uma propriedade biofísica que diferencia o ligante livre e é mensurável por, por exemplo, fotometria, fluorometry ou de anticorpos. Assim, um sinal S, que é proporcional a saturação Y de rendimento e, consequentemente, também para a concentração de ligante do receptor ligado (Lb), é detectado como uma função da concentração total de ligante adicionado (Lt). Ambos os parâmetros, o sinal de S e a concentração total de ligante adicionado são quantificados de forma direta e mais fácil do que as concentrações de ligante ligado e livre. Especialmente, a detecção de ligante do receptor ligado por ensaio imunoenzimático (ELISA) permitiu a redução dos volumes de amostra para abaixo de 100 µ l, bem como medidas paralelas de várias concentrações de ligante em placas de microtitulação multi bem. Em uma titulação, ELISA, um receptor é fisicamente adsorvido a uma placa de microtitulação na mesma concentração e titulado com ligante solúvel. O receptor está imobilizado na superfície de plástico essencialmente por adsorção hidrofóbica. A concentração superficial de imobilizado receptor correlaciona-se com a concentração de revestimento do receptor em uma relação não-linear, provável, de acordo com Langmuir´s de isoterma de adsorção7. Além do número total de moléculas do receptor adsorvida, seu estado de atividade é outro parâmetro importante para os ensaios de titulação. Apenas imobilizado receptores que tem mantido a actividade de ligação do ligante, são relevantes para o ensaio de titulação e eventualmente contribuam para a concentração total de receptores ativa Rt do ensaio de titulação, o que não pode ser determinado diretamente.
Sites sobre a superfície de plástico, não são abrangidas pelo receptor de imobilizado são propensas a adsorver outras proteínas, tais como o ligante. Adsorção física do ligante a tais sites superfície plásticas resultaria em um sinal similar como o ligante do receptor ligado, ainda de forma não específica. Para reduzir este sinal inespecífica, os sites de superfície plásticos das placas de microtitulação que não têm sido revestidos com proteína ainda serão bloqueados com albumina de soro bovino (BSA). No entanto, para alguns ensaios de titulação do receptor-ligante, sinais de fundo inespecíficos podem ser observados. Em seguida, outro agentes de bloqueio, tais como uma solução de 0,2% de gelatina ou de 0,04% Tween 20, são recomendados.
Após a ligação ao receptor, o ligante livre é removido por duas etapas de lavagem. Ligante ligado permanece com o receptor, que é imobilizado à superfície plástica do poço da microplaca e, opcionalmente, reforçado por fixação química. Para a subsequente covalent ligação transversal de limite ligante e receptor imobilizado com glutaraldeído, a substância tampão TRIS é substituída para HEPES, sem qualquer mudança na ligação do ligante. HEPES, em contraste com TRIS, não inativar glutaraldeído. A ligação covalente transversal em glutaraldeído corrige o ligante acoplado com seu receptor e impede sua dissociação durante as etapas subsequentes de lavagem e incubação. Assim, a interação receptor-ligante é quimicamente congelada e garante uma curva de titulação, que é não afetada por etapas subsequentes de lavagem e incubação. No entanto, fixação de glutaraldeído quimicamente pode modificar o ligante e receptor de tal forma que sua interação é reduzida ou abolida. Além disso, modificação de epítopos dentro o ligante pode mudar a afinidade de ligação do anticorpo de detecção, especialmente se um anticorpo monoclonal é usado para quantificar o ligante acoplado. Embora nenhum destes efeitos adversos da fixação de glutaraldeído ocorre nesta titulação ELISA, a sensibilidade do teste para glutaraldeído deve ser testada para cada interação receptor-ligante antes do experimento de titulação. Após a fixação, glutaraldeído em excesso é removido em três etapas de lavagem com tampão TRIS-contendo. TRIS inactivates restantes grupos aldeído, que nonspecifically podem reagir com a detecção de anticorpos na etapa subsequente.
A quantidade de ligante ligado é quantificada com anticorpos enzima-lig, que fornecem um sinal fotométrico de ELISA S. Isto é plotado versus o ligante total concentração Lt adicionado a cada poço. Apesar de sua aquisição mais fácil, a curva de titulação não é uma função de hiperbólicas em contraste com a curva de ligação. Além disso, tem sido pouco claras como calcular a constante de dissociação K de uma curva de titulação. Embora algoritmos para linearizar curvas de titulação espectroscopicamente adquiridos independentemente foram relatados por Stockell8 e Heyn e Weischet9, ela falhou devido a sua incerteza de estimar o sinal máximo valor que o rendimento de saturação aproxima-se em concentrações elevadas de ligante adicionado.
Aqui, uma titulação ELISA e um algoritmo de regressão não-linear são descritos para derivar a constante de dissociação K para uma interação do ligante do receptor de uma curva de titulação. Este protocolo é exemplificado para a interação da-domínio de ligação de colágeno da integrina α2β1 com um inibidor de derivada de veneno de cobra. Integrinas são moléculas de adesão celular, que mediam a ancoragem das células para a matriz extracelular circundante ou membrana basal subjacente10,11. Além disso, integrinas transmitem sinais importantes entre as células e a matriz extracelular através do recrutamento de moléculas de sinalização adicional e formando novas organelas celulares, adhesomes, em cima da célula-matriz interação12,13, 14. colágeno, o ligante de integrina α2β1, é a proteína mais abundante do corpo humano e é um componente crucial do andaime do tecido conjuntivo15. A interação entre a integrina α2β1 e colágeno é mediada pela-domínio de subunidade α2 integrina. O integrina α2A-domínio contém um cátion divalente, que é necessária para a ligação de colágeno e estabiliza sua estrutura. O selvagem-tipo formulário, bem como os mutantes do domínio α2A, como aquele em que o resíduo da superfície exposta Y216 tinha sido substituído por uma glicina, podem ser facilmente recombinantes produzidos em um sistema de expressão bacteriana e isolados através de seus oligo-His-tags com um NiNTA coluna de Superflow com uma diálise subsequente contra salino TRIS (TBS; 50 mM TRIS/HCl, pH 7,4, 150 mM NaCl) contendo 2 mM MgCl216. As concentrações foram determinadas com o ensaio de ácido bicinchoninic (BCA) e suas purezas são testadas por SDS-PAGE convencional e coradas com Coomassie Brilliant Blue R250.
A interação entre a integrina α2β1 e colágeno é bloqueada pela vinculação do componente de veneno de cobra, rhodocetin, a partir do Malayan pit viper (Calloselasma rhodostoma)16,17. Usado como um ligante solúvel nesta titulação ELISA, rhodocetin foi purificado a partir do crude veneno conforme descrito anteriormente,16. Ele é dissolvido em solução salina tampão HEPES (HBS; 10 mM HEPES/NaOH, pH 7,4, 150 mM NaCl) e é armazenado congelado a-20 ° C. Sua concentração foi determinada pelo BCA e sua pureza foi comprovada por SDS-PAGE. Como um antagonista, rhodocetin não só bloqueia o colágeno vinculativos para a integrina α2β1 A-domínio, mas também estabiliza a conformação inativa a integrina, evitando qualquer sinalização de colágeno em células ou plaquetas18. É de grande importância biomédica para determinar a constante de dissociação de rhodocetin com seu alvo do receptor e, portanto, desvendar seu mecanismo molecular e farmacêutica potencial por exemplo, como um agente antitrombótico. Para este fim, uma titulação ELISA é descrita, incluindo sua avaliação, que é aplicável a praticamente qualquer interação receptor-ligante com uma estequiometria 1:1 interação.
Protocol
Representative Results
Discussion
A titulação de ELISA é um sistema versátil de teste para determinar a dissociação de uma interação receptor-ligante. Como a titulação ELISA contorna a necessidade de separar ligands livre e limite efetivamente e analisar as suas concentrações quantitativamente, substancialmente mais estudos e publicações têm empregado titulação ELISAs em vez de gravação curvas de ligação . Além disso, titulação ELISAs são fáceis de realizar e requerem quantidades razoavelmente baixas do receptor e ligante. Para …
Declarações
The authors have nothing to disclose.
Acknowledgements
O protocolo e o algoritmo foram desenvolvidos dentro de um projeto financiado pela Deutsche Forschungsgemeinschaft (DFG grant A09 SFB1009 e EB177/13-1). O autor agradece Barbara Schedding e Felix Schmalbein apoio técnico e Dr. Niland para ler criticamente o manuscrito.
Materials
| TRIS | neoFrox | 1125KG001 | |
| HEPES | Sigma-Aldrich | H4034 | |
| NaCl | Applichem | 1,316,591,214 | |
| MgCl2 | Merck | 172571 | |
| integrin a2A, wild-type and mutant, recombinant | isolated in author's lab | ||
| NiNTA superflow column | Qiagen, Germany | 30821 | |
| Coomassie-Brilliant Blue R250 | Serva | 35050 | |
| bicinchoninic acid assay (BCA), protein concentration determination kit | Fisher Scientific | 23225 | |
| bovine serum albumine (BSA), fraction V | Applichem | A1391 | |
| 25 % solution of glutaraldehyde | Merck | 354400 | |
| anti-rabbit immunglobulin-antibodies from goat, conjugated with alkaline phosphatase | Sigma-Aldrich | A9919 | |
| Glycine | Applichem | A1377 | |
| Zn(II)-acetate | Applichem | A4324 | |
| NaOH | Applichem | A1551 | |
| Alkaline phosphatase substrate tablet (5 mg) | Sigma-Aldrich | S0942 | |
| Costar half-area microtiter plate | Thermo Scientific | Corning 3690 | |
| micro reaction tubes | Eppendorf | 30120086 | |
| Microplate ELISA reader | BioTek | Synergy HT |
Referências
- Klotz, I. M. The application of the law of mass action to binding by proteins; interactions with calcium. Arch Biochem. 9, 109-117 (1946).
- Klotz, I. M. Ligand-receptor complexes: origin and development of the concept. J Biol Chem. 279 (1), 1-12 (2004).
- Bisswanger, H. Ch. 1: Multiple Equilibria, Principles and Derivations. Enzyme Kinetics: Principles and Methods. , 1-26 (2017).
- Shimura, K., Kasai, K. Affinity gel titration: quantitative analysis of the binding equilibrium between immobilized protein and free ligand by a continuous titration procedure. Anal Biochem. 149 (2), 369-378 (1985).
- Gong, M., Nikcevic, I., Wehmeyer, K. R., Limbach, P. A., Heineman, W. R. Protein-aptamer binding studies using microchip affinity capillary electrophoresis. Electrophoresis. 29 (7), 1415-1422 (2008).
- Hanes, M. S., Ratcliff, K., Marqusee, S., Handel, T. M. Protein-protein binding affinities by pulse proteolysis: application to TEM-1/BLIP protein complexes. Protein Sci. 19 (10), 1996-2000 (2010).
- Latour, R. A. The Langmuir isotherm: a commonly applied but misleading approach for the analysis of protein adsorption behavior. J Biomed Mater Res A. 103 (3), 949-958 (2015).
- Stockell, A. The binding of diphosphopyridine nucleotide by yeast glyceraldehyde-3-phosphate dehydrogenase. J Biol Chem. 234 (5), 1286-1292 (1959).
- Heyn, M. P., Weischet, W. O. Circular dichroism and fluorescence studies on the binding of ligands to the α subunit of tryptophan synthase. Biochem. 14 (13), 2962-2968 (1975).
- Campbell, I. D., Humphries, M. J. Integrin structure, activation, and interactions. Cold Spring Harb Perspect Biol. 3 (3), (2011).
- Zeltz, C., Gullberg, D. The integrin-collagen connection–a glue for tissue repair?. J Cell Sci. 129 (4), 653-664 (2016).
- Kanchanawong, P., et al. Nanoscale architecture of integrin-based cell adhesions. Nature. 468 (7323), 580-584 (2010).
- Luo, B. H., Carman, C. V., Springer, T. A. Structural basis of integrin regulation and signaling. Annu Rev Immunol. 25, 619-647 (2007).
- Luo, B. H., Springer, T. A. Integrin structures and conformational signaling. Curr Opin Cell Biol. 18 (5), 579-586 (2006).
- Ricard-Blum, S. The collagen family. Cold Spring Harb Perspect Biol. 3 (1), a004978 (2011).
- Eble, J. A., Tuckwell, D. S. The α2β1 integrin inhibitor rhodocetin binds to the A-domain of the integrin α2 subunit proximal to the collagen-binding site. Biochem J. 376 (Pt 1), 77-85 (2003).
- Eble, J. A., et al. The α2β1 integrin-specific antagonist rhodocetin is a cruciform, heterotetrameric molecule. FASEB J. 23 (9), 2917-2927 (2009).
- Eble, J. A., et al. Dramatic and concerted conformational changes enable rhodocetin to block α2β1 integrin selectively. PLoS Biol. 15 (7), e2001492 (2017).
- Bracht, T., Figueiredo de Rezende, F., Stetefeld, J., Sorokin, L. M., Eble, J. A. Monoclonal antibodies reveal the alteration of the rhodocetin structure upon α2β1 integrin binding. Biochem J. 440 (1), 1-11 (2011).
- Harlow, E., Lane, D. Chapter 5: Immunizations. Antibodies, a laboratory manual. 5, 53-138 (1988).
- Lu, D. Analyzing interactions between SSB and proteins by the use of fluorescence anisotropy. Methods Mol Biol. 922, 155-159 (2012).
- Fielding, L. NMR methods for the determination of protein-ligand dissociation constants. Curr Top Med Chem. 3 (1), 39-53 (2003).
- Leavitt, S., Freire, E. Direct measurement of protein binding energetics by isothermal titration calorimetry. Curr Opin Struct Biol. 11 (5), 560-566 (2001).
- McDonnell, J. M. Surface plasmon resonance: towards an understanding of the mechanisms of biological molecular recognition. Curr Opin Chem Biol. 5 (5), 572-577 (2001).
- Rich, R. L., Myszka, D. G. Advances in surface plasmon resonance biosensor analysis. Curr Opin Biotechnol. 11 (1), 54-61 (2000).
- Pesquero, N. C., et al. Real-time monitoring and kinetic parameter estimation of the affinity interaction of jArtinM and rArtinM with peroxidase glycoprotein by the electrogravimetric technique. Biosens Bioelectron. 26 (1), 36-42 (2010).
- Scheuermann, T. H., Padrick, S. B., Gardner, K. H., Brautigam, C. A. On the acquisition and analysis of microscale thermophoresis data. Anal Biochem. 496, 79-93 (2016).

