Trois procédures de laboratoire pour évaluer les différentes Manifestations d’impulsivité chez le rat
Summary
Nous présentons trois protocoles qui permettent d’évaluer différentes formes d’impulsivité chez les rats et autres petits mammifères. Procédures de choix intertemporel évaluent la tendance à la réduction de la valeur des résultats retardées. Renforcement différentiel de taux bas et la discrimination négative caractéristique évaluer la capacité d’inhibition de réponse avec et sans punition pour des réactions inappropriées, respectivement.
Abstract
Le présent article fournit un guide pour la conduction et l’analyse des trois protocoles axés sur le conditionnement pour évaluer l’impulsivité chez les rats. Impulsivité est un concept utile parce qu’il est associé à des troubles psychiatriques chez les humains et avec un comportement mésadapté chez les animaux non humains. On croit que l’impulsivité est composée de facteurs distincts. Il y a des protocoles de laboratoire conçus pour évaluer chacun de ces facteurs en utilisant des équipements automatisés normalisés. Retard d’escompte est associée à l’incapacité d’être motivés par les résultats retardées. Ce facteur est évalué au moyen de protocoles de choix intertemporel, qui consistent en présentant une situation de choix impliquant une récompense immédiate et une récompense plus grande mais retardée de l’individu. Déficit d’inhibition de réponse est liée à l’incapacité de retenir des réponses dominants. Renforcement différentiel de taux faibles (DLR) et protocoles de discrimination négative caractéristique d’évaluer le facteur de déficit de l’inhibition de réponse d’impulsivité. Le premier impose une condition pour une personne motivée dans laquelle la plupart attendre un délai minimum pour une réponse d’être récompensés. Ce dernier évalue la capacité des individus à s’abstenir de nourriture qui cherchent des réponses quand un signal de l’absence de nourriture est présenté. Le but de ces protocoles est de construire une mesure quantitative objective d’impulsivité, qui sert à faire des comparaisons interspécifique, prévoyant la possibilité de recherche translationnelle. Les avantages de ces protocoles particuliers comprennent leur installation facile et l’application, qui découle de la relativement faible quantité de matériel nécessaire et la nature automatisée de ces protocoles.
Introduction
Impulsivité peut être conceptualisée comme une dimension comportementale associée inadaptés résultats1. Malgré l’utilisation répandue de ce terme, il n’y a pas de consensus universel sur sa définition précise. En fait, plusieurs auteurs ont défini l’impulsivité en donnant des exemples de comportements impulsifs ou leurs conséquences, plutôt que de les délimiter quels aspects distinctifs régissent le phénomène. Par exemple, impulsivité est censée pour impliquer une incapacité à attendre, à planifier, à inhiber les comportements dominants, ou une insensibilité aux résultats retardée2, et il a été considéré comme une vulnérabilité noyau addictives3. Bari et Robbins4 ont caractérisé l’impulsivité comme la co-occurrence de fortes impulsions, déclenché par le dispositionnelle et situationnels variables et des processus inhibiteurs dysfonctionnels. Dalley et Robbins, qui a déclaré que l’impulsivité pouvait être considérée comme une prédisposition aux actions rapides, souvent prématurées, sans perspicacité approprié5a fourni une définition différente. Pourtant, une autre définition d’impulsivité, proposée par Sosa et dos Santos6, une tendance de comportement qui s’écarte d’un organisme de maximisation des récompenses disponibles en raison du contrôle acquis exercée sur l’organisme répond par des stimuli d’ailleurs associés à ces récompenses.
En raison du processus comportements liés à impulsivité, son substrat neurophysiologique implique des structures en commun avec celles des comportements motivés, prise de décision et l’évaluation de la récompense. Ceci est confirmé par des études qui montrent que les structures de la voie cortico-striataux (p. ex., noyau accumbens (ANC), cortex préfrontal [PFC], amygdale et noyau caudé, putamen [CPU]), ainsi que le système de neurotransmetteurs ascendantes monoaminergiques, participent dans l’expression du comportement impulsif7. Toutefois, le substrat neuronal d’impulsivité est plus complexe que cela. Bien que NAc et les PFC sont impliqués dans le comportement impulsif, ces structures font partie d’un système plus complexe et sont également composées de sous-structures qui ont des fonctions différentes (pour la documentation plus détaillée, voir Dalley et Robbins5).
Peu importe les controverses sur son caractère et son substrat biologique, cette dimension comportementale sait varient selon les individus, auquel cas il peut être considéré comme un trait, et les individus, auquel cas il peut être considéré comme un état8. Impulsivité est depuis longtemps reconnue comme une caractéristique de certaines affections psychiatriques, comme l’attention-déficit/hyperactivité (TDAH), l’abus de substances et d’épisodes maniaques9. Il semble y avoir un consensus élevé que l’impulsivité est composée par de multiples facteurs dissociables, y compris le manque de volonté d’attendre (c.-à-d., retarder l’actualisation), incapacité à s’abstenir de réponses dominants (c.-à-d., le déficit inhibiteur), difficulté à se concentrer sur les information (c.-à-d., inattention) et une tendance à s’engager dans des situations risquées (c’est-à-dire, la recherche de sensation)5,10,11. Chacun de ces facteurs peut être évaluée par le biais de tâches comportementales particulières, qui sont habituellement assignés à deux grandes catégories : choix et réponse d’inhibition (ceux-ci peuvent avoir différentes étiquettes entre chaque taxonomies des auteurs). Certaines caractéristiques importantes de ces tâches comportementales sont qu’elles pourraient s’appliquer à travers plusieurs espèces animales2 et qu’elles permettent d’étudier l’impulsivité dans des conditions contrôlées en laboratoire.
Une dimension comportementale avec des animaux non humains laboratoire de modélisation a un certain nombre d’avantages, y compris la possibilité de mesure tendances comportementales spécifiques et mettre en œuvre, ce qui permet aux chercheurs de largement réduire les variables confondantes (par exemple, contamination par des événements de vie passé4) et à mettre en œuvre des manipulations expérimentales telles que l’administration chronique pharmacologique, effectuant des lésions neurotoxiques, ou des manipulations génétiques. La plupart de ces protocoles ont des versions analogiques pour les humains, qui font des comparaisons facile5. Ce qui est important, l’utilisation des analogues de ces protocoles de laboratoire chez l’homme est efficace pour faciliter le diagnostic des troubles psychiatriques, tels que l’ADHD (en particulier lorsque plusieurs protocoles est appliquée12).
Comme tout autre indicateur psychologique, les protocoles de laboratoire pour évaluer l’impulsivité doivent respecter des critères particuliers afin de réaliser l’objectif de fournir un aperçu du phénomène à l’étude. Pour être considéré comme un modèle approprié de comportement impulsif, un laboratoire protocole devrait être fiables et possèdent (du moins, dans une certaine mesure) visage, construction et/ou validité prédictive13. Fiabilité pourrait impliquer qu’un effet sur la mesure reproduirait si une manipulation est réalisée deux fois ou plus, ou que la mesure est conforme au fil du temps ou à travers différentes situations14,15. La fonction d’ancienne serait particulièrement utile dans les études expérimentales, alors que ce dernier serait le cas pour les études corrélationnelles14. Une validité apparente se réfère à la mesure dans laquelle ce qui est mesuré ressemble à ce phénomène qui est censé être modélisée, quant à être, par exemple, touchés par les mêmes variables. Validité prédictive se réfère à la capacité d’une mesure de prévoir la performance future dans les protocoles, qui ont pour but de mesurer la même ou une construction connexe. Enfin, validité conceptuelle renvoie à la question de savoir si le protocole reproduit comportement qui est théoriquement solide concernant le processus ou les processus supposés d’être impliqués dans le phénomène à l’étude. Cependant, même si ce sont des caractéristiques hautement souhaitables, on doit être prudent lorsque indiquant qu’un protocole est valide purement fondée sur ces critères16.
Il existe plusieurs protocoles pour mesurer l’impulsivité en laboratoire. Toutefois, le présent article présente trois de ces méthodes : choix intertemporel, renforcement différentiel de taux bas et la discrimination négative caractéristique. Intertemporels procédures visent à évaluer le retard d’escompte (c.-à-d., la difficulté des résultats retardées pour contrôler le comportement) composante d’impulsivité. La raison d’être fondamentale du présent protocole fait face à des sujets avec deux récompenses qui diffèrent par la grandeur et retard17. Une alternative fournit une petite récompense immédiate (appelée plus tôt plus petit, SS) et l’autre une récompense plus grande mais retardée (appelé plus grande et plus tard, LL). La proportion de réponses à l’alternative de la SS peut servir comme indice d’impulsivité18. En renforcement différentiel des procédures de taux bas, le facteur d’impulsivité à évaluer est inhibition de réponse (p. ex., incapacité de retenir des réponses dominants) quand il y a une éventualité de punition négative sur une réponse inappropriée. La raison d’être du présent protocole met en place une situation dans laquelle le seul moyen d’obtenir des récompenses est à suspendre leur ayant répondu au questionnaire19sujets. Enfin, procédure de discrimination négative caractéristique évalue inhibition de réponse lorsqu’il n’y a aucune sanction explicite sur une réponse inappropriée. La raison d’être du présent protocole (également connu sous le nom pavlovien conditionné l’inhibition ou l’A + / AX-procédure) est d’évaluer la capacité des sujets à retenir les réponses inutiles20.
Ces procédures se démarquent en comparaison à d’autres personnes comme ayant certaines fonctionnalités pratiques. Par exemple, les procédures présentées ici conviennent aux menées dans des chambres très peu équipées de climatisation (également connu sous le nom « la boîte Skinner »). La figure 1 montre un diagramme d’une chambre de climatisation typique. Chambres climatisation sont des instruments de recherche utile en raison d’un certain nombre d’avantages. Ils permettent la collecte automatisée d’un volume relativement important de données, en maximisant le nombre de sujets évalués pour l’unité de temps et l’espace21. Par ailleurs, les études comportementales menées en conditionné chambres requièrent intervention chercheur minime, ce qui réduit le temps et les efforts investis par le personnel de laboratoire, contrairement aux autres méthodes disponibles (p. ex., non automatisé T-labyrinthes, boîtes de jeu-shifting) 21. minimiser l’intervention des chercheurs aussi aider à réduire les biais des chercheurs, diminuant les effets de la courbe d’apprentissage des chercheurs, et une réduction d’induite par le traitement stress22. Chambres climatisation typiques sont assez standardisées pour être utilisé sur des rongeurs de tailles moyennes, comme les rats (r. norvegicus), mais peuvent être utilisées pour étudier les autres taxons, comme les marsupiaux de taille similaire (par exemple, d. albiventris et L. crassicaudata 23). il y a aussi commerciale conditionné chambres adaptées pour les plus petits (p. ex., souris [M. musculus]) et plus grand (par exemple, les primates non humains) espèces. Mise en place et tenue les protocoles présentés dans cet article nécessitent un minimum de compétences en programmation et exigent un nombre assez faible d’entrée accessible et les périphériques de sortie, à la différence des méthodes alternatives plus perfectionnées (p. ex., temps de réaction série 5-choix tâche [5- CSRTT]24 et suivi du signe25).
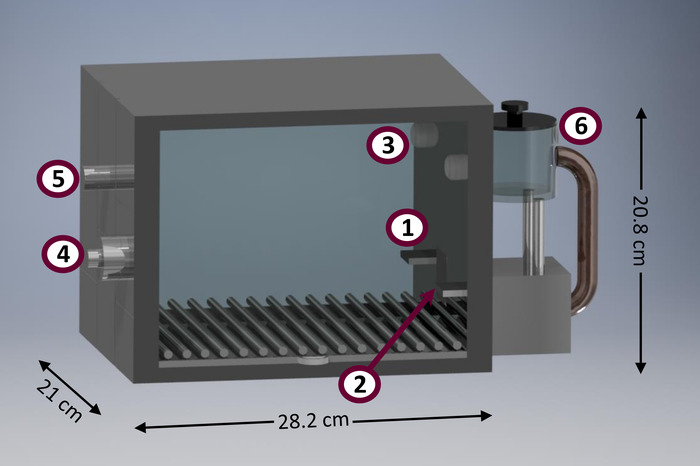
Figure 1 : schéma d’un conditionnement prototype chambre. Les principaux composants de la chambre de climatisation comprennent : (1) gauche levier, prise alimentaire (2) (équipée latérales diodes infrarouges pour détecter les entrées de tête), la lumière focalisée (3) (4) haut-parleur pour émission de tonalité (vue arrière), lumière (5) maison (vue arrière), alimentaire (6) distributeur. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Protocol
Representative Results
Discussion
Le présent article donne une description des divers divers protocoles de dépistage impulsivité chez les rats. On prétend que ces protocoles particuliers sont favorisés pour leur facilité d’analyse de données et de programmation et nécessitent moins de dispositifs d’exploitation et de la stimulation que les autres solutions de rechange disponibles. Il y a plusieurs étapes cruciales pour la mise en œuvre effective de ces protocoles, tels que (1) ce qui donne une question de recherche, (2) sélection d’une m…
Declarações
The authors have nothing to disclose.
Acknowledgements
Nous tenons à remercier Florencia Mata, María Elena Chávez, Miguel Burgos et Alejandro Tapia pour fournir une assistance technique. Nous souhaitons également remercier Sarah Gordon Frances pour ses commentaires utiles sur un projet précédent du présent article et Vladimir Orduña pour gentiment fournissant des données brutes d’un document publié. Merci à Claudio Nallen pour créer le diagramme de la Figure 1. Nous sommes reconnaissants à la Dirección de Investigación de la Universidad Iberoamericana Ciudad de México pour le financement des services de relecture/révision et la vidéo produisant des dépenses.
Materials
| 25 Pin Cables | Med Associates | SG-213F | Connect smart control cards to smart control panels |
| 40 Pin Ribbon Cable | Med Associates | DIG-700C | Connects the computer with the interface cabinet |
| Computer | Dell Computer Company | T8P8T-7G8MR-4YPQV-96C2F-7THHB | For controlling and monitoring protocols’ processes |
| Conductor Cables | Med Associates | SG-210CP-8 | Provide power to the smart control panels via the rack mount power supply |
| Food dispenser with pedestal | Med Associates | ENV-203M-45 (12937) | Silently provides 45 mg food pellets |
| Head-Entry Detector | Med Associates | ENV-254-CB | Uses an infrared photo-beam to detect head entries into the food receptacle |
| House Light | Med Associates | ENV-215M | For providing diffuse illumination inside the chamber |
| Interface Cabinet | Med Associates | SG-6080D | Pod that can hold up to eight smart control cards |
| Med-PC IV Software | Med Associates | SOF-735 | Translate codes into commands for operating outputs and recording/storing input information |
| Multiple tone generator | Med Associates | ENV-223 (597) | For controlling the frequency of the tones |
| Panel fillers | Med Associates | ENV-007-FP | For filling modular walls when devices are not used |
| Pellet Receptacle | Med Associates | ENV-200R2M | Receives and holds food pellets delivered by the dispenser |
| Rack Mount Power Supply | Med Associates | DIG-700F | Provides power to the interface cabinet |
| Retractable Lever | Med Associates | ENV-112CM (10455) | Detects lever-pressing responses; projects into the chamber or retracts as needed |
| Smart Control Cards | Med Associates | DIG-716 | Controls up to eight inputs and four outputs of a conditioning chamber |
| Smart Control Panels | Med Associates | SG-716 (3341) | Connect smart cards to the devices within the conditioning chambers |
| Speaker | Med Associates | ENV-224AM | For providing tones inside the chamber |
| Standard Modular Chambers for Rat | Med Associates | ENV-008 | Made of aluminum channels designed to hold modular devices |
| Standard sound-, light-, and temperature isolating shells | Med Associates | ENV-022MD | Serve to harbor each conditioning chamber |
| Stimulus Light | Med Associates | ENV-221M | For providing a round focalized light stimulus |
| Three Pin Cables | Med Associates | SG-216A-2 | Connects smart control panel with each of the input and output devices in the conditioning chambers |
Referências
- Loxton, N. J. The role of reward sensitivity and impulsivity in overeating and food addiction. Current Addiction Reports. 5 (2), 212-222 (2018).
- Richards, J. B., Gancarz, A. M., Hawk, L. W., Bardo, M. T., Fishbein, D. H., Milich, R. . Inhibitory control and drug abuse prevention. , (2011).
- Gullo, M. J., Loxton, N. J., Dawe, S. Impulsivity: Four ways five fectors are not basic to addiction. Addictive Behaviors. 39 (11), 1547-1556 (2014).
- Bari, A., Robbins, T. W. Inhibition and impulsivity: Behavioral and neural basis of response control. Progress in Neurobiology. 108, 44-79 (2013).
- Dalley, J. W., Robbins, T. W. Fractionating impulsivity: neuropsychiatric implications. Nature Reviews Neuroscience. 18 (3), 158-171 (2017).
- Sosa, R., dos Santos, C. V. Toward a unifying account of impulsivity and the development of self-control. Perspectives in Behavior Science. , 1-32 (2018).
- King, J. A., Tenney, J., Rossi, V., Colamussi, L., Burdick, S. Neural substrates underlying impulsivity. Annals of the New York Academy of Sciences. 1008 (1), 160-169 (2003).
- Stayer, R., Ferring, D., Schmitt, M. J. States and traits in psychological assessment. European Journal of Psychological Assessment. 8 (2), 79-98 (1992).
- Moeller, F. G., Barratt, E. S., Dougherty, D. M., Schmitz, J. M., Swann, A. C. Psychiatric aspects of impulsivity. American Journal of Psychiatry. 158, 1783-1793 (2001).
- Evenden, J. L. Varieties of impulsivity. Psychopharmacology. 146 (4), 348-361 (1999).
- Winstanley, C. A. The utility of rat models of impulsivity in developing pharmacotherapies for impulse control disorders. British Journal of Pharmacology. 164 (4), 1301-1321 (2011).
- Solanto, M. V., et al. The ecological validity of delay aversion and response inhibition as measures of impulsivity in AD/HD: A supplement to the NIMH multimodal treatment study of AD/HD. Journal of Abnormal Child Psychology. 29 (3), 215-218 (2001).
- van der Staay, F. J. Animal models of behavioral dysfunctions: Basic concepts and classifications, and an evaluation strategy. Brain Research Reviews. 52, 131-159 (2006).
- Hedge, C., Powell, G., Summer, P. The reliability paradox: Why robust cognitive tasks do not produce reliable individual differences. Behavioral Research Methods. , 1-21 (2017).
- Nakagawa, S., Schielzeth, H. Repeatability for Gaussian and non-Gaussian data: A practical guide for biologists. Biological Reviews. 85, 935-956 (2010).
- Sjoberg, E. Logical fallacies in animal model research. Behavior and Brain Functions. 13 (1), (2017).
- Rachlin, H. Self-control: Beyond commitment. Behavioral and Brain Sciences. 18 (01), 109 (1995).
- Logue, A. W. Research on self-control: An integrating framework. Behavioral and Brain Sciences. 11 (04), 665 (1988).
- Kramer, T. J., Rilling, M. Differential reinforcement of low rates: A selective critique. Psychological Bulletin. 74 (4), 225-254 (1970).
- Sosa, R., dos Santos, C. V. Conditioned inhibition and its relationship to impulsivity: Empirical and theoretical considerations. The Psychological Record. , (2018).
- Gallistel, C. R., Balci, F., Freestone, D., Kheifets, A., King, A. Automated, quantitative cognitive/behavioral screening of mice: For genetics, pharmacology, animal cognition and undergraduate instruction. Journal of Visualized Experiments. (84), (2014).
- Skinner, B. F. A case history in scientific method. American Psychologist. 11 (5), 221-233 (1956).
- Papini, M. R. Associative learning in the marsupials Didelphis albiventris and Lutreolina crassicaudata. Journal of Comparative Psychology. 102 (1), 21-27 (1988).
- Leonard, J. A. 5 choice serial reaction apparatus. Medical Research Council of Applied Psychology Research. , 326-359 (1959).
- Robinson, T. E., Flagel, S. B. Dissociating the Predictive and Incentive Motivational Properties of Reward-Related Cues Through the Study of Individual Differences. Biological Psychiatry. 65 (10), 869-873 (2009).
- Charan, J., Kantharia, N. D. How to calculate sample size in animal studies?. Journal of Pharmacology and Pharmacotherapeutics. 4 (4), 303-306 (2013).
- Toth, L. A., Gardiner, T. W. Food and water restriction protocols: Physiological and behavioral considerations. Journal of the American Association for Laboratory Animal Science. 39 (6), 9-17 (2000).
- Deluty, M. Z. Self-control and impulsiveness involving aversive events. Journal of Experimental Psychology: Animal Behavior Processes. 4, 250-266 (1978).
- Cabrera, F., Robayo-Castro, B., Covarrubias, P. The ‘huautli’ alternative: Amaranth as reinforcer in operant procedures. Revista Mexicana de Análisis de la Conducta. 36, 71-92 (2010).
- Ferster, C. B., Skinner, B. F. . Schedules of reinforcement. , (1957).
- Orduña, V., Valencia-Torres, L., Bouzas, A. DRL performance of spontaneously hypertensive rats: Dissociation of timing and inhibition of responses. Behavioural Brain Research. 201 (1), 158-165 (2009).
- Freestone, D. M., Balci, F., Simen, P., Church, R. Optimal response rates in humans and animals. Journal of Experimental Psychology: Animal Behavior and Cognition. 41 (1), 39-51 (2015).
- Sanabria, F., Killeen, P. R. Evidence for impulsivity in the Spontaneously Hypertensive Rat drawn from complementary response-withholding tasks. Behavioral and Brain Functions. 4 (1), 7 (2008).
- van den Bergh, F. S., et al. Spontaneously hypertensive rats do not predict symptoms of attention-deficit hyperactivity disorder. Pharmacology, Biochemistry, and Behavior. 83, 11 (2006).
- Topping, J. S., Pickering, J. W. Effects of punishing different bands of IRTs on DRL responding. Psychological Reports. 31 (19-22), (1972).
- Richards, J. B., Sabol, K. E., Seiden, L. S. DRL interresponse-time distributions: quantification by peak deviation analysis. Journal of the Experimental Analysis of Behavior. 60 (2), 361-385 (1993).
- Orduña, V. Impulsivity and sensitivity to amount and delay of reinforcement in an animal model of ADHD. Behavioural Brain Research. 294, 62-71 (2015).
- Harmer, C. J., Phillips, G. D. Enhanced conditioned inhibition following repeated pretreatment with d -amphetamine. Psychopharmacology. 142 (2), 120-131 (1999).
- Lister, S., Pearce, J. M., Butcher, S. P., Collard, K. J., Foster, G. Acquisition of conditioned inhibition in rats is impaired by ablation of serotoninergic pathways. European Journal of Neuroscience. 8, 415-423 (1996).
- Meyer, H. C., Bucci, D. J. The contribution of medial prefrontal cortical regions to conditioned inhibition. Behavioral Neuroscience. 128 (6), 644-653 (2014).
- McNicol, D. . A primer of signal detection theory. , (1972).
- Carnero, S., Morís, J., Acebes, F., Loy, I. Percepción de la contingencia en ratas: Modulación fechneriana y metodología de la detección de señales. Revista Electrónica de Metodología Aplicada. 14 (2), (2009).
- López, H. H., Ettenberg, A. Dopamine antagonism attenuates the unconditioned incentive value of estrus female cues. Pharmacology, Biochemistry, and Behavior. 68, 411-416 (2001).
- Schotte, A., Janssen, P. F. M., Megens, A. A. H. P., Leysen, J. E. Occupancy of central neurotransmitter receptors by risperidone, clozapine and haloperidol, measured ex vivo. Brain Research. 631 (2), 191-202 (1993).
- van Hest, A., van Haaren, F., van de Poll, N. Haloperidol, but not apomorphine, differentially affects low response rates of male and female wistar rats. Pharmacology, Biochemistry, and Behavior. 29, 529-532 (1988).
- Finnegan, K. T., Ricaurte, G., Seiden, L. S., Schuster, C. R. Altered sensitivity to d-methylamphetamine, apomorphine, and haloperidol in rhesus monkeys depleted of caudate dopamine by repeated administration of d-methylamphetamine. Psychopharmacology. 77, 43-52 (1982).
- Britton, K. T., Koob, G. F. Effects of corticotropin releasing factor, desipramine and haloperidol on a DRL schedule of reinforcement. Pharmacology, Biochemistry, and Behavior. 32, 967-970 (1989).
- Maricq, A. V., Church, R. The differential effects of haloperidol and metamphetamine on time estimation in the rat. Psychopharmacology. 79, 10-15 (1983).
- Dalley, J. W., et al. Nucleus accumbens D2/3 receptors predict trait impulsivity and cocaine reinforcement. Science. 315, 1267-1270 (2007).
- Cole, B. J., Robbins, T. W. Effects of 6-hydroxydopamine lesions of the nucleus accumbens septi on performance of a 5-choice serial reaction time task in rats: Implications for theories of selective attention and arousal. Behavior and Brain Research. 33, 165-179 (1989).
- Reynolds, B., de Wit, H., Richards, J. B. Delay of gratification and delay discounting in rats. Behavioural Processes. 59 (3), 157-168 (2002).
- Evenden, J. L., Ryan, C. N. The pharmacology of impulsive behavior in rats: The effects of drugs on response choice with varying delays of reinforcement. Psychopharmacology. 128, 161-170 (1996).
- Autor, S. M., Hendry, D. P. . Conditioned reinforcement. , (1969).
- van den Broek, M. D., Bradshaw, C. M., Szabadi, E. Behaviour of ‘impulsive’ and ‘non-impulsive’ humans in a temporal differentiation schedule of reinforcement. Personality and Individual Differences. 8 (2), 233-239 (1987).
- McGuire, P. S., Seiden, L. S. The effects of tricyclicantidepressants on performance under a differential-reinforcement-of-low-rates schedule in rats. Journal of Pharmacology and Experimental Therapeutics. 214 (3), 635-641 (1980).
- O’Donnell, J. M., Seiden, L. S. Differential-reinforcement-of-low-rates 72-second schedule: Selective effects of antidepressant drugs. Journal of Pharmacology and Experimental Therapeutics. 224 (1), 80-88 (1983).
- Seiden, L. S., Dahms, J. L., Shaughnessy, R. A. Behavioral screen for antidepressants: The effects of drugs and electroconvulsive shock on performance under a differential-reinforcement-of-low-rates schedule. Psychopharmacology. 86, 55-60 (1985).
- He, Z., Cassaday, H. J., Howard, R. C., Khalifa, N., Bonardi, C. Impaired Pavlovian conditioned inhibition in offenders with personality disorders. The Quarterly Journal of Experimental Psychology. 64 (12), 2334-2351 (2011).
- He, Z., Cassaday, H. J., Bonardi, C., Bibi, P. A. Do personality traits predict individual differences in excitatory and inhibitory learning?. Frontiers in Psychology. 4, 1-12 (2013).
- Bucci, D. J., Hopkins, M. E., Keene, C. S., Sharma, M., Orr, L. E. Sex differences in learning and inhibition in spontaneously hypertensive rats. Behavioural Brain Research. 187 (1), 27-32 (2008).
- Gershon, J. A meta-analytic review of gender differences in ADHD. Journal of Attention Disorders. 5, 143-154 (2012).
- Mobini, S., et al. Effects of lesions of the orbitofrontal cortex on sensitivity to delayed and probabilistic reinforcement. Psychopharmacology. 160 (3), 290-298 (2002).
- Bouton, M. E., Nelson, J. B. Context-specificity of target versus feature inhibition in a negative-feature discrimination. Journal of Experimental Psychology: Animal Behavior Processes. 20 (1), 51-65 (1994).
- Bouton, M. E., Nelson, J. B., Schmajuk, N., Holland, P. . Occasion setting: Associative learning and cognition in animals. , 69-112 (1998).
- Rescorla, R. A. Pavlovian conditioned inhibition. Psychological Bulletin. 72 (2), 77-94 (1969).
- Miller, R. R., Matzel, L. D., Bower, G. H. . The psychology of learning and motivation. , (1988).
- Williams, D. A., Overmier, J. B., Lolordo, V. M. A reevaluation of Rescorla’s early dictums about conditioned inhibition. Psychological Bulletin. 111 (2), 275-290 (1992).
- Papini, M. R., Bitterman, M. E. The two-test strategy in the study of inhibitory conditioning. Psychological Review. 97 (3), 396-403 (1993).
- Sosa, R., Ramírez, M. N. Conditioned inhibition: Critiques and controversies in the light of recent advances. Journal of Experimental Psychology: Animal Behavior and Cognition. , (2018).
- Fox, A. T., Hand, D. J., Reilly, M. P. Impulsive choice in a rodent model of attention-deficit/hyperactivity disorder. Behavioural Brain Research. 187, 146-152 (2008).
- Foscue, E. P., Wood, K. N., Schramm-Sapyta, N. L. Characterization of a semi-rapid method for assessing delay discounting in rodents. Pharmacology, Biochemistry, and Behavior. 101, 187-192 (2012).
- Brucks, D., Marshall-Pescini, S., Wallis, L. J., Huber, L., Range, F. Measures of Dogs’ Inhibitory Control Abilities Do Not Correlate across Tasks. Frontiers in Psychology. 8, (2017).
- McDonald, J., Schleifer, L., Richards, J. B., de Wit, H. Effects of THC on Behavioral Measures of Impulsivity in Humans. Neuropsychopharmacology. 28 (7), 1356-1365 (2003).
- Reynolds, B., Ortengren, A., Richards, J. B., de Wit, H. Dimensions of impulsive behavior: Personality and behavioral measures. Personality and Individual Differences. 40 (2), 305-315 (2006).
- Dellu-Hagedorn, F. Relationship between impulsivity, hyperactivity and working memory: a differential analysis in the rat. Behavioral and Brain Functions. 2 (10), 18 (2006).
- López, P., Alba, R., Orduña, V. Individual differences in incentive salience attribution are not related to suboptimal choice in rats. Behavior and Brain Research. 341 (2), 71-78 (2017).
- Ho, M. Y., Al-Zahrani, S. S. A., Al-Ruwaitea, A. S. A., Bradshaw, C. M., Szabadi, E. 5-Hydroxytryptamine and impulse control: prospects for a behavioural analysis. Journal of Psychopharmacology. 12 (1), 68-78 (1998).
- Sagvolden, T., Russell, V. A., Aase, H., Johansen, E. B., Farshbaf, M. Rodent models of attention-deficit/hyperactivity disorder. Biological Psychiatry. 57, 9 (2005).
- Tomie, A., Aguado, A. S., Pohorecky, L. A., Benjamin, D. Ethanol induces impulsive-like responding in a delay-of-reward operant choice procedure: impulsivity predicts autoshaping. Psychopharmacology. 139 (4), 376-382 (1998).
- Monterosso, J., Ainslie, G. Beyond discounting: possible experimental models of impulse control. Psychopharmacology. 146 (4), 339-347 (1999).
- Burguess, M. A., Rabbit, P. . Methodology of frontal and executive function. , 81-116 (1997).
- Watterson, E., Mazur, G. J., Sanabria, F. Validation of a method to assess ADHD-related impulsivity in animal models. Journal of Neuroscience Methods. 252, 36-47 (2015).
- Hackenberg, T. D. Of pigeons and people: some observations on species differences in choice and self-control. Brazilian Journal of Behavior Analysis. 1 (2), 135-147 (2005).
- Asinof, S., Paine, T. A. The 5-choice serial reaction time task: A task of attention and impulse control for rodents. Journal of Visualized Experiments. (90), e51574 (2014).
- Masaki, D., et al. Relationship between limbic and cortical 5-HT neurotransmission and acquisition and reversal learning in a go/no-go task in rats. Psychopharmacology. 189, 249-258 (2006).
- Bari, A., et al. Prefrontal and monoaminergic contributions to stop-signal task performance in rats. The Journal of Neuroscience. 31, 9254-9263 (2011).
- Flagel, S. B., Watson, S. J., Robinson, T. E., Akil, H. Individual differences in the propensity to approach signals vs goals promote different adaptations in the dopamine system of rats. Psychopharmacology. 191, 599-607 (2007).
- Swann, A. C., Lijffijt, M., Lane, S. D., Steinberg, J. L., Moeller, F. G. Trait impulsivity and response inhibition in antisocial personality disorder. Journal of Psychiatric Research. 43 (12), 1057-1063 (2009).
- Lawrence, A. J., Luty, J., Bogdan, N. A., Sahakian, B. J., Clark, L. Impulsivity and response inhibition in alcohol dependence and problem gambling. Psychopharmacology. 207 (1), 163-172 (2009).
- Dougherty, D. M., et al. Behavioral impulsivity paradigms: a comparison in hospitalized adolescents with disruptive behavior disorders. Journal of Child Psychology and Psychiatry. 44 (8), 1145-1157 (2003).
- Rosval, L., et al. Impulsivity in women with eating disorders: Problem of response inhibition, planning, or attention. International Journal of Eating Disorders. 39 (7), 590-593 (2006).
- Huddy, V. C., et al. Reflection impulsivity and response inhibition in first-episode psychosis: relationship to cannabis use. Psychological Medicine. 43 (10), 2097-2107 (2013).

