Tre procedure di laboratorio per valutare diverse manifestazioni di impulsività in ratti
Summary
Presentiamo tre protocolli che valutano le diverse forme di impulsività nei ratti e altri piccoli mammiferi. Le procedure intertemporali valutano la tendenza a sconto il valore dei risultati in ritardo. Rinforzo differenziale di tassi bassi e caratteristica negativa discriminazione valutare capacità di inibizione di risposta con e senza punizione per risposte inadeguate, rispettivamente.
Abstract
Il presente articolo fornisce una guida per la conduzione e l’analisi di tre protocolli basati su condizionata per valutare impulsività in ratti. Impulsività è un concetto significativo perché è associato con patologie psichiatriche in esseri umani e con disadattivi in animali non umani. Si ritiene che l’impulsività è composta di fattori distinti. Ci sono protocolli di laboratorio ideati per valutare ognuno di questi fattori con strumenti automatizzati standardizzati. Attualizzazione di ritardo è associata con l’incapacità di essere motivati da esiti in ritardo. Questo fattore viene valutato attraverso protocolli intertemporali, che consistono di presentare l’individuo con una situazione di scelta che coinvolge una ricompensa immediata e una ricompensa più grande ma in ritardo. Deficit di inibizione di risposta è associata con l’incapacità di trattenere le risposte prepotente. Rinforzo differenziale di tassi bassi (DLR) e protocolli di caratteristica negativa discriminazione valutare il fattore di deficit di inibizione risposta di impulsività. L’ex impone una condizione ad un individuo motivato in cui la maggior parte aspettare un periodo minimo di tempo per una risposta di essere ricompensati. Quest’ultima valuta la capacità degli individui di astenersi dal cibo che cercano le risposte quando viene presentato un segnale di mancanza di cibo. Lo scopo di questi protocolli è quello di costruire una misura quantitativa obiettiva di impulsività, che serve per effettuare confronti inter-specie, consentendo la possibilità di ricerca traslazionale. I vantaggi di questi particolari protocolli includono loro facile set-up e l’applicazione, che deriva dalla quantità relativamente piccola di attrezzatura necessaria e la natura automatizzata di questi protocolli.
Introduction
Impulsività può essere concettualizzata come una dimensione comportamentale associata con esiti disadattivi1. Malgrado l’uso molto diffuso di questo termine, non ci è consenso universale su sua precisa definizione. Infatti, parecchi autori hanno definito impulsività dando esempi di comportamenti impulsivi o delle loro conseguenze, anziché delineare quali aspetti distintivi governano il fenomeno. Per esempio, impulsività è presupposto di coinvolgere un’incapacità di attendere, pianificare, inibire comportamenti prepotent o un’insensibilità a esiti in ritardo2, ed è stato considerato una vulnerabilità di core a comportamenti di dipendenza3. Bari e Robbins4 hanno caratterizzato impulsività come il co-avvenimento di impulsi forti, essere innescato da variabili disposizionale e situazionale e processi inibitori disfunzionali. Una definizione diversa è stata fornita da Mitri e Robbins, che ha dichiarato che impulsività potrebbe essere considerata come una predisposizione alle azioni rapide, spesso precoce, senza comprensione appropriata5. Ancora, un’altra definizione di impulsività, proposta da Sosa e dos Santos6, è una tendenza di comportamento che devia un organismo da massimizzare premi disponibili grazie al controllo acquisito esercitata sopra l’organismo risponde da stimoli per inciso relativo a tali premi.
A causa dei processi comportamentali legati impulsività, suo substrato neurofisiologico coinvolge le strutture in comune con quelli del comportamento motivato, processo decisionale e valorizzazione di ricompensa. Questo è supportato da studi che dimostrano che le strutture del pathway cortico-striatali (ad es., nucleo accumbens [NAc], corteccia prefrontale [PFC], amigdala e caudato putamen [CPU]), come pure il sistema di neurotrasmettitori monoaminergici ascendente, partecipare nell’espressione del comportamento impulsivo7. Tuttavia, il substrato neurale di impulsività è più complesso di quella. Sebbene il NAc e PFC sono coinvolti nel comportamento impulsivo, queste strutture fanno parte di un sistema più complesso e anche sono composti da sottostrutture che hanno funzioni diverse (per la documentazione più dettagliata, vedi de Mitri e Robbins5).
Indipendentemente dalle polemiche sulla sua natura e il substrato biologico, è noto che questa dimensione comportamentale variano tra gli individui, nel qual caso può essere considerato come una caratteristica e negli individui, nel qual caso può essere considerato come una statale8. Impulsività è da tempo riconosciuta come una caratteristica di alcune condizioni psichiatriche, come attention-deficit/hyperactivity disorder (ADHD), abuso di sostanze e di episodi maniacali9. Sembra esserci un consenso elevato che impulsività è composta da molteplici fattori dissociabili, tra cui la mancanza di volontà di aspettare (cioè, un ritardo di attualizzazione), incapacità di astenersi prepotente risposte (cioè, deficit di inibitori), difficoltà a concentrarsi su rilevanti informazioni (cioè, disattenzione) e una tendenza a impegnarsi in situazioni a rischio (cioè, sensazione che cercano)5,10,11. Ciascuno di questi fattori può essere valutata attraverso speciali compiti comportamentali, che vengono generalmente assegnati a due grandi categorie: inibizione di risposta e di scelta (questi possono avere diverse etichette tra ogni tassonomie degli autori). Alcune caratteristiche importanti di tali mansioni comportamentistiche sono che potrebbe essere applicati in diverse specie animali2 e che permettono lo studio di impulsività in condizioni di laboratorio controllate.
Modellazione di una dimensione comportamentale con animali da laboratorio non umano ha una serie di vantaggi tra cui la possibilità di misurazione specifiche, operazionalizzate tendenze comportamentali, consentendo ai ricercatori di in gran parte ridurre le variabili di confusione (ad esempio, contaminazione da passato vita eventi4) e ad attuare le manipolazioni sperimentali quali l’amministrazione farmacologica cronica, eseguendo le lesioni neurotossiche o manipolazioni genetiche. La maggior parte di questi protocolli hanno versioni analogiche per gli esseri umani, che rendono i confronti facile5. D’importanza, utilizzando analoghi di questi protocolli di laboratorio in esseri umani è efficace ausilio alla diagnosi delle patologie psichiatriche, quali ADHD (soprattutto quando più di un protocollo è applicata12).
Come qualsiasi altra misura psicologica, protocolli di laboratorio per la valutazione di impulsività devono rispettare determinati criteri al fine di conseguire l’obiettivo di fornire la comprensione del fenomeno oggetto di studio. Per essere considerato come un appropriato modello di comportamento impulsivo un laboratorio protocollo dovrebbe essere affidabili e possiedono (almeno, in una certa misura) faccia, costrutto, e/o validità predittiva13. Affidabilità potrebbe implicare che un effetto sopra la misura sarebbe replicare se una manipolazione è condotto due o più volte o che la misura è coerenza nel tempo o tra diverse situazioni14,15. La caratteristica ex sarebbe particolarmente utile per gli studi sperimentali, mentre quest’ultimo sarebbe stato così per studi correlazionali14. Faccia validità si riferisce al grado in cui ciò che è misurato è simile al fenomeno che è supposto per essere modellato, quanto a essere, per esempio, risentono le stesse variabili. Validità predittiva si riferisce alla capacità di una misura di previsioni future prestazioni nell’uso dei protocolli, che mirano a misurare lo stesso o un costrutto correlato. Validità di costrutto menziona infine, se il protocollo viene riprodotto il comportamento che è teoricamente corretto per quanto riguarda il processo o processi che presume di essere coinvolti nel fenomeno oggetto di studio. Tuttavia, anche se queste sono le caratteristiche altamente desiderabili, uno dovrebbe essere prudente quando affermando che un protocollo è valido puramente basata su questi criteri16.
Esistono diversi protocolli per misurare impulsività nelle regolazioni del laboratorio. Tuttavia, il presente articolo presenta solo tre metodi: intertemporali, rinforzo differenziale di tassi bassi e la caratteristica negativa discriminazione. Intertemporale procedure mirano a valutare l’attualizzazione di ritardo (cioè, la difficoltà degli esiti in ritardo per controllare il comportamento) componente di impulsività. Il base razionale di questo protocollo sta confrontando soggetti con due ricompense che si differenziano sia in grandezza che in ritardo17. Un’alternativa fornisce una piccola ricompensa immediata (chiamato prima è più piccolo, SS) e l’altro fornisce una ricompensa più grande ma in ritardo (definito più grande dopo, LL). La percentuale di risposte per l’alternativa di SS può essere utilizzata come indice di impulsività18. In rinforzo differenziale delle procedure di tassi bassi, il fattore di impulsività da valutare è l’inibizione di risposta (cioè, incapacità di trattenere le risposte prepotente) quando c’è una contingenza di punizione negativa su blocca inappropriato. Il razionale di questo protocollo sta introducendo soggetti ad una situazione in cui l’unico modo di ottenere ricompense è quello di sospendere la loro risposta19. Infine, procedura di caratteristica negativa discriminazione valuta l’inibizione di risposta quando non c’è nessuna punizione esplicita su blocca inappropriato. Il razionale di questo protocollo (noto anche come pavloviano condizionato l’inibizione o la A + AX-procedura) è quello di valutare la capacità dei soggetti di trattenere inutili risposte20.
Queste procedure si distinguono in confronto agli altri come avendo alcune funzioni utili. Per esempio, le procedure qui presentate sono adatte per essere condotto nelle camere minimamente attrezzata condizionata (noto anche come ‘ la scatola della sbucciatrice’). La figura 1 Mostra un diagramma di una camera tipica condizionata. Condizionata alloggiamenti sono strumenti di ricerca utili a causa di una serie di vantaggi. Essi consentono la raccolta automatizzata di un relativamente grande volume di dati, massimizzando il numero di soggetti valutati per unità di tempo e spazio21. Inoltre, studi comportamentali condotti in condizionata camere richiedono un intervento minimo ricercatore, che riduce il tempo e lo sforzo investito da personale di laboratorio, a differenza di altri metodi disponibili (ad es., non automatizzata T-labirinti, scatole set-shifting) 21. riducendo al minimo intervento dei ricercatori anche aiutare a ridurre il bias dei ricercatori, diminuendo gli effetti di curva di apprendimento dei ricercatori, e una riduzione di movimentazione-indotto stress22. Tipico condizionata chambers sono abbastanza standardizzati per essere utilizzato con i roditori di dimensioni medie, come i ratti (r. norvegicus), ma può essere impiegato per studiare altri taxa, come marsupiali di dimensioni simili (ad es., d. albiventris e L. crassicaudata 23). ci sono anche commerciale condizionata camere adattate per più piccoli (ad es., topi [M. musculus]) e più grandi (ad es., primati non umani) specie. Impostazione e conduzione di protocolli presentati in questo articolo richiedono competenze di programmazione minimale e necessitano di un numero abbastanza basso di ingresso raggiungibile e dispositivi di output, a differenza dei più sofisticati metodi alternativi (ad es., tempo di reazione seriale 5-scelta compito [5- CSRTT]24 e segno-rilevamento25).
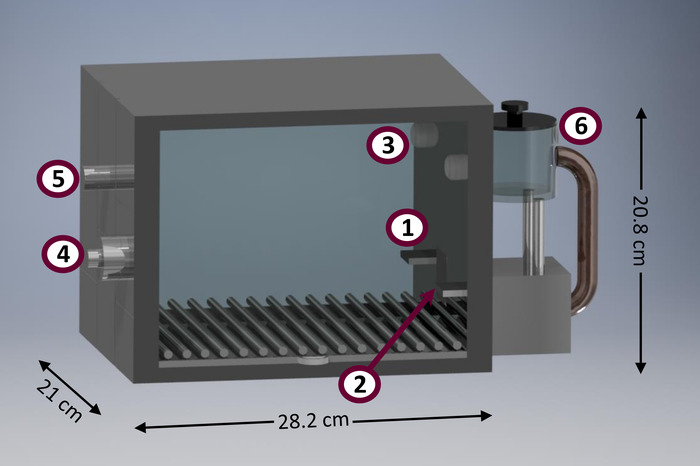
Figura 1: diagramma di un condizionamento prototipo camera. I componenti principali della camera condizionata includono: leva (1) sinistra, presa (2) cibo (dotate di laterale diodi infrarossi per rilevare le voci di testa), (3) la luce focalizzata, (4) altoparlanti per emissione di tono (vista posteriore), luce (5) casa (vista posteriore), cibo (6) erogatore. Clicca qui per visualizzare una versione più grande di questa figura.
Protocol
Representative Results
Discussion
Il presente articolo ha fornito una descrizione di una varietà varie di protocolli per lo screening di impulsività in ratti. Si è sostenuto che questi particolari protocolli sono favoriti per la loro facilità di programmazione e analisi dei dati e richiedono meno dispositivi di funzionamento e di stimolo rispetto ad altre alternative disponibili. Ci sono diversi passaggi cruciali per l’efficace implementazione di questi protocolli, ad esempio (1) producendo una domanda di ricerca, (2) selezione di un disegno dello st…
Declarações
The authors have nothing to disclose.
Acknowledgements
Vorremmo ringraziare Florencia Mata, María Elena Chávez, Miguel Burgos e Alejandro Tapia per fornire assistenza tecnica. Desideriamo anche ringraziare Sarah Gordon Frances per i suoi commenti utili su una precedente bozza di questo articolo e Vladimir Orduña gentilmente fornendo dati grezzi da un documento pubblicato. Grazie a Claudio Nallen per creare il diagramma in Figura 1. Siamo grati alla Dirección de Investigación della Universidad Iberoamericana Ciudad de México per finanziare servizi di correzione di bozze/editing e video producendo le spese.
Materials
| 25 Pin Cables | Med Associates | SG-213F | Connect smart control cards to smart control panels |
| 40 Pin Ribbon Cable | Med Associates | DIG-700C | Connects the computer with the interface cabinet |
| Computer | Dell Computer Company | T8P8T-7G8MR-4YPQV-96C2F-7THHB | For controlling and monitoring protocols’ processes |
| Conductor Cables | Med Associates | SG-210CP-8 | Provide power to the smart control panels via the rack mount power supply |
| Food dispenser with pedestal | Med Associates | ENV-203M-45 (12937) | Silently provides 45 mg food pellets |
| Head-Entry Detector | Med Associates | ENV-254-CB | Uses an infrared photo-beam to detect head entries into the food receptacle |
| House Light | Med Associates | ENV-215M | For providing diffuse illumination inside the chamber |
| Interface Cabinet | Med Associates | SG-6080D | Pod that can hold up to eight smart control cards |
| Med-PC IV Software | Med Associates | SOF-735 | Translate codes into commands for operating outputs and recording/storing input information |
| Multiple tone generator | Med Associates | ENV-223 (597) | For controlling the frequency of the tones |
| Panel fillers | Med Associates | ENV-007-FP | For filling modular walls when devices are not used |
| Pellet Receptacle | Med Associates | ENV-200R2M | Receives and holds food pellets delivered by the dispenser |
| Rack Mount Power Supply | Med Associates | DIG-700F | Provides power to the interface cabinet |
| Retractable Lever | Med Associates | ENV-112CM (10455) | Detects lever-pressing responses; projects into the chamber or retracts as needed |
| Smart Control Cards | Med Associates | DIG-716 | Controls up to eight inputs and four outputs of a conditioning chamber |
| Smart Control Panels | Med Associates | SG-716 (3341) | Connect smart cards to the devices within the conditioning chambers |
| Speaker | Med Associates | ENV-224AM | For providing tones inside the chamber |
| Standard Modular Chambers for Rat | Med Associates | ENV-008 | Made of aluminum channels designed to hold modular devices |
| Standard sound-, light-, and temperature isolating shells | Med Associates | ENV-022MD | Serve to harbor each conditioning chamber |
| Stimulus Light | Med Associates | ENV-221M | For providing a round focalized light stimulus |
| Three Pin Cables | Med Associates | SG-216A-2 | Connects smart control panel with each of the input and output devices in the conditioning chambers |
Referências
- Loxton, N. J. The role of reward sensitivity and impulsivity in overeating and food addiction. Current Addiction Reports. 5 (2), 212-222 (2018).
- Richards, J. B., Gancarz, A. M., Hawk, L. W., Bardo, M. T., Fishbein, D. H., Milich, R. . Inhibitory control and drug abuse prevention. , (2011).
- Gullo, M. J., Loxton, N. J., Dawe, S. Impulsivity: Four ways five fectors are not basic to addiction. Addictive Behaviors. 39 (11), 1547-1556 (2014).
- Bari, A., Robbins, T. W. Inhibition and impulsivity: Behavioral and neural basis of response control. Progress in Neurobiology. 108, 44-79 (2013).
- Dalley, J. W., Robbins, T. W. Fractionating impulsivity: neuropsychiatric implications. Nature Reviews Neuroscience. 18 (3), 158-171 (2017).
- Sosa, R., dos Santos, C. V. Toward a unifying account of impulsivity and the development of self-control. Perspectives in Behavior Science. , 1-32 (2018).
- King, J. A., Tenney, J., Rossi, V., Colamussi, L., Burdick, S. Neural substrates underlying impulsivity. Annals of the New York Academy of Sciences. 1008 (1), 160-169 (2003).
- Stayer, R., Ferring, D., Schmitt, M. J. States and traits in psychological assessment. European Journal of Psychological Assessment. 8 (2), 79-98 (1992).
- Moeller, F. G., Barratt, E. S., Dougherty, D. M., Schmitz, J. M., Swann, A. C. Psychiatric aspects of impulsivity. American Journal of Psychiatry. 158, 1783-1793 (2001).
- Evenden, J. L. Varieties of impulsivity. Psychopharmacology. 146 (4), 348-361 (1999).
- Winstanley, C. A. The utility of rat models of impulsivity in developing pharmacotherapies for impulse control disorders. British Journal of Pharmacology. 164 (4), 1301-1321 (2011).
- Solanto, M. V., et al. The ecological validity of delay aversion and response inhibition as measures of impulsivity in AD/HD: A supplement to the NIMH multimodal treatment study of AD/HD. Journal of Abnormal Child Psychology. 29 (3), 215-218 (2001).
- van der Staay, F. J. Animal models of behavioral dysfunctions: Basic concepts and classifications, and an evaluation strategy. Brain Research Reviews. 52, 131-159 (2006).
- Hedge, C., Powell, G., Summer, P. The reliability paradox: Why robust cognitive tasks do not produce reliable individual differences. Behavioral Research Methods. , 1-21 (2017).
- Nakagawa, S., Schielzeth, H. Repeatability for Gaussian and non-Gaussian data: A practical guide for biologists. Biological Reviews. 85, 935-956 (2010).
- Sjoberg, E. Logical fallacies in animal model research. Behavior and Brain Functions. 13 (1), (2017).
- Rachlin, H. Self-control: Beyond commitment. Behavioral and Brain Sciences. 18 (01), 109 (1995).
- Logue, A. W. Research on self-control: An integrating framework. Behavioral and Brain Sciences. 11 (04), 665 (1988).
- Kramer, T. J., Rilling, M. Differential reinforcement of low rates: A selective critique. Psychological Bulletin. 74 (4), 225-254 (1970).
- Sosa, R., dos Santos, C. V. Conditioned inhibition and its relationship to impulsivity: Empirical and theoretical considerations. The Psychological Record. , (2018).
- Gallistel, C. R., Balci, F., Freestone, D., Kheifets, A., King, A. Automated, quantitative cognitive/behavioral screening of mice: For genetics, pharmacology, animal cognition and undergraduate instruction. Journal of Visualized Experiments. (84), (2014).
- Skinner, B. F. A case history in scientific method. American Psychologist. 11 (5), 221-233 (1956).
- Papini, M. R. Associative learning in the marsupials Didelphis albiventris and Lutreolina crassicaudata. Journal of Comparative Psychology. 102 (1), 21-27 (1988).
- Leonard, J. A. 5 choice serial reaction apparatus. Medical Research Council of Applied Psychology Research. , 326-359 (1959).
- Robinson, T. E., Flagel, S. B. Dissociating the Predictive and Incentive Motivational Properties of Reward-Related Cues Through the Study of Individual Differences. Biological Psychiatry. 65 (10), 869-873 (2009).
- Charan, J., Kantharia, N. D. How to calculate sample size in animal studies?. Journal of Pharmacology and Pharmacotherapeutics. 4 (4), 303-306 (2013).
- Toth, L. A., Gardiner, T. W. Food and water restriction protocols: Physiological and behavioral considerations. Journal of the American Association for Laboratory Animal Science. 39 (6), 9-17 (2000).
- Deluty, M. Z. Self-control and impulsiveness involving aversive events. Journal of Experimental Psychology: Animal Behavior Processes. 4, 250-266 (1978).
- Cabrera, F., Robayo-Castro, B., Covarrubias, P. The ‘huautli’ alternative: Amaranth as reinforcer in operant procedures. Revista Mexicana de Análisis de la Conducta. 36, 71-92 (2010).
- Ferster, C. B., Skinner, B. F. . Schedules of reinforcement. , (1957).
- Orduña, V., Valencia-Torres, L., Bouzas, A. DRL performance of spontaneously hypertensive rats: Dissociation of timing and inhibition of responses. Behavioural Brain Research. 201 (1), 158-165 (2009).
- Freestone, D. M., Balci, F., Simen, P., Church, R. Optimal response rates in humans and animals. Journal of Experimental Psychology: Animal Behavior and Cognition. 41 (1), 39-51 (2015).
- Sanabria, F., Killeen, P. R. Evidence for impulsivity in the Spontaneously Hypertensive Rat drawn from complementary response-withholding tasks. Behavioral and Brain Functions. 4 (1), 7 (2008).
- van den Bergh, F. S., et al. Spontaneously hypertensive rats do not predict symptoms of attention-deficit hyperactivity disorder. Pharmacology, Biochemistry, and Behavior. 83, 11 (2006).
- Topping, J. S., Pickering, J. W. Effects of punishing different bands of IRTs on DRL responding. Psychological Reports. 31 (19-22), (1972).
- Richards, J. B., Sabol, K. E., Seiden, L. S. DRL interresponse-time distributions: quantification by peak deviation analysis. Journal of the Experimental Analysis of Behavior. 60 (2), 361-385 (1993).
- Orduña, V. Impulsivity and sensitivity to amount and delay of reinforcement in an animal model of ADHD. Behavioural Brain Research. 294, 62-71 (2015).
- Harmer, C. J., Phillips, G. D. Enhanced conditioned inhibition following repeated pretreatment with d -amphetamine. Psychopharmacology. 142 (2), 120-131 (1999).
- Lister, S., Pearce, J. M., Butcher, S. P., Collard, K. J., Foster, G. Acquisition of conditioned inhibition in rats is impaired by ablation of serotoninergic pathways. European Journal of Neuroscience. 8, 415-423 (1996).
- Meyer, H. C., Bucci, D. J. The contribution of medial prefrontal cortical regions to conditioned inhibition. Behavioral Neuroscience. 128 (6), 644-653 (2014).
- McNicol, D. . A primer of signal detection theory. , (1972).
- Carnero, S., Morís, J., Acebes, F., Loy, I. Percepción de la contingencia en ratas: Modulación fechneriana y metodología de la detección de señales. Revista Electrónica de Metodología Aplicada. 14 (2), (2009).
- López, H. H., Ettenberg, A. Dopamine antagonism attenuates the unconditioned incentive value of estrus female cues. Pharmacology, Biochemistry, and Behavior. 68, 411-416 (2001).
- Schotte, A., Janssen, P. F. M., Megens, A. A. H. P., Leysen, J. E. Occupancy of central neurotransmitter receptors by risperidone, clozapine and haloperidol, measured ex vivo. Brain Research. 631 (2), 191-202 (1993).
- van Hest, A., van Haaren, F., van de Poll, N. Haloperidol, but not apomorphine, differentially affects low response rates of male and female wistar rats. Pharmacology, Biochemistry, and Behavior. 29, 529-532 (1988).
- Finnegan, K. T., Ricaurte, G., Seiden, L. S., Schuster, C. R. Altered sensitivity to d-methylamphetamine, apomorphine, and haloperidol in rhesus monkeys depleted of caudate dopamine by repeated administration of d-methylamphetamine. Psychopharmacology. 77, 43-52 (1982).
- Britton, K. T., Koob, G. F. Effects of corticotropin releasing factor, desipramine and haloperidol on a DRL schedule of reinforcement. Pharmacology, Biochemistry, and Behavior. 32, 967-970 (1989).
- Maricq, A. V., Church, R. The differential effects of haloperidol and metamphetamine on time estimation in the rat. Psychopharmacology. 79, 10-15 (1983).
- Dalley, J. W., et al. Nucleus accumbens D2/3 receptors predict trait impulsivity and cocaine reinforcement. Science. 315, 1267-1270 (2007).
- Cole, B. J., Robbins, T. W. Effects of 6-hydroxydopamine lesions of the nucleus accumbens septi on performance of a 5-choice serial reaction time task in rats: Implications for theories of selective attention and arousal. Behavior and Brain Research. 33, 165-179 (1989).
- Reynolds, B., de Wit, H., Richards, J. B. Delay of gratification and delay discounting in rats. Behavioural Processes. 59 (3), 157-168 (2002).
- Evenden, J. L., Ryan, C. N. The pharmacology of impulsive behavior in rats: The effects of drugs on response choice with varying delays of reinforcement. Psychopharmacology. 128, 161-170 (1996).
- Autor, S. M., Hendry, D. P. . Conditioned reinforcement. , (1969).
- van den Broek, M. D., Bradshaw, C. M., Szabadi, E. Behaviour of ‘impulsive’ and ‘non-impulsive’ humans in a temporal differentiation schedule of reinforcement. Personality and Individual Differences. 8 (2), 233-239 (1987).
- McGuire, P. S., Seiden, L. S. The effects of tricyclicantidepressants on performance under a differential-reinforcement-of-low-rates schedule in rats. Journal of Pharmacology and Experimental Therapeutics. 214 (3), 635-641 (1980).
- O’Donnell, J. M., Seiden, L. S. Differential-reinforcement-of-low-rates 72-second schedule: Selective effects of antidepressant drugs. Journal of Pharmacology and Experimental Therapeutics. 224 (1), 80-88 (1983).
- Seiden, L. S., Dahms, J. L., Shaughnessy, R. A. Behavioral screen for antidepressants: The effects of drugs and electroconvulsive shock on performance under a differential-reinforcement-of-low-rates schedule. Psychopharmacology. 86, 55-60 (1985).
- He, Z., Cassaday, H. J., Howard, R. C., Khalifa, N., Bonardi, C. Impaired Pavlovian conditioned inhibition in offenders with personality disorders. The Quarterly Journal of Experimental Psychology. 64 (12), 2334-2351 (2011).
- He, Z., Cassaday, H. J., Bonardi, C., Bibi, P. A. Do personality traits predict individual differences in excitatory and inhibitory learning?. Frontiers in Psychology. 4, 1-12 (2013).
- Bucci, D. J., Hopkins, M. E., Keene, C. S., Sharma, M., Orr, L. E. Sex differences in learning and inhibition in spontaneously hypertensive rats. Behavioural Brain Research. 187 (1), 27-32 (2008).
- Gershon, J. A meta-analytic review of gender differences in ADHD. Journal of Attention Disorders. 5, 143-154 (2012).
- Mobini, S., et al. Effects of lesions of the orbitofrontal cortex on sensitivity to delayed and probabilistic reinforcement. Psychopharmacology. 160 (3), 290-298 (2002).
- Bouton, M. E., Nelson, J. B. Context-specificity of target versus feature inhibition in a negative-feature discrimination. Journal of Experimental Psychology: Animal Behavior Processes. 20 (1), 51-65 (1994).
- Bouton, M. E., Nelson, J. B., Schmajuk, N., Holland, P. . Occasion setting: Associative learning and cognition in animals. , 69-112 (1998).
- Rescorla, R. A. Pavlovian conditioned inhibition. Psychological Bulletin. 72 (2), 77-94 (1969).
- Miller, R. R., Matzel, L. D., Bower, G. H. . The psychology of learning and motivation. , (1988).
- Williams, D. A., Overmier, J. B., Lolordo, V. M. A reevaluation of Rescorla’s early dictums about conditioned inhibition. Psychological Bulletin. 111 (2), 275-290 (1992).
- Papini, M. R., Bitterman, M. E. The two-test strategy in the study of inhibitory conditioning. Psychological Review. 97 (3), 396-403 (1993).
- Sosa, R., Ramírez, M. N. Conditioned inhibition: Critiques and controversies in the light of recent advances. Journal of Experimental Psychology: Animal Behavior and Cognition. , (2018).
- Fox, A. T., Hand, D. J., Reilly, M. P. Impulsive choice in a rodent model of attention-deficit/hyperactivity disorder. Behavioural Brain Research. 187, 146-152 (2008).
- Foscue, E. P., Wood, K. N., Schramm-Sapyta, N. L. Characterization of a semi-rapid method for assessing delay discounting in rodents. Pharmacology, Biochemistry, and Behavior. 101, 187-192 (2012).
- Brucks, D., Marshall-Pescini, S., Wallis, L. J., Huber, L., Range, F. Measures of Dogs’ Inhibitory Control Abilities Do Not Correlate across Tasks. Frontiers in Psychology. 8, (2017).
- McDonald, J., Schleifer, L., Richards, J. B., de Wit, H. Effects of THC on Behavioral Measures of Impulsivity in Humans. Neuropsychopharmacology. 28 (7), 1356-1365 (2003).
- Reynolds, B., Ortengren, A., Richards, J. B., de Wit, H. Dimensions of impulsive behavior: Personality and behavioral measures. Personality and Individual Differences. 40 (2), 305-315 (2006).
- Dellu-Hagedorn, F. Relationship between impulsivity, hyperactivity and working memory: a differential analysis in the rat. Behavioral and Brain Functions. 2 (10), 18 (2006).
- López, P., Alba, R., Orduña, V. Individual differences in incentive salience attribution are not related to suboptimal choice in rats. Behavior and Brain Research. 341 (2), 71-78 (2017).
- Ho, M. Y., Al-Zahrani, S. S. A., Al-Ruwaitea, A. S. A., Bradshaw, C. M., Szabadi, E. 5-Hydroxytryptamine and impulse control: prospects for a behavioural analysis. Journal of Psychopharmacology. 12 (1), 68-78 (1998).
- Sagvolden, T., Russell, V. A., Aase, H., Johansen, E. B., Farshbaf, M. Rodent models of attention-deficit/hyperactivity disorder. Biological Psychiatry. 57, 9 (2005).
- Tomie, A., Aguado, A. S., Pohorecky, L. A., Benjamin, D. Ethanol induces impulsive-like responding in a delay-of-reward operant choice procedure: impulsivity predicts autoshaping. Psychopharmacology. 139 (4), 376-382 (1998).
- Monterosso, J., Ainslie, G. Beyond discounting: possible experimental models of impulse control. Psychopharmacology. 146 (4), 339-347 (1999).
- Burguess, M. A., Rabbit, P. . Methodology of frontal and executive function. , 81-116 (1997).
- Watterson, E., Mazur, G. J., Sanabria, F. Validation of a method to assess ADHD-related impulsivity in animal models. Journal of Neuroscience Methods. 252, 36-47 (2015).
- Hackenberg, T. D. Of pigeons and people: some observations on species differences in choice and self-control. Brazilian Journal of Behavior Analysis. 1 (2), 135-147 (2005).
- Asinof, S., Paine, T. A. The 5-choice serial reaction time task: A task of attention and impulse control for rodents. Journal of Visualized Experiments. (90), e51574 (2014).
- Masaki, D., et al. Relationship between limbic and cortical 5-HT neurotransmission and acquisition and reversal learning in a go/no-go task in rats. Psychopharmacology. 189, 249-258 (2006).
- Bari, A., et al. Prefrontal and monoaminergic contributions to stop-signal task performance in rats. The Journal of Neuroscience. 31, 9254-9263 (2011).
- Flagel, S. B., Watson, S. J., Robinson, T. E., Akil, H. Individual differences in the propensity to approach signals vs goals promote different adaptations in the dopamine system of rats. Psychopharmacology. 191, 599-607 (2007).
- Swann, A. C., Lijffijt, M., Lane, S. D., Steinberg, J. L., Moeller, F. G. Trait impulsivity and response inhibition in antisocial personality disorder. Journal of Psychiatric Research. 43 (12), 1057-1063 (2009).
- Lawrence, A. J., Luty, J., Bogdan, N. A., Sahakian, B. J., Clark, L. Impulsivity and response inhibition in alcohol dependence and problem gambling. Psychopharmacology. 207 (1), 163-172 (2009).
- Dougherty, D. M., et al. Behavioral impulsivity paradigms: a comparison in hospitalized adolescents with disruptive behavior disorders. Journal of Child Psychology and Psychiatry. 44 (8), 1145-1157 (2003).
- Rosval, L., et al. Impulsivity in women with eating disorders: Problem of response inhibition, planning, or attention. International Journal of Eating Disorders. 39 (7), 590-593 (2006).
- Huddy, V. C., et al. Reflection impulsivity and response inhibition in first-episode psychosis: relationship to cannabis use. Psychological Medicine. 43 (10), 2097-2107 (2013).

