Drei Laborverfahren für die Beurteilung der unterschiedliche Erscheinungsformen von Impulsivität bei Ratten
Summary
Wir präsentieren Ihnen drei Protokolle, die verschiedene Formen der Impulsivität bei Ratten und andere Kleinsäuger zu bewerten. Intertemporale Wahl Verfahren bewerten die Tendenz, den Wert der verspäteten Ergebnisse Rabatt. Differentielle Verstärkung von niedrigen Zinsen und Feature-Negative Diskriminierung bewerten bzw. Hemmung der Reaktionsfähigkeit mit und ohne Strafe für unangemessene Reaktionen.
Abstract
Der vorliegende Artikel bietet einen Leitfaden für die Durchführung und Analyse von drei Klimaanlage-basierte Protokolle, Impulsivität bei Ratten zu bewerten. Impulsivität ist ein sinnvolles Konzept, weil es mit psychiatrischen Erkrankungen beim Menschen und maladaptive Verhalten bei nichtmenschlichen Tieren assoziiert ist. Es wird vermutet, dass Impulsivität getrennte Faktoren besteht. Es gibt Laborprotokolle entwickelt, um jeden dieser Faktoren mit standardisierten und automatisierten Anlagen zu bewerten. Verzögerung Abzinsung ist verbunden mit dem Unvermögen, motiviert durch verzögerte Ergebnisse. Dieser Faktor wird durch intertemporale Wahl Protokolle, ausgewertet, die das Individuum zu präsentieren, mit einer Wahl Situation im Zusammenhang mit eine sofortige Belohnung und eine größere aber verzögerte Belohnung bestehen. Reaktion Hemmung Defizit ist verbunden mit dem Unvermögen, dominant Antworten zurückhalten. Differentielle Verstärkung der niedrigen Zinsen (DLR) und Feature-Negative Diskriminierung Protokolle bewerten Hemmung Defizit Responsefaktor der Impulsivität. Erstere stellt eine Bedingung für eine motivierte Person, in der meisten warten einen Mindestzeitraum für eine Reaktion belohnt werden. Dieser wertet der Fähigkeit von Individuen zu unterlassen Essen Antworten zu suchen, wenn ein Signal für das Fehlen von Lebensmitteln vorgestellt wird. Diese Protokolle soll eine objektive quantitative Bestimmung der Impulsivität, zu konstruieren, die zu Cross-Arten vergleichen, wobei die Möglichkeit der translationalen Forschung dient. Die Vorteile dieser bestimmte Protokolle sind ihre einfache Einrichtung und Anwendung, die aus der verhältnismäßig geringe Umfang der Ausrüstung und der automatisierten Natur dieser Protokolle herrührt.
Introduction
Impulsivität kann als verhaltensbezogene Dimension zugeordneten maladaptive Ergebnisse1konzipiert. Trotz der weit verbreiteten Verwendung dieses Begriffs gibt es keinen allgemeinen Konsens über die genaue Definition. In der Tat sind mehrere Autoren Impulsivität von Beispielen von impulsiven Verhaltensweisen oder deren Folgen, anstatt die Abgrenzung, welche Besonderheiten das Phänomen regieren definiert. Zum Beispiel wird angenommen, dass Impulsivität beinhalten eine Unfähigkeit zu warten, planen, hemmen dominant Verhalten oder eine Unempfindlichkeit gegen verzögerte Ergebnisse2, und es wurde als eine Kern-Anfälligkeit für Suchtverhalten3. Bari und Robbins4 haben Impulsivität als das gleichzeitige Auftreten von starken Impulse, ausgelöst durch dispositionellen und situative Variablen und dysfunktionalen hemmenden Prozesse geprägt. Eine andere Definition sorgte Dalley und Robbins, die erklärte, dass Impulsivität als eine Prädisposition für schnelle, oft verfrüht, Aktionen ohne entsprechende Einsicht5angesehen werden konnte. Doch eine andere Definition der Impulsivität, vorgeschlagen von Sosa und Dos Santos6, Verhalten neigen, die einen Organismus aus verfügbaren Prämien aufgrund der erworbenen Kontrolle ausgeübt über des Organismus zu maximieren abweicht von Reizen im übrigen reagiert in Bezug auf die Belohnungen.
Aufgrund der Verhaltensstörungen Prozesse im Zusammenhang mit Impulsivität bezieht seine neurophysiologischen Substrat Strukturen gemeinsam mit motivierten Verhalten, Entscheidungsfindung und Belohnung zu schätzen. Unterstützt wird dies durch Studien, die zeigen, dass die Strukturen der Cortico-striatalen Weg (z. B. Nucleus Accumbens [NAc], präfrontalen Kortex [PFC], Amygdala und caudatus Putamen [CPU]) sowie die aufsteigende monoaminergen Neurotransmitter-System beteiligen in der Expression von impulsivem Verhalten7. Das neuronale Substrat der Impulsivität ist jedoch komplizierter als das. Obwohl NAc und PFC impulsives Verhalten beteiligt sind, diese Strukturen sind Teil eines komplexen Systems, und auch bestehen von Teilstrukturen, die unterschiedliche Funktionen haben (für ausführlichere Dokumentation siehe Dalley und Robbins5).
Unabhängig von den Kontroversen über seine Natur und biologisches Substrat dieser Verhaltensstörungen Dimension ist bekannt, dass über Individuen variieren, in diesem Fall kann als eine Eigenschaft und innerhalb von Individuen, in welchem Fall es kann betrachtet werden als ein Staat8. Impulsivität ist lange als ein Feature von einigen psychiatrischen Erkrankungen, wie z. B. Aufmerksamkeitsdefizit-/Hyperaktivitätsstörung (ADHS), Drogenmissbrauch und manischer Episoden9anerkannt. Es scheint ein hoher Konsens, dass Impulsivität durch mehrere Faktoren trennbar, besteht einschließlich Unwillen zu warten (d. h. verzögern, Diskontierung), Unfähigkeit zu dominant Antworten (d. h. hemmenden Defizit), Schwierigkeiten sich auf relevante Informationen (z. B. Unaufmerksamkeit) und eine Tendenz sich in riskanten Situationen (z. B. Gefühl suchen)5,10,11. Jeder dieser Faktoren beurteilt werden kann, durch behavioral Sonderaufgaben, die in der Regel zwei Kategorien zugeordnet werden: Wahl und Reaktion Hemmung (diese möglicherweise verschiedene Etiketten zwischen den einzelnen Autoren Taxonomien). Einige wichtige Merkmale solcher Verhaltensstörungen Aufgaben sind, dass sie über mehrere Tierarten2 angewendet werden könnte und sie studieren Impulsivität unter kontrollierten Laborbedingungen.
Modellierung mit Labor nichtmenschliche Tiere eine verhaltensbezogene Dimension hat eine Reihe von Vorteilen, einschließlich der Möglichkeit der Messung konkrete und operationalisierte Verhaltenstendenzen, so dass die Forscher weitgehend konfundierenden Variablen (z. B. reduzieren Kontamination von vergangenen Leben Ereignisse4) und experimentelle Manipulationen wie chronische pharmakologische Verwaltung, Durchführung von neurotoxischen Läsionen oder genetische Manipulationen durchzuführen. Die meisten dieser Protokolle haben analoge Versionen für Menschen, die Vergleiche einfach5machen. Wichtig ist, ist die Verwendung von Analoga dieser Labor-Protokolle in Menschen wirksam zur Unterstützung der Diagnose von psychiatrischen Erkrankungen wie ADHS (vor allem, wenn mehr als ein Protokoll angewandte12).
Wie jede andere psychologische Messung einzuhalten Laborprotokolle für die Beurteilung der Impulsivität bestimmten Kriterien in der Reihenfolge zur Erreichung des Ziels der Einblicke in das Phänomen untersucht. Gelten als ein geeignetes Modell des impulsiven Verhaltens ein Labor Protokoll sollte zuverlässig sein, und besitzen (zumindest in einem gewissen Grad) Gesicht, konstruieren und/oder prädiktive Gültigkeit13. Zuverlässigkeit kann bedeuten, dass eine Wirkung auf die Messung replizieren würde, wenn eine Manipulation zwei oder mehrere Male durchgeführt wird oder, dass die Messung im Laufe der Zeit oder in verschiedenen Situationen14,15entspricht. Die ehemalige Funktion wäre besonders nützlich für experimentelle Studien, während letzteres dies für korrelative Studien14 wäre. Augenscheinvalidität bezieht sich auf das Ausmaß, in dem was gemessen wird das Phänomen dem modelliert werden ähnelt, als, zum Beispiel durch die gleichen Variablen beeinflusst, soll. Prädiktive Gültigkeit bezieht sich auf die Fähigkeit einer Maßnahme, die zukünftige Wertentwicklung in den Protokollen, Prognose, die darauf abzielen, die gleiche oder eine ähnliche Konstrukt messen. Konstruktvalidität bezieht sich schließlich, ob das Protokoll Verhalten, die theoretisch fundiert in Bezug auf den Prozess oder Verfahren davon ausgegangen reproduziert, dass das Phänomen unter Studie beteiligt ist. Jedoch obwohl diese höchst wünschenswerten Eigenschaften sind, sollte man vorsichtig sein, wenn besagt, dass ein Protokoll gültig ist, rein basierend auf diesen Kriterien16.
Es gibt mehrere Protokolle, Impulsivität in Labor-Einstellungen zu messen. Der vorliegende Artikel stellt jedoch nur drei solche Methoden: intertemporale Wahl, differentielle Verstärkung von niedrigen Zinsen und Feature-Negative Diskriminierung. Intertemporale Verfahren zielen darauf ab, beurteilen die Verzögerung Abzinsung (d. h. der Schwierigkeit der verzögerten Ergebnisse um Verhalten zu steuern) Bestandteil der Impulsivität. Das Grundprinzip dieses Protokolls ist Themen konfrontiert mit zwei Belohnungen, die sich in Größe und Verzögerung17unterscheiden. Eine Alternative bietet eine kleine sofortige Belohnung (als kleiner früher SS) und andererseits eine größere aber verzögerte Belohnung (genannt größere später LL). Der Anteil der Antworten auf die SS-Alternative kann als Index der Impulsivität18verwendet werden. In differentielle Verstärkung der günstigen Tarifen Verfahren, ist der Faktor Impulsivität zu bewertenden Reaktion Hemmung (z. B. Arbeitsunfähigkeit, dominant Antworten zurückzuhalten) Wann gibt es eine negative Strafe Kontingenz auf unangemessene Reaktion. Das Grundprinzip dieses Protokolls führt Themen zu einer Situation, in dem die einzige Möglichkeit Prämien zu erhalten ihrer reagiert19anhalten soll. Schließlich wertet Feature-Negative Diskriminierung Verfahren Reaktion Hemmung, wenn es keine explizite Strafe auf unangemessene Reaktion gibt. Das Grundprinzip dieses Protokolls (auch bekannt als Pawlowschen konditioniert, Hemmung oder der A + / AX-Verfahren) soll Themen Fähigkeit, zurückzuhalten, unnötige Antworten20bewertet.
Diese Verfahren zeichnen sich im Vergleich zu anderen als einige praktischen Funktionen. Zum Beispiel eignen sich die hier vorgestellten Verfahren für in minimal ausgestatteten Klimaanlage Kammern (auch bekannt als “die Skinner Box”) durchgeführt. Abbildung 1 zeigt ein Diagramm einer typischen Klimaanlage-Kammer. Klimaanlage-Kammern sind nützliche Forschungsinstrumente durch eine Reihe von Vorteilen. Sie können automatisierte Erfassung der eine relativ große Menge von Daten, maximiert die Anzahl der Themen, die für die Einheit von Zeit und Raum21bewertet. Darüber hinaus Verhaltensstudien durchgeführt in Kammern Konditionierung erfordern minimale Forscher Intervention, die die Zeit und Mühe investiert von Laborpersonal, im Gegensatz zu anderen Methoden (z. B. nichtautomatisierte T-Labyrinthe, Boxen Set-shifting) reduziert 21. Forscher Intervention zu minimieren helfen auch bei der Verringerung der Forscher Voreingenommenheit, Verringerung der Auswirkungen der Forscher Lernkurve, und eine Reduzierung der Handling-induzierten stress22. Typische Klimaanlage Kammern sind ziemlich standardisiert, um mit mittlerer Größe Nagetiere wie Ratten (R. Norvegicus), verwendet werden, sondern können eingesetzt werden, um anderen Taxa, wie ähnlich großen Beuteltiere (z. B. D. Albiventris und L. Crassicaudata studieren 23). es gibt auch kommerzielle Klimaanlage angepasste für kleinere Kammern (z. B. Mäuse [M. Musculus]) und größer (z. B. Primaten) Arten. Einrichtung und Durchführung der in diesem Artikel vorgestellten Protokolle erfordern minimale Programmierkenntnisse und verlangen ganz wenige erreichbare Eingabe- und Ausgabegeräte, im Gegensatz zu alternativen Methoden (z. B. serielle Reaktionszeit 5-Choice-Aufgabe [5- CSRTT]24 und Zeichen-Tracking-25).
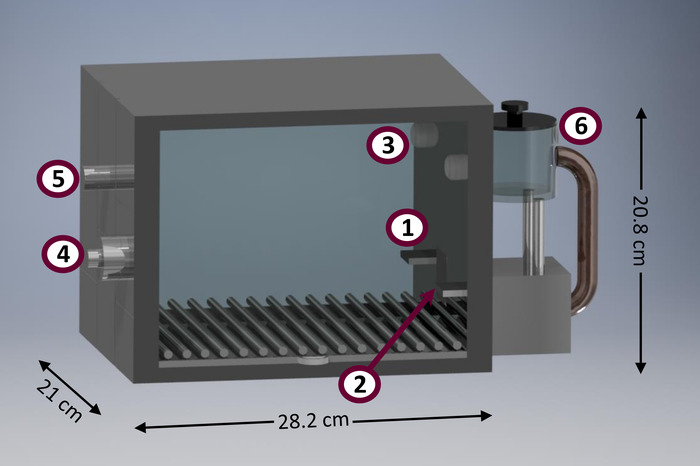
Abbildung 1: Schematische Darstellung einer Konditionierung Kammer Prototyp. Die Hauptkomponenten der Klimaanlage Kammer gehören: (1) linken Hebel, (2) Lebensmittel-Behälter (ausgestattet mit seitlichen Infrarotdioden, Kopf Einträge zu erkennen), (3) konzentrierter Licht (4) Lautsprecher für Ton Emission (Rückansicht), (5) Haus Licht (Rückansicht), Lebensmittel (6) Dispenser. Bitte klicken Sie hier für eine größere Version dieser Figur.
Protocol
Representative Results
Discussion
Der vorliegende Artikel lieferte eine Beschreibung Diverses verschiedener Protokolle für das screening von Impulsivität bei Ratten. Es wird argumentiert, dass diese bestimmte Protokolle für die einfache Programmierung und Datenanalyse begünstigt sind und erfordern weniger Betriebs- und Reiz-Geräte als Alternativen zur Verfügung. Es gibt mehrere entscheidende Schritte für die wirksame Umsetzung dieser Protokolle, wie z. B. (1) eine Forschungsfrage nachgeben, (2) eine entsprechende Studiendesign auswählen, (3) das …
Declarações
The authors have nothing to disclose.
Acknowledgements
Wir möchte Florencia Mata, María Elena Chávez, Miguel Burgos und Alejandro Tapia danken für die Bereitstellung technischer Hilfe. Wir möchten auch Danke Sarah Gordon Frances für ihre hilfreichen Anmerkungen zu einem früheren Entwurf des vorliegenden Artikels und Vladimir Orduña freundlicherweise die Rohdaten aus einem veröffentlichten Papier. Dank Claudio Nallen für das Diagramm in Abbildung 1zu schaffen. Wir sind dankbar, Dirección de Investigación von der Universidad Iberoamericana Ciudad de México für Korrektorat/Lektorat Dienstleistungen und das Video produziert Ausgaben finanzieren.
Materials
| 25 Pin Cables | Med Associates | SG-213F | Connect smart control cards to smart control panels |
| 40 Pin Ribbon Cable | Med Associates | DIG-700C | Connects the computer with the interface cabinet |
| Computer | Dell Computer Company | T8P8T-7G8MR-4YPQV-96C2F-7THHB | For controlling and monitoring protocols’ processes |
| Conductor Cables | Med Associates | SG-210CP-8 | Provide power to the smart control panels via the rack mount power supply |
| Food dispenser with pedestal | Med Associates | ENV-203M-45 (12937) | Silently provides 45 mg food pellets |
| Head-Entry Detector | Med Associates | ENV-254-CB | Uses an infrared photo-beam to detect head entries into the food receptacle |
| House Light | Med Associates | ENV-215M | For providing diffuse illumination inside the chamber |
| Interface Cabinet | Med Associates | SG-6080D | Pod that can hold up to eight smart control cards |
| Med-PC IV Software | Med Associates | SOF-735 | Translate codes into commands for operating outputs and recording/storing input information |
| Multiple tone generator | Med Associates | ENV-223 (597) | For controlling the frequency of the tones |
| Panel fillers | Med Associates | ENV-007-FP | For filling modular walls when devices are not used |
| Pellet Receptacle | Med Associates | ENV-200R2M | Receives and holds food pellets delivered by the dispenser |
| Rack Mount Power Supply | Med Associates | DIG-700F | Provides power to the interface cabinet |
| Retractable Lever | Med Associates | ENV-112CM (10455) | Detects lever-pressing responses; projects into the chamber or retracts as needed |
| Smart Control Cards | Med Associates | DIG-716 | Controls up to eight inputs and four outputs of a conditioning chamber |
| Smart Control Panels | Med Associates | SG-716 (3341) | Connect smart cards to the devices within the conditioning chambers |
| Speaker | Med Associates | ENV-224AM | For providing tones inside the chamber |
| Standard Modular Chambers for Rat | Med Associates | ENV-008 | Made of aluminum channels designed to hold modular devices |
| Standard sound-, light-, and temperature isolating shells | Med Associates | ENV-022MD | Serve to harbor each conditioning chamber |
| Stimulus Light | Med Associates | ENV-221M | For providing a round focalized light stimulus |
| Three Pin Cables | Med Associates | SG-216A-2 | Connects smart control panel with each of the input and output devices in the conditioning chambers |
Referências
- Loxton, N. J. The role of reward sensitivity and impulsivity in overeating and food addiction. Current Addiction Reports. 5 (2), 212-222 (2018).
- Richards, J. B., Gancarz, A. M., Hawk, L. W., Bardo, M. T., Fishbein, D. H., Milich, R. . Inhibitory control and drug abuse prevention. , (2011).
- Gullo, M. J., Loxton, N. J., Dawe, S. Impulsivity: Four ways five fectors are not basic to addiction. Addictive Behaviors. 39 (11), 1547-1556 (2014).
- Bari, A., Robbins, T. W. Inhibition and impulsivity: Behavioral and neural basis of response control. Progress in Neurobiology. 108, 44-79 (2013).
- Dalley, J. W., Robbins, T. W. Fractionating impulsivity: neuropsychiatric implications. Nature Reviews Neuroscience. 18 (3), 158-171 (2017).
- Sosa, R., dos Santos, C. V. Toward a unifying account of impulsivity and the development of self-control. Perspectives in Behavior Science. , 1-32 (2018).
- King, J. A., Tenney, J., Rossi, V., Colamussi, L., Burdick, S. Neural substrates underlying impulsivity. Annals of the New York Academy of Sciences. 1008 (1), 160-169 (2003).
- Stayer, R., Ferring, D., Schmitt, M. J. States and traits in psychological assessment. European Journal of Psychological Assessment. 8 (2), 79-98 (1992).
- Moeller, F. G., Barratt, E. S., Dougherty, D. M., Schmitz, J. M., Swann, A. C. Psychiatric aspects of impulsivity. American Journal of Psychiatry. 158, 1783-1793 (2001).
- Evenden, J. L. Varieties of impulsivity. Psychopharmacology. 146 (4), 348-361 (1999).
- Winstanley, C. A. The utility of rat models of impulsivity in developing pharmacotherapies for impulse control disorders. British Journal of Pharmacology. 164 (4), 1301-1321 (2011).
- Solanto, M. V., et al. The ecological validity of delay aversion and response inhibition as measures of impulsivity in AD/HD: A supplement to the NIMH multimodal treatment study of AD/HD. Journal of Abnormal Child Psychology. 29 (3), 215-218 (2001).
- van der Staay, F. J. Animal models of behavioral dysfunctions: Basic concepts and classifications, and an evaluation strategy. Brain Research Reviews. 52, 131-159 (2006).
- Hedge, C., Powell, G., Summer, P. The reliability paradox: Why robust cognitive tasks do not produce reliable individual differences. Behavioral Research Methods. , 1-21 (2017).
- Nakagawa, S., Schielzeth, H. Repeatability for Gaussian and non-Gaussian data: A practical guide for biologists. Biological Reviews. 85, 935-956 (2010).
- Sjoberg, E. Logical fallacies in animal model research. Behavior and Brain Functions. 13 (1), (2017).
- Rachlin, H. Self-control: Beyond commitment. Behavioral and Brain Sciences. 18 (01), 109 (1995).
- Logue, A. W. Research on self-control: An integrating framework. Behavioral and Brain Sciences. 11 (04), 665 (1988).
- Kramer, T. J., Rilling, M. Differential reinforcement of low rates: A selective critique. Psychological Bulletin. 74 (4), 225-254 (1970).
- Sosa, R., dos Santos, C. V. Conditioned inhibition and its relationship to impulsivity: Empirical and theoretical considerations. The Psychological Record. , (2018).
- Gallistel, C. R., Balci, F., Freestone, D., Kheifets, A., King, A. Automated, quantitative cognitive/behavioral screening of mice: For genetics, pharmacology, animal cognition and undergraduate instruction. Journal of Visualized Experiments. (84), (2014).
- Skinner, B. F. A case history in scientific method. American Psychologist. 11 (5), 221-233 (1956).
- Papini, M. R. Associative learning in the marsupials Didelphis albiventris and Lutreolina crassicaudata. Journal of Comparative Psychology. 102 (1), 21-27 (1988).
- Leonard, J. A. 5 choice serial reaction apparatus. Medical Research Council of Applied Psychology Research. , 326-359 (1959).
- Robinson, T. E., Flagel, S. B. Dissociating the Predictive and Incentive Motivational Properties of Reward-Related Cues Through the Study of Individual Differences. Biological Psychiatry. 65 (10), 869-873 (2009).
- Charan, J., Kantharia, N. D. How to calculate sample size in animal studies?. Journal of Pharmacology and Pharmacotherapeutics. 4 (4), 303-306 (2013).
- Toth, L. A., Gardiner, T. W. Food and water restriction protocols: Physiological and behavioral considerations. Journal of the American Association for Laboratory Animal Science. 39 (6), 9-17 (2000).
- Deluty, M. Z. Self-control and impulsiveness involving aversive events. Journal of Experimental Psychology: Animal Behavior Processes. 4, 250-266 (1978).
- Cabrera, F., Robayo-Castro, B., Covarrubias, P. The ‘huautli’ alternative: Amaranth as reinforcer in operant procedures. Revista Mexicana de Análisis de la Conducta. 36, 71-92 (2010).
- Ferster, C. B., Skinner, B. F. . Schedules of reinforcement. , (1957).
- Orduña, V., Valencia-Torres, L., Bouzas, A. DRL performance of spontaneously hypertensive rats: Dissociation of timing and inhibition of responses. Behavioural Brain Research. 201 (1), 158-165 (2009).
- Freestone, D. M., Balci, F., Simen, P., Church, R. Optimal response rates in humans and animals. Journal of Experimental Psychology: Animal Behavior and Cognition. 41 (1), 39-51 (2015).
- Sanabria, F., Killeen, P. R. Evidence for impulsivity in the Spontaneously Hypertensive Rat drawn from complementary response-withholding tasks. Behavioral and Brain Functions. 4 (1), 7 (2008).
- van den Bergh, F. S., et al. Spontaneously hypertensive rats do not predict symptoms of attention-deficit hyperactivity disorder. Pharmacology, Biochemistry, and Behavior. 83, 11 (2006).
- Topping, J. S., Pickering, J. W. Effects of punishing different bands of IRTs on DRL responding. Psychological Reports. 31 (19-22), (1972).
- Richards, J. B., Sabol, K. E., Seiden, L. S. DRL interresponse-time distributions: quantification by peak deviation analysis. Journal of the Experimental Analysis of Behavior. 60 (2), 361-385 (1993).
- Orduña, V. Impulsivity and sensitivity to amount and delay of reinforcement in an animal model of ADHD. Behavioural Brain Research. 294, 62-71 (2015).
- Harmer, C. J., Phillips, G. D. Enhanced conditioned inhibition following repeated pretreatment with d -amphetamine. Psychopharmacology. 142 (2), 120-131 (1999).
- Lister, S., Pearce, J. M., Butcher, S. P., Collard, K. J., Foster, G. Acquisition of conditioned inhibition in rats is impaired by ablation of serotoninergic pathways. European Journal of Neuroscience. 8, 415-423 (1996).
- Meyer, H. C., Bucci, D. J. The contribution of medial prefrontal cortical regions to conditioned inhibition. Behavioral Neuroscience. 128 (6), 644-653 (2014).
- McNicol, D. . A primer of signal detection theory. , (1972).
- Carnero, S., Morís, J., Acebes, F., Loy, I. Percepción de la contingencia en ratas: Modulación fechneriana y metodología de la detección de señales. Revista Electrónica de Metodología Aplicada. 14 (2), (2009).
- López, H. H., Ettenberg, A. Dopamine antagonism attenuates the unconditioned incentive value of estrus female cues. Pharmacology, Biochemistry, and Behavior. 68, 411-416 (2001).
- Schotte, A., Janssen, P. F. M., Megens, A. A. H. P., Leysen, J. E. Occupancy of central neurotransmitter receptors by risperidone, clozapine and haloperidol, measured ex vivo. Brain Research. 631 (2), 191-202 (1993).
- van Hest, A., van Haaren, F., van de Poll, N. Haloperidol, but not apomorphine, differentially affects low response rates of male and female wistar rats. Pharmacology, Biochemistry, and Behavior. 29, 529-532 (1988).
- Finnegan, K. T., Ricaurte, G., Seiden, L. S., Schuster, C. R. Altered sensitivity to d-methylamphetamine, apomorphine, and haloperidol in rhesus monkeys depleted of caudate dopamine by repeated administration of d-methylamphetamine. Psychopharmacology. 77, 43-52 (1982).
- Britton, K. T., Koob, G. F. Effects of corticotropin releasing factor, desipramine and haloperidol on a DRL schedule of reinforcement. Pharmacology, Biochemistry, and Behavior. 32, 967-970 (1989).
- Maricq, A. V., Church, R. The differential effects of haloperidol and metamphetamine on time estimation in the rat. Psychopharmacology. 79, 10-15 (1983).
- Dalley, J. W., et al. Nucleus accumbens D2/3 receptors predict trait impulsivity and cocaine reinforcement. Science. 315, 1267-1270 (2007).
- Cole, B. J., Robbins, T. W. Effects of 6-hydroxydopamine lesions of the nucleus accumbens septi on performance of a 5-choice serial reaction time task in rats: Implications for theories of selective attention and arousal. Behavior and Brain Research. 33, 165-179 (1989).
- Reynolds, B., de Wit, H., Richards, J. B. Delay of gratification and delay discounting in rats. Behavioural Processes. 59 (3), 157-168 (2002).
- Evenden, J. L., Ryan, C. N. The pharmacology of impulsive behavior in rats: The effects of drugs on response choice with varying delays of reinforcement. Psychopharmacology. 128, 161-170 (1996).
- Autor, S. M., Hendry, D. P. . Conditioned reinforcement. , (1969).
- van den Broek, M. D., Bradshaw, C. M., Szabadi, E. Behaviour of ‘impulsive’ and ‘non-impulsive’ humans in a temporal differentiation schedule of reinforcement. Personality and Individual Differences. 8 (2), 233-239 (1987).
- McGuire, P. S., Seiden, L. S. The effects of tricyclicantidepressants on performance under a differential-reinforcement-of-low-rates schedule in rats. Journal of Pharmacology and Experimental Therapeutics. 214 (3), 635-641 (1980).
- O’Donnell, J. M., Seiden, L. S. Differential-reinforcement-of-low-rates 72-second schedule: Selective effects of antidepressant drugs. Journal of Pharmacology and Experimental Therapeutics. 224 (1), 80-88 (1983).
- Seiden, L. S., Dahms, J. L., Shaughnessy, R. A. Behavioral screen for antidepressants: The effects of drugs and electroconvulsive shock on performance under a differential-reinforcement-of-low-rates schedule. Psychopharmacology. 86, 55-60 (1985).
- He, Z., Cassaday, H. J., Howard, R. C., Khalifa, N., Bonardi, C. Impaired Pavlovian conditioned inhibition in offenders with personality disorders. The Quarterly Journal of Experimental Psychology. 64 (12), 2334-2351 (2011).
- He, Z., Cassaday, H. J., Bonardi, C., Bibi, P. A. Do personality traits predict individual differences in excitatory and inhibitory learning?. Frontiers in Psychology. 4, 1-12 (2013).
- Bucci, D. J., Hopkins, M. E., Keene, C. S., Sharma, M., Orr, L. E. Sex differences in learning and inhibition in spontaneously hypertensive rats. Behavioural Brain Research. 187 (1), 27-32 (2008).
- Gershon, J. A meta-analytic review of gender differences in ADHD. Journal of Attention Disorders. 5, 143-154 (2012).
- Mobini, S., et al. Effects of lesions of the orbitofrontal cortex on sensitivity to delayed and probabilistic reinforcement. Psychopharmacology. 160 (3), 290-298 (2002).
- Bouton, M. E., Nelson, J. B. Context-specificity of target versus feature inhibition in a negative-feature discrimination. Journal of Experimental Psychology: Animal Behavior Processes. 20 (1), 51-65 (1994).
- Bouton, M. E., Nelson, J. B., Schmajuk, N., Holland, P. . Occasion setting: Associative learning and cognition in animals. , 69-112 (1998).
- Rescorla, R. A. Pavlovian conditioned inhibition. Psychological Bulletin. 72 (2), 77-94 (1969).
- Miller, R. R., Matzel, L. D., Bower, G. H. . The psychology of learning and motivation. , (1988).
- Williams, D. A., Overmier, J. B., Lolordo, V. M. A reevaluation of Rescorla’s early dictums about conditioned inhibition. Psychological Bulletin. 111 (2), 275-290 (1992).
- Papini, M. R., Bitterman, M. E. The two-test strategy in the study of inhibitory conditioning. Psychological Review. 97 (3), 396-403 (1993).
- Sosa, R., Ramírez, M. N. Conditioned inhibition: Critiques and controversies in the light of recent advances. Journal of Experimental Psychology: Animal Behavior and Cognition. , (2018).
- Fox, A. T., Hand, D. J., Reilly, M. P. Impulsive choice in a rodent model of attention-deficit/hyperactivity disorder. Behavioural Brain Research. 187, 146-152 (2008).
- Foscue, E. P., Wood, K. N., Schramm-Sapyta, N. L. Characterization of a semi-rapid method for assessing delay discounting in rodents. Pharmacology, Biochemistry, and Behavior. 101, 187-192 (2012).
- Brucks, D., Marshall-Pescini, S., Wallis, L. J., Huber, L., Range, F. Measures of Dogs’ Inhibitory Control Abilities Do Not Correlate across Tasks. Frontiers in Psychology. 8, (2017).
- McDonald, J., Schleifer, L., Richards, J. B., de Wit, H. Effects of THC on Behavioral Measures of Impulsivity in Humans. Neuropsychopharmacology. 28 (7), 1356-1365 (2003).
- Reynolds, B., Ortengren, A., Richards, J. B., de Wit, H. Dimensions of impulsive behavior: Personality and behavioral measures. Personality and Individual Differences. 40 (2), 305-315 (2006).
- Dellu-Hagedorn, F. Relationship between impulsivity, hyperactivity and working memory: a differential analysis in the rat. Behavioral and Brain Functions. 2 (10), 18 (2006).
- López, P., Alba, R., Orduña, V. Individual differences in incentive salience attribution are not related to suboptimal choice in rats. Behavior and Brain Research. 341 (2), 71-78 (2017).
- Ho, M. Y., Al-Zahrani, S. S. A., Al-Ruwaitea, A. S. A., Bradshaw, C. M., Szabadi, E. 5-Hydroxytryptamine and impulse control: prospects for a behavioural analysis. Journal of Psychopharmacology. 12 (1), 68-78 (1998).
- Sagvolden, T., Russell, V. A., Aase, H., Johansen, E. B., Farshbaf, M. Rodent models of attention-deficit/hyperactivity disorder. Biological Psychiatry. 57, 9 (2005).
- Tomie, A., Aguado, A. S., Pohorecky, L. A., Benjamin, D. Ethanol induces impulsive-like responding in a delay-of-reward operant choice procedure: impulsivity predicts autoshaping. Psychopharmacology. 139 (4), 376-382 (1998).
- Monterosso, J., Ainslie, G. Beyond discounting: possible experimental models of impulse control. Psychopharmacology. 146 (4), 339-347 (1999).
- Burguess, M. A., Rabbit, P. . Methodology of frontal and executive function. , 81-116 (1997).
- Watterson, E., Mazur, G. J., Sanabria, F. Validation of a method to assess ADHD-related impulsivity in animal models. Journal of Neuroscience Methods. 252, 36-47 (2015).
- Hackenberg, T. D. Of pigeons and people: some observations on species differences in choice and self-control. Brazilian Journal of Behavior Analysis. 1 (2), 135-147 (2005).
- Asinof, S., Paine, T. A. The 5-choice serial reaction time task: A task of attention and impulse control for rodents. Journal of Visualized Experiments. (90), e51574 (2014).
- Masaki, D., et al. Relationship between limbic and cortical 5-HT neurotransmission and acquisition and reversal learning in a go/no-go task in rats. Psychopharmacology. 189, 249-258 (2006).
- Bari, A., et al. Prefrontal and monoaminergic contributions to stop-signal task performance in rats. The Journal of Neuroscience. 31, 9254-9263 (2011).
- Flagel, S. B., Watson, S. J., Robinson, T. E., Akil, H. Individual differences in the propensity to approach signals vs goals promote different adaptations in the dopamine system of rats. Psychopharmacology. 191, 599-607 (2007).
- Swann, A. C., Lijffijt, M., Lane, S. D., Steinberg, J. L., Moeller, F. G. Trait impulsivity and response inhibition in antisocial personality disorder. Journal of Psychiatric Research. 43 (12), 1057-1063 (2009).
- Lawrence, A. J., Luty, J., Bogdan, N. A., Sahakian, B. J., Clark, L. Impulsivity and response inhibition in alcohol dependence and problem gambling. Psychopharmacology. 207 (1), 163-172 (2009).
- Dougherty, D. M., et al. Behavioral impulsivity paradigms: a comparison in hospitalized adolescents with disruptive behavior disorders. Journal of Child Psychology and Psychiatry. 44 (8), 1145-1157 (2003).
- Rosval, L., et al. Impulsivity in women with eating disorders: Problem of response inhibition, planning, or attention. International Journal of Eating Disorders. 39 (7), 590-593 (2006).
- Huddy, V. C., et al. Reflection impulsivity and response inhibition in first-episode psychosis: relationship to cannabis use. Psychological Medicine. 43 (10), 2097-2107 (2013).

