전분 과립 크기 분포의 분석 및 사양
Summary
여기에 제시된 전분 과립 크기 분포의 재현 가능하고 통계적으로 유효한 측정을 위한 절차이며, 2파라미터 곱셈 형태를 사용하여 결정된 과립 로그노멀 크기 분포를 지정하는 절차이다. 식물 및 식품 과학 연구를 위한 그램 스케일 전분 샘플의 모든 과립 크기 조정 분석에 적용됩니다.
Abstract
모든 식물 원에서 전분은 크기와 모양의 범위가 다른 발생 주파수, 즉 크기와 모양 분포를 나타내는 다양한 크기 및 모양의 과립으로구성됩니다. 여러 유형의 입자 크기 조정 기술을 사용하여 결정된 전분 과립 크기 데이터는 과립 모양에 대한 민감도 및 과립 샘플 크기의 한계를 포함하여 일부 극복 할 수없는 체계적인 오류로 인한 일부 극복 할 수없는 체계적인 오류로 인한 통계적 유의부족으로 인해 종종 문제가됩니다. 전기 감지 영역 기술을 사용하여 전분 과립 크기 분포의 재현 가능하고 통계적으로 유효한 측정 절차를 설명하고, 향상된 정확도와 비교성을 갖춘 채택된 2파라미터 곱셈 형태를 사용하여 결정된 과립 로그노멀 크기 분포를 지정하는 절차를 설명했습니다. 그것은 그람 규모 전분 견본의 모든 과립 크기 분석에 적용되고, 그러므로, 전분 과립 크기가 전분 생합성 장치 및 기계장치에 의해 성형되는 방법에 대한 연구를 용이하게 할 수 있었습니다; 그리고 식품 및 산업 용도에 대한 전분의 특성과 기능에 미치는 영향. 대표적인 결과는 설명된 절차를 사용하여 고구마 전분 샘플의 과립 크기 분포의 복제 분석에서 제시됩니다. 우리는 또한 절차의 몇 가지 주요 기술적 측면, 특히 과립 로그노어 크기 분포의 곱셈 사양과 과립 골재에 의해 빈번한 조리개 막힘을 극복하기위한 몇 가지 기술적 수단에 대해 논의했습니다.
Introduction
전분 과립은 식물 광합성 및 저장 조직에서 두 개의 주요 예비 호모글루칸 폴리머, 선형 또는 희소하게 분진 아밀로오스 및 고분진 아밀요펙틴이 지질 및 단백질을 포함한 일부 사소한 구성 요소와 함께 질서 있게 포장되는 물리적 구조입니다. 다양한 식물 종의 전분 과립은 구체, 타원, 다발성발, 혈소판, 큐브, 큐비드 및 불규칙한 튜블러를 포함하여 많은 3차원 (3D) 모양 (ref.1,2에서검토됨)을 나타낸다. 같은 조직이나 동일한 식물 종의 다른 조직에서도 다양한 발생 주파수를 가진 모양의 집합이있을 수 있습니다. 즉, 식물 종으로부터의 전분 과립은 특정 형상이 아닌 특성통계 적 형상 분포를 가질 수 있다. 비 균일하고 구형이 아닌 과립 모양으로 전분 과립 크기를 올바르게 측정하고 정의하기가 어렵습니다. 또한 식물 종의 동일한 조직에서 전분 과립은 특성 크기 분포를 나타내는 다른 비율, 즉 다양한 크기의 크기입니다. 이 크기 분포는 전분 과립 크기의 분석 및 설명을 더욱 복잡하게 만듭니다.
전분 과립 크기는 현미경, 침전/스테릭 필드 흐름 분획(Sd/StFFF), 레이저 회절 및 전기 감지 영역(ESZ)을 포함하여 여러 범주의 입자 크기 조정 기술(참조3에서검토됨)을 사용하여 분석되었습니다. 그러나, 이러한 기술은 과립 모양과 크기 분포가 있는 전분 과립 크기의 결정에 똑같이 적합하지 않다. 빛, 공초점 및 스캐닝 전자 현미경 검사를 포함한 현미경검사는 형태4,5,6,7,구조8,9 및 개발10,11의 전분 과립의 연구에 우수하지만 일부 내재된 단점으로 인해 크기 분포를 정의하는 데 거의 적합하지 않습니다. 여러 종에서 전분의 과립 크기의 측정에 사용 된 광학 현미경 데이터 (IAOM)의 미세화 과립 이미지 또는 소프트웨어 지원 이미지 분석의 직접 측정,옥수수(12),밀13,14,감자15, 보리16을포함하여 전분 과립 이미지의 매우 제한된 수(수만~몇 천)의 1D(보통 최대 길이) 또는 2D(표면적) 크기만 측정할 수 있다. 기술에 의해 본질적으로 제약받는 작은 과립 샘플링 크기는 전분의 단위 중량당 엄청난 과립 수를 고려하면 통계적으로 대표될 수 없으며(1.5 g/cm³ 밀도에서 10 μm 구체를 모두 가정함). Sd/StFFF 기술은 전분과립(17)의고속 및 해상도, 좁은 크기 분획을 가질 수 있지만, 그 정확도가 전분 과립의 손상, 다양한 모양 및 밀도에 의해 심각하게 영향을 받을 수 있기 때문에 거의 사용되지 않았습니다. 레이저 회절 기술은 가장 널리 사용되고 있으며, 모든 주요 작물 종3,14,16에대한 전분 과립 크기 분석을 위해 적용되었다. 이 기술은 많은 장점을 가지고 있지만, 실제로 과립 모양 분포의 존재전세 과립 크기의 결정에 적합하지 않습니다. 동시 레이저 회절 기기의 대부분은 균일한 구형 입자에 대한 Mie 빛 산란 이론18에 의존하고 균일성의 다른 모양에 대한 수정 된 Mie 이론18. 따라서 이 기술은 본질적으로 입자 모양에 매우 민감하며, 다양한 비율의 모양 세트를 갖는 전분 과립은 물론 균일성19의특정 모양에도 완전히 적합하지 않습니다. ESZ 기술은 조리개를 통과하는 입자의 부피에 비례하여 전기장 교란을 측정합니다. 그것은 높은 해상도에서 과립 볼륨 크기뿐만 아니라 수 및 볼륨 분포 정보 등을 제공합니다. ESZ 기술은 색상, 모양, 조성 또는 굴절률을 포함한 입자의 광학 적 특성과 독립적이므로 결과가 매우 재현 가능하기 때문에 모양 집합을 갖는 전분 과립의 크기 분포를 결정하는 데 특히 적합합니다.
전분 과립 크기는 또한 많은 매개 변수를 사용하여 정의되었습니다. 그(것)들은 수시로 평균 직경에 의해 심플리스트로 기술되었다, 어떤 경우에는 2D 심상12의현미경 측정 최대 길이의 산술 수단이었다12,20,또는 동등한 구직경3의평균. 다른 경우에는, 과립 크기 분포는크기범위(21, 22),분포 평균 부피 또는 평균 직경(구, 수, 부피 또는 표면적)을 정상분포(14,23,24,25, 26)를가정하여 지정하였다. 다양한 분석에서 전분 과립 크기의 이러한 설명은 매우 다른 성격의, 엄격하게 비교할 수 없습니다. 다른 종에서 전분 과립의 이러한 “크기”또는 같은 종의 동일한 조직이 직접 비교된 경우 매우 오해의 소지가 있을 수 있습니다. 더욱이, 가정된 정상 분포의 확산(또는 형상) 매개변수, 즉, 분포의 폭(즉, 크기의 확산)을 측정하는 표준 편차 σ(또는 그래픽 표준 편차 σg)의확산(또는 형상) 파라미터는 대부분의 연구에서 무시되고 있다.
전술한 전분 과립 크기 분석이 직면한 중요한 문제를 해결하기 위해 ESZ 기술을 사용하여 전분 샘플의 과립 크기 분포에 대한 재현 가능하고 통계적으로 유효한 측정 절차를 설명하고, 정확도향상과 비교성을 갖춘 채택된 2-파라미터 곱셈 조형27을 사용하여 결정된 과립 로그노편 크기 분포를 적절히 지정했습니다. 유효성 검사 및 데모를 위해 절차를 사용하여 고구마 전분 샘플의 복제 과립 크기 조정 분석을 수행하고 그래픽 기하학적 수단 및 곱셈 표준 편차를 사용하여 lognormal 차동 볼륨 백분율 -볼륨 -동등한 구 직경 분포를 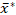
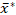 x/ (곱하고 분할) s* 형태로 지정했습니다.
x/ (곱하고 분할) s* 형태로 지정했습니다.
Protocol
Representative Results
Discussion
설명된 절차는 전분 과립 크기 분석을 위한 몇 가지 기존 방법에서 몇 가지 중요한 문제를 해결했습니다. 3D 과립의 부적절한 1D 또는 2D 크기 조정, 균일한 과립 모양으로 인한 크기 조정 측정의 왜곡, 제한된 과립 샘플 크기로 인한 재현성과 모호한 통계적 타당성, 부정확하거나 부적절한 사양(특히 평균 크기의 사용)을 포함하였습니다. 전분 과립의 3D 크기(볼륨)를 측정하고 과립 모양에 반응하지 …
Declarações
The authors have nothing to disclose.
Acknowledgements
이 작품은 부분적으로 협동 농업 연구 센터에 의해 지원, 농업 및 인간 과학 대학의 통합 식품 보안 연구 센터, 프레리 뷰 A&M 대학. 그의 기술 지원에 대한 Hua Tian에게 감사드립니다.
Materials
| Analytical beaker | Beckman Coulter Life Sciences | A35595 | Smart-Technology (ST) beaker |
| Aperture tube, 100 µm | Beckman Coulter Life Sciences | A36394 | For the MS4E, , 1000 µm |
| Disposable transfer pipettor, | Fisher Scientific (Fishersci.com) | 13-711-9AM | Other disposable transfer pipettors with similar orifice can also be used. |
| Fisherbrand Conical Polypropylene Centrifuge Tubes, 50 ml | Fisher Scientific (Fishersci.com) | 05-539-13 | Any other similar types of tubes can be used. |
| Glass beakers, 150 to 250 ml | Fisher Scientific (Fishersci.com) | 02-540K | These beakers are used to contain methanol for washing the aperture tube and stirer between runs. |
| LiCl | Fisher Chemical | L121-100 | |
| Methanol | Fisher Chemical | A412-500 | Buy in bulk as the analysis uses a large quantity of methanol. |
| Mettler Toledo ML-T Precision Balances | Mettler Toledo | 30243412 | Any other precision balance with a readablity 0.01 g to 1 mg will work. |
| Multisizer 4e Coulter Counter | Beckman Coulter Life Sciences | B23005 | The old model, Multisizer 3 can also be used with slight adjustment of parameters. The 4e model comes with a 100 μm aperture tube. Other aperture tubes of different diameter can be purchased separately from the company. |
| Ultrasonic processor UP50H | Hielscher Ultrasound Technology | UP50H | Other laborator sonicator having a low-power (<50 Watt) output can be also used. Both MS1 and MS2 sonotrodes for the particular sonicator can be used to disperse starch granules in 5 ml methanol. Always use the lowest setting first, 20% amplitude and 0.1 or 0.2 cycle, and raise the setting if aggregates persist in suspension. |
Referências
- Shannon, J. C., Garwood, D. L., Boyer, C. D., BeMiller, J., Whistler, R. . Starch:Chemistry and Technology Food Science and Technology. , 23-82 (2009).
- Singh, N., Singh, J., Kaur, L., Singh Sodhi, N., Singh Gill, B. Morphological, thermal and rheological properties of starches from different botanical sources. Food Chemistry. 81 (2), 219-231 (2003).
- Lindeboom, N., Chang, P. R., Tyler, R. T. Analytical, biochemical and physicochemical aspects of starch granule size, with emphasis on small granule starches: a review. Starch – Stärke. 56 (34), 89-99 (2004).
- Baldwin, P. M., Davies, M. C., Melia, C. D. Starch granule surface imaging using low-voltage scanning electron microscopy and atomic force microscopy. International Journal of Biological Macromolecules. 21 (1-2), 103-107 (1997).
- Jane, J. L., Kasemsuwan, T., Leas, S., Zobel, H., Robyt, J. F. Anthology of starch granule morphology by scanning electron microscopy. Starch-Stärke. 46 (4), 121-129 (1994).
- Matsushima, R., Nakamura, Y. . Starch: Metabolism and Structure. , 425-441 (2015).
- Wang, S. -. q., Wanf, L. -. l., Fan, W. -. h., Cao, H., Cao, B. -. s. Morphological analysis of common edible starch granules by scanning electron microscopy. Food Science. 32 (15), 74-79 (2011).
- Baldwin, P. M., Adler, J., Davies, M. C., Melia, C. D. Holes in starch granules: confocal, SEM and light microscopy studies of starch granule structure. Starch-Stärke. 46 (9), 341-346 (1994).
- Chakraborty, I., Pallen, S., Shetty, Y., Roy, N., Mazumder, N. Advanced microscopy techniques for revealing molecular structure of starch granules. Biophysical Reviews. 12 (1), 105-122 (2020).
- Bechtel, D. B., Wilson, J. D. Amyloplast formation and starch granule development in hard red winter wheat. Cereal Chemistry. 80 (2), 175-183 (2003).
- Evers, A. Scanning electron microscopy of wheat starch. III. Granule development in the endosperm. Starch-Stärke. 23 (5), 157-162 (1971).
- Wang, Y. J., White, P., Pollak, L., Jane, J. L. Characterization of starch structures of 17 maize endosperm mutant genotypes with Oh43 inbred line background. Cereal Chemistry. 70, 171-179 (1993).
- Peng, M., Gao, M., Abdel-Aal, E. S. M., Hucl, P., Chibbar, R. N. Separation and characterization of A-and B-type starch granules in wheat endosperm. Cereal Chemistry. 76, 375-379 (1999).
- Wilson, J. D., Bechtel, D. B., Todd, T. C., Seib, P. A. Measurement of wheat starch granule size distribution using image analysis and laser diffraction technology. Cereal Chemistry. 83 (3), 259-268 (2006).
- Liu, Q., Weber, E., Currie, V., Yada, R. Physicochemical properties of starches during potato growth. Carbohydrate Polymers. 51 (2), 213-221 (2003).
- Chmelik, J., et al. Comparison of size characterization of barley starch granules determined by electron and optical microscopy, low angle laser light scattering and gravitational field-flow fractionation. Journal of the Institute of Brewing. 107 (1), 11-17 (2001).
- Moon, M. H., Giddings, J. C. Rapid separation and measurement of particle size distribution of starch granules by sedimentation/steric field-flow fractionation. Journal of Food Science. 58 (5), 1166-1171 (1993).
- Wriedt, T., Wolfram, H., Wriedt, T. . The Mie Theory: Basics and Applications. , 53-71 (2012).
- Schuerman, D. W., Wang, R. T., Gustafson, B. &. #. 1. 9. 7. ;. S., Schaefer, R. W. Systematic studies of light scattering. 1: Particle shape. Applied Optics. 20 (23), 4039-4050 (1981).
- Goering, K. J., Fritts, D. H., Eslick, R. F. A study of starch granule size and distribution in 29 barley varieties. Starch-Stärke. 25 (9), 297-302 (1973).
- Chen, Z., Schols, H. A., Voragen, A. G. J. Starch granule size strongly determines starch noodle processing and noodle quality. Journal of Food Sciences. 68 (5), 1584-1589 (2003).
- Dai, Z. M. Starch granule size distribution in grains at different positions on the spike of wheat (Triticum aestivum L.). Starch-Starke. 61 (10), 582-589 (2009).
- Edwards, M. A., Osborne, B. G., Henry, R. J. Effect of endosperm starch granule size distribution on milling yield in hard wheat. Journal of Cereal Science. 48 (1), 180-192 (2008).
- Karlsson, R., Olered, R., Eliasson, A. C. Changes in starch granule size distribution and starch gelatinization properties during development and maturation of wheat, barley and rye. Starch – Starke. 35 (10), 335-340 (1983).
- Li, W. -. Y., et al. Comparison of starch granule size distribution between hard and soft wheat cultivars in Eastern China. Agricultural Sciences China. 7 (8), 907-914 (2008).
- Park, S. H., Wilson, J. D., Seabourn, B. W. Starch granule size distribution of hard red winter and hard red spring wheat: Its effects on mixing and breadmaking quality. Journal of Cereal Science. 49 (1), 98-105 (2009).
- Limpert, E., Stahel, W. A., Abbt, M. Log-normal distributions across the sciences: keys and clues. Bioscience. 51 (5), 341-352 (2001).
- Gao, M., et al. Self-preserving lognormal volume-size distributions of starch granules in developing sweetpotatoes and modulation of their scale parameters by a starch synthase II (SSII). Acta Physiologiae Plantarum. 38 (11), 259 (2016).
- Wattebled, F., et al. STA11, a Chlamydomonas reinhardtii locus required for normal starch granule biogenesis, encodes disproportionating enzyme. Further evidence for a function of alpha-1,4 glucanotransferases during starch granule biosynthesis in green algae. Plant Physiology. 132 (1), 137-145 (2003).
- Ji, Y., Seetharaman, K., White, P. J. Optimizing a Small-Scale Corn-Starch Extraction Method for Use in the Laboratory. Cereal Chemistry. 81 (1), 55-58 (2004).
- Halloy, S., Whigham, P. The lognormal as universal descriptor of unconstrained complex systems: a unifying theory for complexity. Proceedings of the 7th Asia-Pacific Complex Systems Conference. , 309-320 (2004).
- Furusawa, C., Suzuki, T., Kashiwagi, A., Yomo, T., Kaneko, K. Ubiquity of log-normal distributions in intra-cellular reaction dynamics. Biophysics (Nagoya-shi). 1, 25-31 (2005).

