구슬에 갈렉틴-3 - U1 snRNP 복합체에 의한 접합 활동의 보완
Summary
이 문서에서는 (a) 핵 추출물에서 U1 snRNP의 고갈에 대한 실험 절차에 대해 설명하며, 접합 활동의 수반되는 손실; (b) Galectin-3에 의한 U1 고갈 된 추출물에서 접합 활성의 재구성 – U1 snRNP 입자는 항 갈류 -3 항체와 함께 공동으로 구슬에 결합된다.
Abstract
고갈-재헌법 실험은 galectin-3이 핵 추출물에 필요한 접합 인자임을 나타냅니다. 접합 경로에 galectin-3을 통합하는 메커니즘은이 논문에서 해결된다. 12%-32% 글리세롤 그라데이션에 HeLa 세포 핵 추출물의 침전물은 galectin-3 및 U1 snRNP를 포함하는 내생 ~10S 입자에 농축된 분획을 산출합니다. 우리는 지금 접합 활동의 수반되는 손실로 U1 snRNP의 핵 추출물을 고갈시키는 프로토콜을 기술합니다. U1 고갈된 추출물의 접합 활성은 항갈류-3 항체와 함께 아가로스 비드에 갇힌 U1 snRNP 입자에 의해 재구성될 수 있다. 결과는 galectin-3 – U1 snRNP – 사전 mRNA 대동맥 복합체가 접합 반응의 중간 및 제품으로 이어지는 기능적인 E 복합체이고 galectin-3는 U1 snRNP와의 협회를 통해 접합 통로를 입력한다는 것을 표시합니다. 특정 접합계의 고갈된 추출물에서 접합 활성을 재구성하기 위해 비드에서 복잡한 친화성 또는 면역 선택을 사용하는 방식은 일반적으로 다른 시스템에 적용될 수 있다.
Introduction
대부분의 진핵 메신저 RNA (mRNA)의 생산은 핵 프로세스에서 인트론의 제거및 엑손의 결찰을 포함 1. RNA 단백질 복합체(RNP)의 2부류는 스플리세이세탈 복합체를 통해 숙사 RNA를 성숙한 mRNA로 직접 처리한다. 1부, 초기 사전 메신저 RNP는, 이질적인 핵 RNP 단백질 및 SR 제품군의 일부 구성원을 포함한 다른 RNA 결합 단백질의 결합에 의해 공동 전사적으로 형성되어 hnRNP 복합체2를 산출한다. 두 번째 클래스, 우라실이 풍부한 소형 핵 RNP(U1, U2, U4, U5 및 U6 snRNAs를 가진 U snRNP)는 U-특이적 및 핵심 단백질3,4와 관련이 있습니다. U snRNP는 인트론이 절제되고 성숙한 mpRNPs5를 생성하기 위해 기근이 계게됨에 따라 동적 리모델링 경로에서 사전 메신저 RNP의 특정 영역과 정렬 된 방식으로 상호 작용합니다. 많은 추가 핵 단백질이 이러한 처리 이벤트에 참여6.
Galectin-1 (Gal1) 및 galectin-3 (Gal3)는 고갈 재구성 연구에 의해 표시된 바와 같이 접합 경로에 필요한 두 가지 단백질입니다7,8. 유능한 핵 추출물(NE)을 접합하는 데 서 두 갈대린을 제거하는 것은 초기 단계에서 화려한 조립과 접합 활동을 폐지합니다. 이러한 이중 고갈 된 NE에 둘 다 갈대린의 추가는 두 활동을 복원. Gal1 및 Gal3는 Gal1 또는 Gal39에 특이적인 항혈제에 의해 사전 mRNA, 접합 중기 및 성숙한 mRNA의 특정 면역 침전에 의해 입증된 활성 스pliceosomes의 성분입니다. 중요한 것은, Gal3는 항갈3 항세라10에 의한 스니프의 침전에 의해 도시된 바와 같이 접합 통로 외부에 NE내 입자를 함유하는 내인성 U snRNA와 연관된다. 마지막으로, HeLa 세포에 있는 Gal3의 침묵은 수많은 유전자11의 접합 패턴을 변경합니다.
미리 배양된 NE에서 미리 배양되어 미리 형성된 스플리세솜12, snRNPs는 7S에서 60S 이상으로 글리세롤 그라데이션에서 퇴적하는 여러 복합체에서 발견된다. 글리세롤 그라데이션 분획은 스플리케소말 복합체 및 성분의 분리를 위한 일반적인 기술이지만(예를 들어 참조13,14,15 참조), 항체 면역 침전을 사용하여 특정 분수를 특성화하여 이 방법을 확장했습니다. 10S에서 snRNP 퇴적물은 Gal3와 함께 U1 snRNA만 포함합니다. 갈3 또는 U1 snRNP에 특이적 항세라를 가진 10S 분획의 면역 침전은 U1과 Gal3 의 일부를 나타내는 U1 과 Gal3 모두 의 일부를 나타내는 Gal310에 결합된다. U1 snRNP는 화려한 어셈블리1,5에서 사전 mRNP에 결합하는 첫 번째 복합체이므로 이 단계는 접합 경로에 Gal3의 잠재적 진입 지를 나타냅니다. 이를 바탕으로, 10S Gal3-U1 snRNP 단입자가 U1 snRNP고갈약된 NE에 접합 활성을 복원한 구슬을 함유한 항갈3에 결합된 단입자가 이 복합체를 spliceosopathway16에 모집되는 하나의 메커니즘으로 확립하는 것으로 나타났습니다. 이것은 접합 반응의 특정 단계에서 spliceosomes를 분리하고 관련 요인을 분류하는 시도와 대조17,18. 이러한 연구에서, 특정 요인의 존재는 어느 시점에서 확인 하지만 그들은 로드 된 메커니즘.
우리는 이전에 NE의 준비, 접합 기판, 접합 반응 혼합물의 조립 및 사전 mRNA 접합19에서 galectins의 역할에 대한 문서화에서 제품의 분석을 상세히 설명했습니다. 우리는 지금 Gal3 – U1 snRNP 복합체 및 U1 고갈된 핵 추출물에서 접합 활동을 재구성하기 위하여 후자 의 면역 선택을 위해, Gal3에 농축된 분획을 위한 실험 절차를 기술합니다.
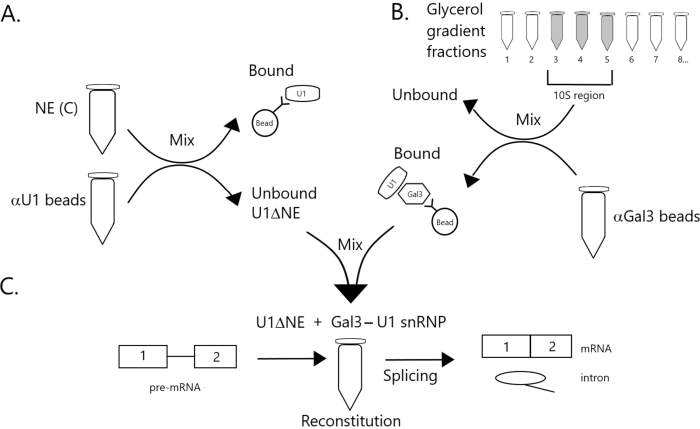
도 1: 구슬에 Gal3-U1 snRNP 복합체에 의해 U1 snRNP의 고갈된 핵 추출물에서 접합 활성의 보완을 보여주는 회로도 도표. (A) NE 버퍼 C (NE(C)) 단백질 A-Sepharose 비즈와 함께 배양된다.). 언바운드 분수는 U1 snRNP(U1ΔNE)의 고갈됩니다. (B) 완충D(NE)에서 NE은 초원심분리에 의한 12%-32% 글리세롤 그라데이션을 통해 분획된다. 10S 영역(분수 3-5)에 대응하는 분획은 항갈3 항체(αGal3 구슬)와 함께 구슬과 결합되고 혼합된다. 구슬에 바인딩된 재료에는 Gal3-U1 snRNP 단입자가 포함되어 있습니다. (C) 파트(B)로부터의 Gal3-U1 snRNP 복합체는 32P 표지된 MINX 프리mRNA 기판 및 접합 반응의 중간 및 제품을 사용하여 부품(A)으로부터 U1ΔNE과 혼합되어 겔 전기전구및 사방사선에 의해 분석된다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
Protocol
Representative Results
Discussion
이 보고서는 항갈3 코팅 구슬에 갇힌 U1 snRNP 복합체가 사전 mRNA 기판에 결합할 수 있으며 이 삼차 복합체는 원래 갈라크토에 기초하여 분리된 단백질 의 가족 중 하나인 U1 snRNP 고갈된 NE. Gal3에 접합 활동을 복원할 수 있는 실험적 세부 사항을 제공합니다. . 초기 면역 형광 및 세포 전형 연구는 접합 기계의 구성 요소와 Gal3의 협회의 초기 힌트를 제공: 스네RNPs의 Sm 코어 폴리 펩티?…
Declarações
The authors have nothing to disclose.
Acknowledgements
이 작품은 국립 과학 재단 그랜트 MCB-0092919 및 미시간 주립 대학 교교 연구 보조금 09-CDFP-2001 (RJP) 및 건강 보조금 GM-38740 및 미시간 AgBioResearch 프로젝트 MICL02455 (JLW)에 의해 지원되었습니다.
접합 표식에 사용된 MINX 사전 mRNA 기판은 닥터 수잔 버겟 (미국 휴스턴, 텍사스, 텍사스) 박사수잔 버겟에게서 친절한 선물이었습니다.
Materials
| anti-U1 snRNP | The Binding Site | Hu ENA-RNP #33471 | human autoimmune serum specific for U1 snRNP |
| bottle top vacuum filter | Fisher Scientific | Corning 431153 (0.22 μm; PES 150 ml) | for filtering solutions containing Tris |
| centrifuge | International Equipment Company | IEC Model PR-6 | for pelletting Sepharose beads in immunoprecipitation |
| diethylpyrocarbonate (DEPC) | Sigma-Aldrich | 159220-5G | for treatment of water used in preparation of all solutions |
| dimethylpimelimidate (DMP) | Sigma-Aldrich | 80490-5G | for cross-linking antibody to Sepharose beads |
| electrophoresis cell | BioRad Laboratories, Inc | Mini-Protean II | for SDS-PAGE separation of proteins |
| ethanolamine | Sigma-Aldrich | 411000-100ml | for blocking after the cross-linking reaction |
| gel electrophoresis system | Hoefer, Inc | HSI SE 500 Series | for separating snRNAs by gel electrophoresis |
| gel slab dryer | BioRad | Model 224 | for drying gel slabs for autoradiography |
| Hybond ECL membrane | GE Healthcare | RPN3032D (0.2 μm; 30 cm x 3 m) | for immunoblotting of proteins on membrane |
| microdialyzer (12 x 100 μl sample capacity) | Pierce | Microdialyzer System 100 | for exchanging the buffer of nuclear extract |
| microdialyzer membranes (8K cutoff) | Pierce | 66310 | for exchanging the buffer of nuclear extract |
| non-fat dry milk | Spartan Stores | Spartan Instant Non-fat Dry Milk | |
| Protein A Sepharose CL-4B | Millipore-Sigma | GE 17-0780-01 | for coupling antibody to beads |
| Proteinase K | Millipore-Sigma | P2308-5mg | for stopping the splicing reaction to isolate the RNAs |
| RNasin | Promega | N2111 | for inhibiting ribonuclease activity |
| rocker/rotator | Lab Industries, Inc | Labquake Shaker 400-110 | for mixing protein solutions in coupling reactions and in immunoprecipitation |
| Safety-Solve | Research Products International Corp. | No. 111177 | scintillation counting cocktail for determination of radioactivity in splicing substrate |
| scintillation counter | Beckman Instruments | LS6000SC | scintillation counter for determination of radioactivity |
| speed vaccum concentrator | Savant | SVC 100H | for drying ethanol-precipitated RNA pellets |
| Transphor electrophoresis unit | Hoefer, Inc | Hoefer TE Series Transphor | for protein transfer from SDS-PAGE to blotting membrane |
Referências
- Hoskins, A. A., Moore, M. J. The spliceosome: a flexible, reversible macromolecular machine. Trends In Biochemical Sciences. 37, 179-188 (2012).
- Choi, Y. D., Grabowski, P., Sharp, P. A., Dreyfuss, G. Heterogeneous nuclear ribonucleoproteins: role in RNA splicing. Science. 231, 1534-1539 (1986).
- Lerner, M., Steitz, J. A. Snurps and scyrps. Cell. 25, 298-300 (1981).
- Maniatis, T., Reed, R. The role of small nuclear ribonucleoprotein particles in pre-mRNA splicing. Nature. 325, 673-678 (1987).
- Hoskins, A. A., et al. Ordered and dynamic assembly of single spliceosomes. Science. 331, 1289-1295 (2011).
- Coppin, L., Leclerc, J., Vincent, A., Porchet, N., Pigny, P. Messenger RNA life-cycle in cancer: emerging role of conventional and non-conventional RNA-binding proteins. International Journal of Molecular Sciences. 19, 650-676 (2018).
- Dagher, S. F., Wang, J. L., Patterson, R. J. Identification of galectin-3 as a factor in pre-mRNA splicing. Proceedings of the National Academy of Sciences of the United States of America. 92, 1213-1217 (1995).
- Vyakarnam, A., Dagher, S. F., Wang, J. L., Patterson, R. J. Evidence for a role for galectin-1 in pre-mRNA splicing. Molecular and Cellular Biology. 17, 4730-4737 (1997).
- Wang, W., Park, J. W., Wang, J. L., Patterson, R. J. Immunoprecipitation of spliceosomal RNAs by antisera to galectin-1 and galectin-3. Nucleic Acids Research. 34, 5166-5174 (2006).
- Haudek, K. C., Voss, P. G., Locascio, L. E., Wang, J. L., Patterson, R. J. A mechanism for incorporation of galectin-3 into the spliceosome through its association with U1 snRNP. Bioquímica. 48, 7705-7712 (2009).
- Fritsch, K., et al. Galectin-3 interacts with components of the nuclear ribonucleoprotein complex. BMC Cancer. 16, 502-511 (2016).
- Conway, G. C., Krainer, A. R., Spector, D. L., Roberts, R. J. Multiple splicing factors are released from endogenous complexes during in vitro pre-mRNA splicing. Molecular and Cellular Biology. 9, 5273-5280 (1989).
- Dery, K. J., Yean, S. L., Lin, R. J. Assembly and glycerol gradient isolation of yeast spliceosomes containing transcribed or synthetic U6 snRNA. Methods in Molecular Biology. 488, 41-63 (2008).
- Yoshimoto, R., Kataoka, N., Okawa, K., Ohno, M. Isolation and characterization of post-splicing lariat-intron complexes. Nucleic Acids Research. 37, 891-902 (2009).
- Malca, H., Shomron, N., Ast, G. The U1 snRNP base pairs with the 5′ splice site within a penta-snRNP complex. Molecular and Cellular Biology. 23, 3442-3455 (2003).
- Haudek, K. C., Voss, P. G., Wang, J. L., Patterson, R. J. A 10S galectin-3 – snRNP complex assembles into active spliceosomes. Nucleic Acids Research. 44, 6391-6397 (2016).
- Rappsilber, J., Ryder, U., Lamond, A. I., Mann, M. Large-scale proteomic analysis of the human spliceosome. Genome Research. 12, 1231-1245 (2002).
- Jurica, M. S., Moore, M. J. Capturing splicing complexes to study structure and mechanism. Methods. 28, 336-345 (2002).
- Patterson, R. J., Haudek, K. C., Voss, P. G., Wang, J. L. Examination of the role of galectins in pre-mRNA splicing. Methods in Molecular Biology. 1207, 431-449 (2015).
- Dignam, J. D., Lebovitz, R. M., Roeder, R. G. Accurate transcription initiation by RNA polymerase II in a soluble extract from isolated mammalian nuclei. Nucleic Acids Research. 11, 1475-1489 (1983).
- Agarwal, N., Sun, Q., Wang, S. Y., Wang, J. L. Carbohydrate-binding protein 35. I. Properties of the recombinant polypeptide and the individuality of the domains. Journal of Biological Chemistry. 268, 14932 (1993).
- Zillmann, M., Zapp, M. I., Berget, S. M. Gel electrophoretic isolation of splicing complexes containing U1 small nuclear ribonucleoprotein particles. Molecular and Cellular Biology. 8, 814-821 (1988).
- Barondes, S. H., et al. Galectins: a family of animal β-galactoside-binding proteins. Cell. 76, 597-598 (1994).
- Laing, J. G., Wang, J. L. Identification of carbohydrate binding protein 35 in heterogeneous nuclear ribonucleoprotein complex. Bioquímica. 27, 5329-5334 (1988).
- Vyakarnam, A., Lenneman, A. J., Lakkides, K. M., Patterson, R. J., Wang, J. L. A comparative nuclear localization study of galectin-1 with other splicing components. Experimental Cell Research. 242, 419-428 (1998).
- Michaud, S., Reed, R. An ATP-independent complex commits pre-mRNA to the mammalian spliceosome assembly pathway. Genes & Development. 5, 2534-2546 (1991).
- Chiu, Y. -. F., et al. Cwc25 is a novel splicing factor required after Prp2 and Yju2 to facilitate the first catalytic reaction. Molecular and Cellular Biology. 29, 5671-5678 (2009).
- Krishnan, R., et al. Biased Brownian ratcheting leads to pre-mRNA remodeling and capture prior to first-step splicing. Nature Structural and Molecular Biology. 20, 1450-1457 (2013).
- Gray, R. M., et al. Distinct effects on splicing of two monoclonal antibodies directed against the amino-terminal domain of galectin-3. Archives of Biochemistry and Biophysics. 475, 100-108 (2008).

