استكمال نشاط الربط بواسطة Galectin-3 - U1 SnRNP مجمع على الخرز
Summary
تصف هذه المقالة الإجراءات التجريبية ل(أ) استنفاد U1 snRNP من المستخلصات النووية، مع ما يصاحب ذلك من فقدان نشاط الربط؛ (ب) استنفاد اليورانيوم 1 من اليورانيوم المستنفد لليورانيوم من المستخلصات النووية، مع ما يصاحب ذلك من فقدان نشاط الربط؛ (ب) استنفاد اليورانيوم من اليورانيوم 1 من اليورانيوم المستنفد للأوزون؛ (ج) استنفاد اليورانيوم من اليورانيوم غير النووي. و (ب) إعادة تشكيل نشاط الربط في استخراج U1 المنضب بواسطة الجسيمات galectin-3 – U1 SnRNP ملزمة بالخرز يقترن بشكل متناقض مع الأجسام المضادة المضادة للجاليكتين-3.
Abstract
وتشير التجارب الكلاسيكية لإعادة تشكيل الاستنفاد إلى أن الجيليكتين -3 عامل مطلوب للربط في المستخلصات النووية. يتم تناول آلية دمج galectin-3 في مسار الربط في هذه الورقة. الترسيب من المستخلصات النووية خلايا هيلا على 12٪ -32٪ التدرجات الجلسرين تسفر عن كسور المخصب في الجسيمات الذاتية ~ 10S التي تحتوي على galectin-3 و U1 snRNP. ونصف الآن بروتوكولا لاستنفاد المستخلصات النووية من U1 snRNP مع ما يصاحب ذلك من فقدان نشاط الربط. يمكن إعادة تشكيل نشاط الربط في استخراج U1 المستنفدة من قبل الجسيمات galectin-3 – U1 SnRNP المحاصرين على حبات الآغاروز بشكل مشترك مع الأجسام المضادة المضادة للجاليكتين-3. وتشير النتائج إلى أن galectin-3 – U1 snRNP – مجمع ما قبل ميرنا الترنيري هو مجمع E وظيفي يؤدي إلى وسيطة ومنتجات رد فعل الربط وأن galectin-3 يدخل مسار الربط من خلال ارتباطه مع U1 snRNP. قد ينطبق مخطط استخدام التعقيدات التي يتم اختيارها من ناحية التقارب أو المناعة على الخرز لإعادة تشكيل نشاط الربط في المستخلصات المستنفدة لعامل ربط محدد بشكل عام على أنظمة أخرى.
Introduction
إنتاج معظم RNAS رسول eukaryotic (mRNAs) ينطوي على إزالة introns وربط exons في عملية نووية يطلق عليها اسم ما قبل مرنا الربط1. نوعين من مجمعات بروتين الحمض النووي الريبي (RNPs) توجيه معالجة الحمض النووي الريبي قبل رسول في ميرنا ناضجة عبر مجمعات الطحال. يتم تشكيل فئة واحدة ، RNPs ما قبل الرسول الوليدة ، نسخا مشتركة من خلال ربط بروتينات RNP النووية غير المتجانسة وغيرها من البروتينات الملزمة للجيش الملكي النيبالي ، بما في ذلك بعض أفراد عائلة SR ، مما ينتج مجمعات hnRNP2. ويرتبط من الدرجة الثانية، RNPs النووية الصغيرة الغنية uracil (U snRNPs مع U1، U2، U4، U5، وU6 snRNAs) مع U محددة والبروتينات الأساسية3،4. تتفاعل UnRNPs بطريقة مرتبة مع مناطق محددة من RNPs ما قبل الرسول في مسار إعادة عرض ديناميكي حيث يتم استئصال السترونز وربط exons لإنتاج mRNPs5 ناضجة. ويشارك العديد من البروتينات النووية الإضافية في أحداث المعالجة هذه6.
Galectin-1 (Gal1) و galectin-3 (Gal3) هما بروتينان مطلوبان في مسار الربط كما هو موضح في دراسات إعادة تشكيل الاستنفاد7،8. إزالة كل من galectins من الربط المستخلصات النووية المختصة (NE) يلغي التجميع الربط ونشاط الربط في خطوة مبكرة. إضافة أي galectin إلى مثل هذه NE المنضب بشكل مضاعف يستعيد كلا النشاطين. Gal1 و Gal3 هي مكونات اللصقات النشطة كما يتضح من السبق المناعي المحدد لمرنا ما قبل، وسيطة الربط، ورنا ناضجة من قبل antiserum محددة إما Gal1 أو Gal39. الأهم من ذلك، Gal3 المنتسبين مع SnRNA U الذاتية التي تحتوي على جزيئات في NE خارج مسار الربط كما هو مبين من خلال هطول الأمطار من snRNPs من قبل antisera10 المضادة Gal3. وأخيرا، إسكات Gal3 في خلايا هيلا يغير أنماط الربط من الجينات العديدة11.
في NE قبل احتضان لتفكيك اللصقات مسبقة الشكل12، تم العثور على snRNPs في مجمعات متعددة الرسوب في تدرجات الجلسرين من 7S إلى أكبر من 60S. على الرغم من أن الكسر التدرج الجلسرين هو تقنية شائعة لعزل المجمعات والمكونات الطحال (انظر المراجع13,14,15 على سبيل المثال), لقد قمنا بتوسيع هذه الطريقة عن طريق توصيف كسور محددة باستخدام الأجسام المضادة المناعية. وsnRNP الرسوب في 10S يحتوي فقط U1 snRNA جنبا إلى جنب مع Gal3. إن التكسير المناعي للكسر 10S مع antisera محدد ل Gal3 أو U1 snRNP يشارك في التعجيل بكل من U1 و Gal3 مما يشير إلى أن بعض الجسيمات الأحادية U1 snRNP لا بد أن تكون Gal310. كما U1 snRNP هو أول مجمع يربط إلى ما قبل mRNP في التجميع spliceosomal1،5، تمثل هذه الخطوة موقع دخول محتمل لGal3 في مسار الربط. على هذا الأساس، أظهرنا أن 10S Gal3-U1 snRNP أحادية الجسيمات ملزمة المضادة Gal3 التي تحتوي على الخرز استعادة نشاط الربط إلى U1 snRNP استنفدت NE، وإنشاء هذا المجمع كآلية واحدة التي يتم تجنيد Gal3 في المسار الربط16. وهذا يتناقض مع محاولات عزل اللصقات في مراحل محددة في رد فعل الربط وفهرسة العوامل المرتبطة بها17,18. وفي مثل هذه الدراسات، يتم التأكد من وجود عوامل معينة في وقت ما ولكن ليس الآلية التي تم تحميلها بها.
كنا قد وصفنا بالتفصيل في إعداد NE، وركيزة الربط، وتجميع خليط رد فعل الربط، وتحليل المنتجات في توثيقنا لدور galectins في الربط قبل ميرنا19. ونصف الآن الإجراءات التجريبية لتجزئ المستخلصات النووية للحصول على جزء مثري في مجمع Gal3 – U1 snRNP ولانتقاء المناعة للمجمع الأخير لإعادة تشكيل نشاط الربط في مستخلص نووي مستنفد U1.
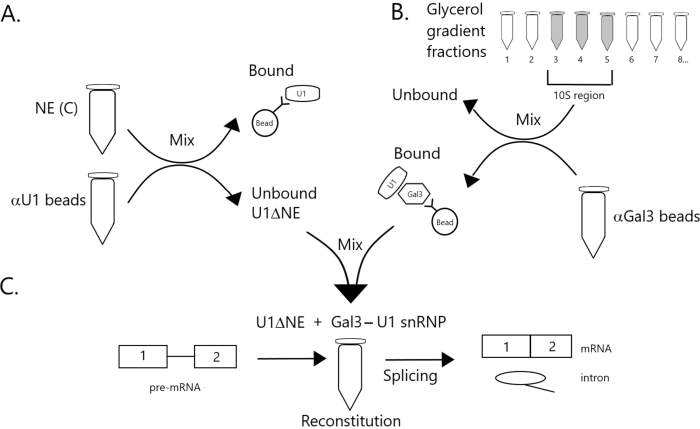
الشكل 1: مخطط تخطيطي يوضح استكمال نشاط الربط في استخراج نووي مستنزف من U1 snRNP بواسطة مجمع Gal3-U1 snRNP على الخرز. (A) NE في العازل C (NE(C)) يتم احتضانه بخرز البروتين A-Sepharose مقترنا بشكل متناقض مع حبات SnRNP المضادة U1 (حبات αU1). يتم استنفاد الكسر غير منضم من U1 snRNP (U1ΔNE). (ب) يتم تجزئة NE في المخزن المؤقت D (NE(D)) على تدرج جلسيرول 12٪-32٪ عن طريق الطرد المركزي الفائق. يتم الجمع بين الكسور المقابلة لمنطقة 10S (الكسور 3-5) وخلطها مع الخرز المقترن بشكل مشترك مع الأجسام المضادة المضادة ل Gal3 (حبات αGal3). المواد ملزمة الخرز يحتوي على Gal3-U1 snRNP أحادية الحزبية. (ج) يتم خلط مجمع Gal3-U1 snRNP من الجزء (B) مع U1ΔNE من الجزء (A) في مقايسة الربط باستخدام ركيزة MINX قبل ميرنا المسماة 32P ويتم تحليل وسيطة ومنتجات تفاعل الربط بواسطة الكتروفلوريس الهلامي والتصوير الإشعاعي التلقائي. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Protocol
Representative Results
Discussion
يقدم هذا التقرير التفاصيل التجريبية التي توثق مجمع Gal3 – U1 snRNP المحاصرين على الخرز المغلف المضاد ل Gal3 يمكن أن يرتبط بركيزة ما قبل مرنا ويمكن لهذا المجمع الترني استعادة نشاط الربط إلى NE. Gal3 المستنفدة ل U1 SnRNP هو عضو واحد في عائلة من البروتينات المعزولة في الأصل على أساس نشاطها الخا?…
Declarações
The authors have nothing to disclose.
Acknowledgements
وقد تم دعم هذا العمل من قبل المؤسسة الوطنية للعلوم منحة MCB-0092919 وجامعة ولاية ميشيغان منحة البحوث الداخلية 09-CDFP-2001 (إلى RJP) والمعاهد الوطنية للصحة منحة جنرال موتورز-38740 وميشيغان AgBioResearch مشروع MICL02455 (إلى JLW).
كانت ركيزة MINX قبل مرنا المستخدمة في المقايسات الربط هدية لطيفة من الدكتور سوزان بيرغيت (كلية بايلور للطب، هيوستن، تكساس، الولايات المتحدة الأمريكية).
Materials
| anti-U1 snRNP | The Binding Site | Hu ENA-RNP #33471 | human autoimmune serum specific for U1 snRNP |
| bottle top vacuum filter | Fisher Scientific | Corning 431153 (0.22 μm; PES 150 ml) | for filtering solutions containing Tris |
| centrifuge | International Equipment Company | IEC Model PR-6 | for pelletting Sepharose beads in immunoprecipitation |
| diethylpyrocarbonate (DEPC) | Sigma-Aldrich | 159220-5G | for treatment of water used in preparation of all solutions |
| dimethylpimelimidate (DMP) | Sigma-Aldrich | 80490-5G | for cross-linking antibody to Sepharose beads |
| electrophoresis cell | BioRad Laboratories, Inc | Mini-Protean II | for SDS-PAGE separation of proteins |
| ethanolamine | Sigma-Aldrich | 411000-100ml | for blocking after the cross-linking reaction |
| gel electrophoresis system | Hoefer, Inc | HSI SE 500 Series | for separating snRNAs by gel electrophoresis |
| gel slab dryer | BioRad | Model 224 | for drying gel slabs for autoradiography |
| Hybond ECL membrane | GE Healthcare | RPN3032D (0.2 μm; 30 cm x 3 m) | for immunoblotting of proteins on membrane |
| microdialyzer (12 x 100 μl sample capacity) | Pierce | Microdialyzer System 100 | for exchanging the buffer of nuclear extract |
| microdialyzer membranes (8K cutoff) | Pierce | 66310 | for exchanging the buffer of nuclear extract |
| non-fat dry milk | Spartan Stores | Spartan Instant Non-fat Dry Milk | |
| Protein A Sepharose CL-4B | Millipore-Sigma | GE 17-0780-01 | for coupling antibody to beads |
| Proteinase K | Millipore-Sigma | P2308-5mg | for stopping the splicing reaction to isolate the RNAs |
| RNasin | Promega | N2111 | for inhibiting ribonuclease activity |
| rocker/rotator | Lab Industries, Inc | Labquake Shaker 400-110 | for mixing protein solutions in coupling reactions and in immunoprecipitation |
| Safety-Solve | Research Products International Corp. | No. 111177 | scintillation counting cocktail for determination of radioactivity in splicing substrate |
| scintillation counter | Beckman Instruments | LS6000SC | scintillation counter for determination of radioactivity |
| speed vaccum concentrator | Savant | SVC 100H | for drying ethanol-precipitated RNA pellets |
| Transphor electrophoresis unit | Hoefer, Inc | Hoefer TE Series Transphor | for protein transfer from SDS-PAGE to blotting membrane |
Referências
- Hoskins, A. A., Moore, M. J. The spliceosome: a flexible, reversible macromolecular machine. Trends In Biochemical Sciences. 37, 179-188 (2012).
- Choi, Y. D., Grabowski, P., Sharp, P. A., Dreyfuss, G. Heterogeneous nuclear ribonucleoproteins: role in RNA splicing. Science. 231, 1534-1539 (1986).
- Lerner, M., Steitz, J. A. Snurps and scyrps. Cell. 25, 298-300 (1981).
- Maniatis, T., Reed, R. The role of small nuclear ribonucleoprotein particles in pre-mRNA splicing. Nature. 325, 673-678 (1987).
- Hoskins, A. A., et al. Ordered and dynamic assembly of single spliceosomes. Science. 331, 1289-1295 (2011).
- Coppin, L., Leclerc, J., Vincent, A., Porchet, N., Pigny, P. Messenger RNA life-cycle in cancer: emerging role of conventional and non-conventional RNA-binding proteins. International Journal of Molecular Sciences. 19, 650-676 (2018).
- Dagher, S. F., Wang, J. L., Patterson, R. J. Identification of galectin-3 as a factor in pre-mRNA splicing. Proceedings of the National Academy of Sciences of the United States of America. 92, 1213-1217 (1995).
- Vyakarnam, A., Dagher, S. F., Wang, J. L., Patterson, R. J. Evidence for a role for galectin-1 in pre-mRNA splicing. Molecular and Cellular Biology. 17, 4730-4737 (1997).
- Wang, W., Park, J. W., Wang, J. L., Patterson, R. J. Immunoprecipitation of spliceosomal RNAs by antisera to galectin-1 and galectin-3. Nucleic Acids Research. 34, 5166-5174 (2006).
- Haudek, K. C., Voss, P. G., Locascio, L. E., Wang, J. L., Patterson, R. J. A mechanism for incorporation of galectin-3 into the spliceosome through its association with U1 snRNP. Bioquímica. 48, 7705-7712 (2009).
- Fritsch, K., et al. Galectin-3 interacts with components of the nuclear ribonucleoprotein complex. BMC Cancer. 16, 502-511 (2016).
- Conway, G. C., Krainer, A. R., Spector, D. L., Roberts, R. J. Multiple splicing factors are released from endogenous complexes during in vitro pre-mRNA splicing. Molecular and Cellular Biology. 9, 5273-5280 (1989).
- Dery, K. J., Yean, S. L., Lin, R. J. Assembly and glycerol gradient isolation of yeast spliceosomes containing transcribed or synthetic U6 snRNA. Methods in Molecular Biology. 488, 41-63 (2008).
- Yoshimoto, R., Kataoka, N., Okawa, K., Ohno, M. Isolation and characterization of post-splicing lariat-intron complexes. Nucleic Acids Research. 37, 891-902 (2009).
- Malca, H., Shomron, N., Ast, G. The U1 snRNP base pairs with the 5′ splice site within a penta-snRNP complex. Molecular and Cellular Biology. 23, 3442-3455 (2003).
- Haudek, K. C., Voss, P. G., Wang, J. L., Patterson, R. J. A 10S galectin-3 – snRNP complex assembles into active spliceosomes. Nucleic Acids Research. 44, 6391-6397 (2016).
- Rappsilber, J., Ryder, U., Lamond, A. I., Mann, M. Large-scale proteomic analysis of the human spliceosome. Genome Research. 12, 1231-1245 (2002).
- Jurica, M. S., Moore, M. J. Capturing splicing complexes to study structure and mechanism. Methods. 28, 336-345 (2002).
- Patterson, R. J., Haudek, K. C., Voss, P. G., Wang, J. L. Examination of the role of galectins in pre-mRNA splicing. Methods in Molecular Biology. 1207, 431-449 (2015).
- Dignam, J. D., Lebovitz, R. M., Roeder, R. G. Accurate transcription initiation by RNA polymerase II in a soluble extract from isolated mammalian nuclei. Nucleic Acids Research. 11, 1475-1489 (1983).
- Agarwal, N., Sun, Q., Wang, S. Y., Wang, J. L. Carbohydrate-binding protein 35. I. Properties of the recombinant polypeptide and the individuality of the domains. Journal of Biological Chemistry. 268, 14932 (1993).
- Zillmann, M., Zapp, M. I., Berget, S. M. Gel electrophoretic isolation of splicing complexes containing U1 small nuclear ribonucleoprotein particles. Molecular and Cellular Biology. 8, 814-821 (1988).
- Barondes, S. H., et al. Galectins: a family of animal β-galactoside-binding proteins. Cell. 76, 597-598 (1994).
- Laing, J. G., Wang, J. L. Identification of carbohydrate binding protein 35 in heterogeneous nuclear ribonucleoprotein complex. Bioquímica. 27, 5329-5334 (1988).
- Vyakarnam, A., Lenneman, A. J., Lakkides, K. M., Patterson, R. J., Wang, J. L. A comparative nuclear localization study of galectin-1 with other splicing components. Experimental Cell Research. 242, 419-428 (1998).
- Michaud, S., Reed, R. An ATP-independent complex commits pre-mRNA to the mammalian spliceosome assembly pathway. Genes & Development. 5, 2534-2546 (1991).
- Chiu, Y. -. F., et al. Cwc25 is a novel splicing factor required after Prp2 and Yju2 to facilitate the first catalytic reaction. Molecular and Cellular Biology. 29, 5671-5678 (2009).
- Krishnan, R., et al. Biased Brownian ratcheting leads to pre-mRNA remodeling and capture prior to first-step splicing. Nature Structural and Molecular Biology. 20, 1450-1457 (2013).
- Gray, R. M., et al. Distinct effects on splicing of two monoclonal antibodies directed against the amino-terminal domain of galectin-3. Archives of Biochemistry and Biophysics. 475, 100-108 (2008).

