Een pro-inflammatoire, degeneratieve orgaancultuurmodel om intervertebrale discusziekte in een vroeg stadium te simuleren.
Summary
Dit protocol presenteert een nieuw experimenteel model van pro-inflammatoire, degeneratieve runderorgaancultuur om vroege tussenwervelschijfdegeneratie te simuleren.
Abstract
Symptomatische tussenwervelschijf (IVD) degeneratie (IDD) is een belangrijke sociaaleconomische last en wordt gekenmerkt door ontsteking en weefselafbraak. Vanwege het gebrek aan oorzakelijke therapieën is er dringend behoefte aan innovatieve experimentele orgaancultuurmodellen om de mechanismen te bestuderen die betrokken zijn bij de progressie van de ziekte, therapeutische doelen te vinden en de behoefte aan diermodellen te verminderen. We presenteren hier een nieuw, driedimensionaal orgaancultuurmodelprotocol dat het pro-inflammatoire en katabole micromilieu nabootst, dat aanwezig is tijdens IDD.
Aanvankelijk werden runderaudale IVD’s ontleed, gereinigd en gekweekt in het weefselkweekmedium. Dynamische fysiologische of pathologische belasting werd gedurende 2 uur per dag toegepast in een op maat gemaakte bioreactor. IVD’s werden gedurende vier dagen toegewezen aan een controlegroep (hoog glucosemedium, fysiologische belasting, fosfaatgebufferde zoutoplossinginjectie) en een pathologische groep (laag glucosemedium, pathologische belasting, tumornecrosefactor-alfa-injectie). Genexpressieanalyse van verzamelde nucleus pulposuscellen van de IVD’s en enzymgekoppelde immunosorbente assay van de geconditioneerde orgaankweekmedia werd uitgevoerd.
Onze gegevens onthulden een hogere expressie van ontstekingsmarkers en verminderde schijfhoogten na belasting in de pathologische groep in vergelijking met de controlegroep. Dit protocol is betrouwbaar om IVD-ontsteking en degeneratie te simuleren en kan verder worden uitgebreid om het toepassingsgebied ervan te verbreden.
Introduction
Lage rugpijn (LBP) kan individuen van alle leeftijden treffen en is wereldwijd een belangrijke oorzaak voor invaliditeit1,2,3. De totale kosten in verband met LBP bedragen meer dan $ 100 miljard per jaar4,5. Symptomatische tussenwervelschijf (IVD) degeneratie (IDD), een aandoening die wordt gekenmerkt door ontsteking en weefselafbraak, is een belangrijke oorzaak van LBP6,7. In het bijzonder wordt IDD gekenmerkt door een geleidelijk evoluerende afbraak van de extracellulaire matrix (ECM) van het IVD, geïnduceerd en geactiveerd door meerdere factoren die leiden tot een versnelde pathologie, neurologische aandoeningen en uiteindelijk invaliditeit. Bovendien wordt IDD geassocieerd met het vrijkomen van pro-inflammatoire cytokinen, veranderde wervelkolombiomechanica, angiogenese en zenuwingroei, wat het pijngevoel verhoogt, wat in totaal chronische LBP (actieve discopathie) veroorzaakt6,8. Tot op heden omvatten behandelingsopties discectomie en daaropvolgende fusie van de aangrenzende wervels, implantatie van een IVD-prothese of niet-chirurgische benaderingen, zoals niet-steroïde ontstekingsremmende geneesmiddelen, opioïden en spierverslappers voor patiënten met IDD9. Beide huidige standaard therapeutische opties, chirurgisch en niet-chirurgisch, zijn slechts gedeeltelijk effectief en pakken het onderliggende biologische probleem niet aan9,10. Degeneratieve schijfziekte in een vroeg stadium wordt gekenmerkt door een initiële inflammatoire weefselrespons, met name een toename van tumornecrosefactor-alfa (TNF-alpha) expressie11. Deze vroege schijfveranderingen treden voornamelijk op cellulair niveau op zonder de schijfarchitectuur te verstoren en kunnen eerder worden nagebootst door voedingstekort onder pro-inflammatoire aandoeningen12. Daarom is nauwkeurige simulatie van de in vivo situatie om deze degeneratiemechanismen te onderzoeken en geschikte therapeutische doelen te vinden cruciaal. Bovendien speelt de mechanische belastingsomgeving van de schijven een sleutelrol bij pathologische en fysiologische veranderingen van IVD. Bijgevolg zou het combineren van deze benaderingen ons een stap vooruit brengen om de complexe micro-omgeving van IVD’s in vivo na te bootsen. Er zijn momenteel geen studies die het aspect van dynamische belasting in overweging nemen, samen met de pro-inflammatoire en nutritionele setting voor zover wij weten.
Hoewel grote diermodellen het mogelijk maken om potentiële relevante in vivo interacties te onderzoeken, zijn ze duur en werkintensief. Aangezien het gebruik van diermodellen in onderzoek al lang een controverse is, is de vermindering van het aantal dieren dat nodig is om belangrijke onderzoeksvragen te beantwoorden van groot belang. Ten slotte is er momenteel geen ideaal diermodel om IDD na te bootsen in IVD-onderzoek13,14. Daarom is het noodzakelijk om een kosteneffectieve en betrouwbare vervanging vast te stellen, zoals een orgaancultuurmodel om IDD en bijbehorende ontstekings- en degeneratieve processen te simuleren. Onlangs stelde de toepassing van het huidige protocol voor de vaststelling van een pro-inflammatoir en degeneratief orgaancultuurmodel om intervertebrale schijfziekte in een vroeg stadium te simuleren ons in staat om het effect van ontstekingsremmende geneesmiddelen in de IDD-orgaancultuur te onderzoeken15.
Hier beschrijven we hoe runderintervertebrale schijven kunnen worden verkregen en de toestand van IDD in een vroeg stadium kunnen worden induceren via een katabole en pro-inflammatoire micro-omgeving veroorzaakt door directe intradiscale injectie van tumornecrosefactor-alfa (TNF-α) en degeneratieve belasting in een bioreactor onder lage voedingsmatige mediumomstandigheden. Figuur 1 illustreert het experimentele model en toont de bioreactor die wordt gebruikt om degeneratieve en fysiologische belastingsomstandigheden te simuleren.
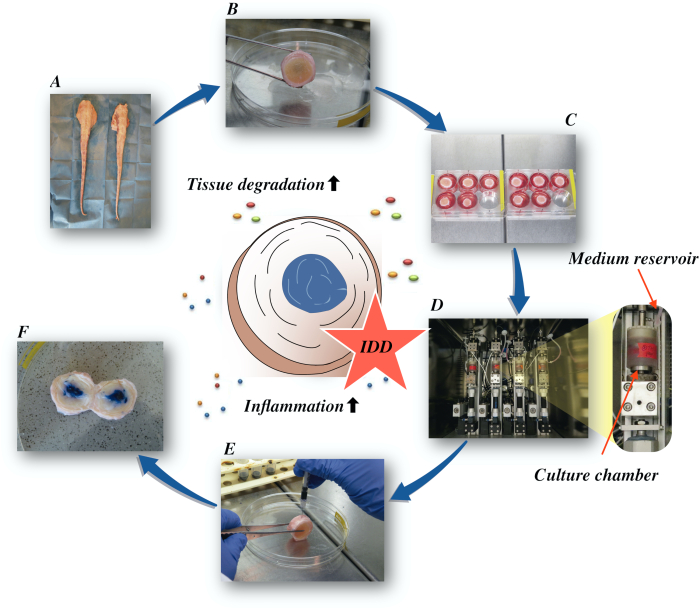
Figuur 1: Illustratie van de experimentele opstelling. A: runderstaart; B: ontlede tussenwervelschijven van runderen; C: overdracht van de schijf naar een putplaat met kweekmedium; D: het laden van de simulatie in een bioreactor; E: intradiscale injectietechniek; F: IVD na injectie van PBS/trypan blauwe kleurstof om de verdeling te onthullen. IDD: tussenwervelschijfdegeneratie. Klik hier om een grotere versie van deze afbeelding te bekijken.
Protocol
Representative Results
Discussion
We hebben hier een gedetailleerd protocol gegeven om degeneratieve en inflammatoire IVDD te simuleren. Dit protocol kan worden toegepast voor gedetailleerde onderzoeken van ontstekingsroutes die leiden tot de destructieve effecten op de schijf. Bovendien kan het protocol helpen bij het bepalen van veelbelovende therapeutische doelen die betrokken zijn bij de progressie van de ziekte.
We hebben onlangs laten zien dat humane recombinante TNF-α ontstekingen kan veroorzaken in zowel runder- als m…
Declarações
The authors have nothing to disclose.
Acknowledgements
Dit werk werd ondersteund door AO Foundation en AOSpine International. Babak Saravi kreeg fellowship steun van de German Spine Foundation en de German Osteoarthritis Foundation. Gernot Lang werd ondersteund door het Berta-Ottenstein-programma voor gevorderde clinicuswetenschappers, faculteit geneeskunde, Universiteit van Freiburg, Duitsland.
Materials
| 1-Bromo-3-chloropropane(BCP) | Sigma-Aldrich, St. Louis, USA | B9673 | |
| Ascorbate-2-phosphate | Sigma-Aldrich, St. Louis, USA | A8960 | |
| Band saw | Exakt Apparatebau, Norderstedt, Germany | model 30/833 | |
| Betadine | Munndipharma, Frankfurt, Germany | ||
| Bovine IL-8 Do.it-Yourself ELISA | Kingfisher Biotech, St. Paul, USA | DIY1028B-003 | |
| Corning ITS Premix | Corning Inc., New York, USA | 354350 | |
| DMEM high glucose | Gibco by life technologies, Carlsbad, USA | 10741574 | |
| DMEM low glucose | Gibco by life technologies, Carlsbad, USA | 11564446 | |
| Ethanol for molecular biology | Sigma-Aldrich, St. Louis, USA | 09-0851 | |
| Fetal Bovine Serum (FBS) | Gibco by life technologies, Carlsbad, USA | A4766801 | |
| Non-essential amino acid solution | Gibco by life technologies, Carlsbad, USA | 11140050 | |
| Penicillin/Streptomycin(P/S) | gibco by life technologies, Carlsbad, USA | 11548876 | |
| Phosphate Buffer Solution, tablet | Sigma-Aldrich, St. Louis, USA | P4417 | |
| Pronase | Sigma-Aldrich, St. Louis, USA | 10165921001 | |
| Primocin | InvivoGen, Sandiego, USA | ant-pm-05 | |
| Pulsavac Jet Lavage System | Zimmer, IN,USA | ||
| TissueLyser II | Quiagen, Venlo, Netherlands | 85300 | |
| Streptavidinn-HRP | Kingfisher Biotech, St. Paul, USA | AR0068-001 | |
| Superscript VILO | Invitrogen by life Technologies, Carlsbad, USA | 10704274 | |
| cDNA Synthesis Kit | Applied Biosystems by life technologies | 10400745 | |
| TaqMan Universal Master Mix | Applied Biosystems by life technologies | ||
| TNF-alpha, recombinant human protein | R&D systems, Minnesota, USA | 210-TA-005 | |
| TRI Reagent | Molecular Research Center, Cincinnati, USA | TR 118 | |
| Tris-EDTA buffer solution | sigma-Aldrich, St. Louis, USA | 93283 | |
| Gene bIL-6 | Applied Biosystems by life technologies | Custom made probes | Primer fw (5′–3′) TTC CAA AAA TGG AGG AAA AGG A Primer rev (5′–3′) TCC AGA AGA CCA GCA GTG GTT Probe (5′FAM/3′TAMRA) CTT CCA ATC TGG GTT CAA TCA GGC GATT |
| Gene bIL8 | Applied Biosystems by life technologies | Bt03211906_m1 | |
| Gene bTNF-alpha | Applied Biosystems by life technologies | Custom made probes | Primer fw (5′–3′) CCT CTT CTC AAG CCT CAA GTA ACA A Primer rev (5′–3′) GAG CTG CCC CGG AGA GTT Probe (5′FAM/3′TAMRA) ATG TCG GCT ACA ACG TGG GCT ACC G |
| GENE bIL1beta | Applied Biosystems by life technologies | Custom made probes | Primer fw (5′–3′) TTA CTA CAG TGA CGA GAA TGA GCT GTT Primer rev (5′–3′) GGT CCA GGT GTT GGA TGC A Probe (5′FAM/3′TAMRA) CTC TTC ATC TGT TTA GGG TCA TCA GCC TCA A |
| RPLP0 | Applied Biosystems by life technologies | Bt03218086_m1 |
Referências
- Vos, T., et al. Global, regional, and national incidence, prevalence, and years lived with disability for 328 diseases and injuries for 195 countries, 1990-2016: a systematic analysis for the Global Burden of Disease Study 2016. The Lancet. 390 (10100), 1211-1259 (2017).
- Hoy, D., et al. Measuring the global burden of low back pain. Best Practice & Research Clinical Rheumatology. 24 (2), 155-165 (2010).
- Thiese, M. S., et al. Prevalence of low back pain by anatomic location and intensity in an occupational population. BMC Musculoskeletal Disorders. 15 (1), 283 (2014).
- Katz, J. N. Lumbar Disc Disorders and Low-Back Pain: Socioeconomic Factors and Consequences. The Journal of Bone and Joint Surgery (American). 88, 21 (2006).
- Vlaeyen, J. W. S., et al. Low back pain. Nature Reviews Disease Primers. 4 (1), 52 (2018).
- Khan, A. N., et al. Inflammatory biomarkers of low back pain and disc degeneration: a review: Biomarkers of disc degeneration and back pain. Annals of the New York Academy of Sciences. 1410 (1), 68-84 (2017).
- Kim, H. S., Wu, P. H., Jang, I. T. Lumbar Degenerative Disease Part 1: Anatomy and Pathophysiology of Intervertebral Discogenic Pain and Radiofrequency Ablation of Basivertebral and Sinuvertebral Nerve Treatment for Chronic Discogenic Back Pain: A Prospective Case Series and Review of Literature. International Journal of Molecular Sciences. 21 (4), 1483 (2020).
- Adams, M. A., Roughley, P. J. What is Intervertebral Disc Degeneration, and What Causes It. Spine. 31 (18), 2151-2161 (2006).
- Wu, P. H., Kim, H. S., Jang, I. T. Intervertebral Disc Diseases Part 2: A Review of the Current Diagnostic and Treatment Strategies for Intervertebral Disc Disease. International Journal of Molecular Sciences. 21 (6), 2135 (2020).
- Lurie, J. D., et al. Surgical Versus Nonoperative Treatment for Lumbar Disc Herniation: Eight-Year Results for the Spine Patient Outcomes Research Trial. Spine. 39 (1), 3-16 (2014).
- Risbud, M. V., Shapiro, I. M. Role of cytokines in intervertebral disc degeneration: pain and disc content. Nature Reviews Rheumatology. 10 (1), 44-56 (2014).
- Ponnappan, R. K., et al. An organ culture system to model early degenerative changes of the intervertebral disc. Arthritis Research & Therapy. 13 (5), 171 (2011).
- O’Connell, G. D., Vresilovic, E. J., Elliott, D. M. Comparison of Animals Used in Disc Research to Human Lumbar Disc Geometry. Spine. 32 (3), 328-333 (2007).
- Stannard, J. T., et al. Development of a whole organ culture model for intervertebral disc disease. Journal of Orthopaedic Translation. 5, 1-8 (2016).
- Li, Z., et al. Preclinical ex-vivo Testing of Anti-inflammatory Drugs in a Bovine Intervertebral Degenerative Disc Model. Frontiers in Bioengineering and Biotechnology. 8, 583 (2020).
- Li, Z., et al. Development of an ex vivo cavity model to study repair strategies in loaded intervertebral discs. European Spine Journal. 25 (9), 2898-2908 (2016).
- Kazezian, Z., Li, Z., Alini, M., Grad, S., Pandit, A. Injectable hyaluronic acid down-regulates interferon signaling molecules, IGFBP3 and IFIT3 in the bovine intervertebral disc. Acta Biomaterialia. 52, 118-129 (2017).
- Caprez, S., Menzel, U., Li, Z., Grad, S., Alini, M., Peroglio, M. Isolation of high-quality RNA from intervertebral disc tissue via pronase predigestion and tissue pulverization. JOR Spine. 1 (2), 1017 (2018).
- Lopa, S., Ceriani, C., Cecchinato, R., Zagra, L., Moretti, M., Colombini, A. Stability of housekeeping genes in human intervertebral disc, endplate and articular cartilage cells in multiple conditions for reliable transcriptional analysis. European Cells & Materials. 31, 395-406 (2016).
- Lang, G., et al. An intervertebral disc whole organ culture system to investigate proinflammatory and degenerative disc disease condition. Journal of Tissue Engineering and Regenerative Medicine. 12 (4), 2051-2061 (2018).
- Du, J., et al. Proinflammatory intervertebral disc cell and organ culture models induced by tumor necrosis factor alpha. JOR Spine. 3, 1104 (2020).
- Purmessur, D., Walter, B. A., Roughley, P. J., Laudier, D. M., Hecht, A. C., Iatridis, J. A role for TNFα in intervertebral disc degeneration: A non-recoverable catabolic shift. Biochemical and Biophysical Research Communications. 433 (1), 151-156 (2013).
- Walter, B. A., Likhitpanichkul, M., Illien-Junger, S., Roughley, P. J., Hecht, A. C., Iatridis, J. C. TNFα Transport Induced by Dynamic Loading Alters Biomechanics of Intact Intervertebral Discs. PLOS One. 10 (3), 0118358 (2015).
- Gullbrand, S. E., et al. A large animal model that recapitulates the spectrum of human intervertebral disc degeneration. Osteoarthritis and Cartilage. 25 (1), 146-156 (2017).
- Willems, N., et al. Safety of intradiscal injection and biocompatibility of polyester amide microspheres in a canine model predisposed to intervertebral disc degeneration: intradiscal application of pea microspheres. Journal of Biomedical Materials Research Part B: Applied Biomaterials. 105 (4), 707-714 (2017).
- Michalek, A. J., Buckley, M. R., Bonassar, L. J., Cohen, I., Iatridis, J. C. The effects of needle puncture injury on microscale shear strain in the intervertebral disc annulus fibrosus. The Spine Journal. 10 (12), 1098-1105 (2010).
- Illien-Jünger, S., et al. The combined effects of limited nutrition and high-frequency loading on intervertebral discs with endplates. Spine. 35 (19), 1744-1752 (2010).
- Gantenbein, B., et al. Organ culture bioreactors–platforms to study human intervertebral disc degeneration and regenerative therapy. Current Stem Cell Research & Therapy. 10 (4), 339-352 (2015).
- Boubriak, O. A., Watson, N., Sivan, S. S., Stubbens, N., Urban, J. P. G. Factors regulating viable cell density in the intervertebral disc: blood supply in relation to disc height. Journal of Anatomy. 222 (3), 341-348 (2013).
- Maroudas, A., Stockwell, R. A., Nachemson, A., Urban, J. Factors involved in the nutrition of the human lumbar intervertebral disc: cellularity and diffusion of glucose in vitro. Journal of Anatomy. 120, 113-130 (1975).
- Beckstein, J. C., Sen, S., Schaer, T. P., Vresilovic, E. J., Elliott, D. M. Comparison of Animal Discs Used in Disc Research to Human Lumbar Disc: Axial Compression Mechanics and Glycosaminoglycan Content. Spine. 33 (6), 166-173 (2008).
- Walter, B. A., Illien-Jünger, S., Nasser, P. R., Hecht, A. C., Iatridis, J. C. Development and validation of a bioreactor system for dynamic loading and mechanical characterization of whole human intervertebral discs in organ culture. Journal of Biomechanics. 47 (9), 2095-2101 (2014).
- Rajan, N. E., et al. Toll-Like Receptor 4 (TLR4) Expression and Stimulation in a Model of Intervertebral Disc Inflammation and Degeneration. Spine. 38 (16), 1343-1351 (2013).
- vanden Akker, G. G., Rorije, A. J., Davidson, E. N. B., vander Kraan, P. M. Phenotypic marker genes distinguish inner and outer annulus fibrosus from nucleus pulposus tissue in the bovine intervertebral disc. Osteoarthritis and Cartilage. 25, 402 (2017).
- Du, J., et al. Functional cell phenotype induction with TGF-β1 and collagen-polyurethane scaffold for annulus fibrosus rupture repair. European Cells & Materials. 39, 1-17 (2020).
- Risbud, M. V., et al. Defining the phenotype of young healthy nucleus pulposus cells: recommendations of the Spine Research Interest Group at the 2014 annual ORS meeting. Journal of Orthopaedic Research: Official Publication of the Orthopaedic Research Society. 33 (3), 283-293 (2015).

