Un modèle pro-inflammatoire et dégénératif de culture d’organe pour simuler la maladie de disque intervertébral de tôt-étape.
Summary
Ce protocole présente un modèle expérimental original de culture proinflammatory et dégénérative d’organe bovin pour simuler la dégénération intervertébrale de disque de tôt-étape.
Abstract
La dégénérescence symptomatique du disque intervertébral (IVD) (IDD) est un fardeau socio-économique majeur et se caractérise par une inflammation et une dégradation tissulaire. En raison du manque de thérapies causales, il est urgent de disposer de modèles expérimentaux novateurs de culture d’organes pour étudier les mécanismes impliqués dans la progression de la maladie, trouver des cibles thérapeutiques et réduire le besoin de modèles animaux. Nous présentons ici un nouveau, protocole tridimensionnel de modèle de culture d’organe imitant le microenvironnement proinflammatory et catabolique, qui est présent pendant IDD.
Au commencement, des IVDs caudaux bovins ont été disséqués, nettoyés, et cultivés dans le milieu de culture de tissu. La charge physiologique ou pathologique dynamique a été appliquée dans un bioréacteur fait sur mesure pendant 2 heures par jour. Des IVDs ont été assignés à un groupe témoin (milieu élevé de glucose, charge physiologique, injection saline phosphate-tamponnée) et à un groupe pathologique (milieu bas de glucose, charge pathologique, injection de facteur-alpha de nécrose tumorale) pendant quatre jours. L’analyse d’expression génique des cellules rassemblées de pulposus de noyau des IVDs et de l’analyse enzyme-liée d’immunosorbant des milieux conditionnés de culture d’organe a été exécutée.
Nos données ont indiqué une expression plus élevée des marqueurs inflammatoires et ont réduit des hauteurs de disque après chargement dans le groupe pathologique comparé au groupe témoin. Ce protocole est fiable pour simuler l’inflammation et la dégénérescence d’IVD et peut être encore élargi pour élargir son champ d’application.
Introduction
La lombalgie (LBP) peut affecter des personnes de tous âges et est l’une des principales causes d’invalidité dans le monde1,2,3. Le coût total associé au LBP dépasse 100 milliards de dollars par an4,5. La dégénérescence symptomatique du disque intervertébral (IVD) (IDD), une condition caractérisée par l’inflammation et la dégradation des tissus, est une cause majeure de LBP6,7. Plus précisément, la DDI est caractérisée par une dégradation progressive de la matrice extracellulaire (ECM) de l’IVD, induite et déclenchée par de multiples facteurs qui conduisent à une pathologie accélérée, à des troubles neurologiques et, éventuellement, à une invalidité. En outre, idd est associé à la libération de cytokines proinflammatory, biomécanique de colonne vertébrale altérée, angiogenèse, et l’ingrowth de nerf, qui augmente la sensation de douleur, tout à fait causer chronique LBP (discopathie active)6,8. À ce jour, les options de traitement comprennent la discectomie et la fusion subséquente des vertèbres adjacentes, l’implantation d’une prothèse de DDIV ou des approches non chirurgicales, telles que des anti-inflammatoires non stéroïdiens, des opioïdes et des relaxants musculaires pour les patients atteints de DDI9. Les deux options thérapeutiques standard actuelles, chirurgicales et non chirurgicales, ne sont que partiellement efficaces et ne parviennent pas à résoudre le problème biologique sous-jacent9,10. La discopathie dégénérative à un stade précoce est caractérisée par une réponse initiale des tissus inflammatoires, en particulier une augmentation de l’expression11du facteur-alpha de nécrose tumorale (TNF-alpha). Ces changements précoces de disque se produisent principalement au niveau cellulaire sans perturber l’architecture de disque et pourraient précédemment être imités par insuffisance nutritionnelle dans des conditions pro-inflammatoires12. Par conséquent, une simulation précise de la situation in vivo pour étudier ces mécanismes de dégénérescence et trouver des cibles thérapeutiques appropriées est cruciale. De plus, pour ces simulations de propriétés moléculaires, l’environnement de charge mécanique des disques joue un rôle clé dans les changements pathologiques et physiologiques des IDIV. Par conséquent, la combinaison de ces approches nous permettrait d’avancer d’un pas en avant pour imiter le microenvironnement complexe des IDIV in vivo. Il n’y a actuellement aucune étude considérant l’aspect du chargement dynamique avec le cadre pro-inflammatoire et nutritionnel au meilleur de nos connaissances.
Bien que les grands modèles animaux permettent d’enquêter sur les interactions in vivo pertinentes potentielles, ils sont coûteux et exigent beaucoup de travail. En outre, étant donné que l’utilisation de modèles animaux dans la recherche fait l’objet de controverses depuis longtemps, la réduction du nombre d’animaux nécessaires pour répondre à d’importantes questions de recherche est d’un grand intérêt. Enfin, il n’existe actuellement aucun modèle animal idéal pour imiter les IDD dans la recherche sur lesIDIV 13,14. Par conséquent, il est nécessaire d’établir un remplacement rentable et fiable, tel qu’un modèle de culture d’organes pour simuler les MDI et les processus inflammatoires et dégénératifs associés. Récemment, l’application du protocole actuel sur l’établissement d’un modèle proinflammatory et dégénératif de culture d’organe pour simuler la maladie de disque intervertébral de tôt-étape nous a permis pour étudier l’effet des drogues anti-inflammatoires dans la culture d’organe d’IDD15.
Ici, nous décrivons comment obtenir les disques intervertébraux bovins et induire l’état de la partie IDD par l’intermédiaire d’un microenvironnement catabolique et proinflammatory provoqué par l’injection intradiscal directe du facteur-alpha de nécrose tumorale (TNF-α) et du chargement dégénératif dans un bioréacteur dans de basses conditions nutritives moyennes. La figure 1 illustre le modèle expérimental et montre le bioréacteur utilisé pour simuler les conditions de charge dégénératives et physiologiques.
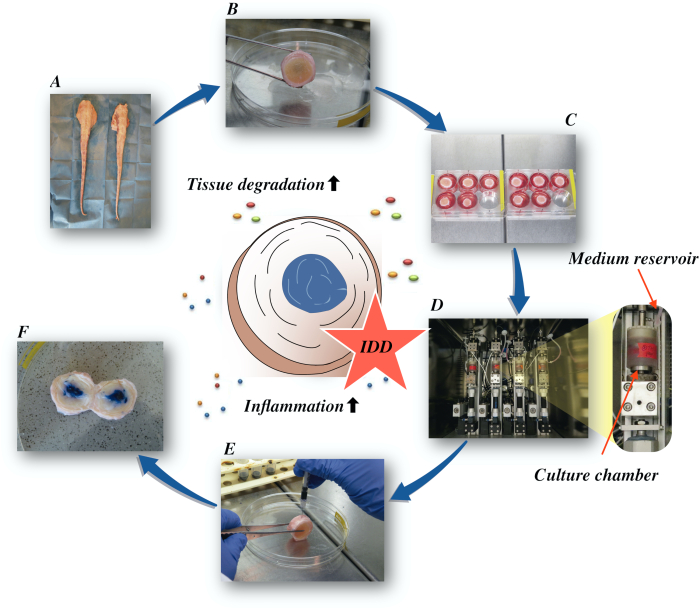
Figure 1: Illustration de la configuration expérimentale. A: queue bovine; B: disques intervertébraux bovins disséqués ; C: transfert du disque sur une plaque de puits avec milieu de culture ; D: chargement de la simulation dans un bioréacteur ; E: technique d’injection intradiscal; F: IVD après injection de PBS/trypan colorant bleu pour révéler la distribution. IDD : dégénérescence de disque intervertébral. Veuillez cliquer ici pour voir une version plus grande de cette figure.
Protocol
Representative Results
Discussion
Nous avons ici fourni un protocole détaillé pour simuler l’IVDD dégénératif et inflammatoire. Ce protocole peut être appliqué pour des examens détaillés des voies inflammatoires menant aux effets destructeurs sur le disque. De plus, le protocole peut aider à déterminer des cibles thérapeutiques prometteuses impliquées dans la progression de la maladie.
Nous avons récemment montré que le TNF-α recombinant humain pouvait induire une inflammation dans les cellules NP bovines et …
Declarações
The authors have nothing to disclose.
Acknowledgements
Ce travail a été soutenu par la Fondation AO et AOSpine International. Babak Saravi a reçu le soutien de la Fondation allemande de la colonne vertébrale et de la Fondation allemande de l’arthrose. Gernot Lang a été soutenu par le Berta-Ottenstein-Programme for Advanced Clinician Scientists, Faculté de médecine, Université de Fribourg, Allemagne.
Materials
| 1-Bromo-3-chloropropane(BCP) | Sigma-Aldrich, St. Louis, USA | B9673 | |
| Ascorbate-2-phosphate | Sigma-Aldrich, St. Louis, USA | A8960 | |
| Band saw | Exakt Apparatebau, Norderstedt, Germany | model 30/833 | |
| Betadine | Munndipharma, Frankfurt, Germany | ||
| Bovine IL-8 Do.it-Yourself ELISA | Kingfisher Biotech, St. Paul, USA | DIY1028B-003 | |
| Corning ITS Premix | Corning Inc., New York, USA | 354350 | |
| DMEM high glucose | Gibco by life technologies, Carlsbad, USA | 10741574 | |
| DMEM low glucose | Gibco by life technologies, Carlsbad, USA | 11564446 | |
| Ethanol for molecular biology | Sigma-Aldrich, St. Louis, USA | 09-0851 | |
| Fetal Bovine Serum (FBS) | Gibco by life technologies, Carlsbad, USA | A4766801 | |
| Non-essential amino acid solution | Gibco by life technologies, Carlsbad, USA | 11140050 | |
| Penicillin/Streptomycin(P/S) | gibco by life technologies, Carlsbad, USA | 11548876 | |
| Phosphate Buffer Solution, tablet | Sigma-Aldrich, St. Louis, USA | P4417 | |
| Pronase | Sigma-Aldrich, St. Louis, USA | 10165921001 | |
| Primocin | InvivoGen, Sandiego, USA | ant-pm-05 | |
| Pulsavac Jet Lavage System | Zimmer, IN,USA | ||
| TissueLyser II | Quiagen, Venlo, Netherlands | 85300 | |
| Streptavidinn-HRP | Kingfisher Biotech, St. Paul, USA | AR0068-001 | |
| Superscript VILO | Invitrogen by life Technologies, Carlsbad, USA | 10704274 | |
| cDNA Synthesis Kit | Applied Biosystems by life technologies | 10400745 | |
| TaqMan Universal Master Mix | Applied Biosystems by life technologies | ||
| TNF-alpha, recombinant human protein | R&D systems, Minnesota, USA | 210-TA-005 | |
| TRI Reagent | Molecular Research Center, Cincinnati, USA | TR 118 | |
| Tris-EDTA buffer solution | sigma-Aldrich, St. Louis, USA | 93283 | |
| Gene bIL-6 | Applied Biosystems by life technologies | Custom made probes | Primer fw (5′–3′) TTC CAA AAA TGG AGG AAA AGG A Primer rev (5′–3′) TCC AGA AGA CCA GCA GTG GTT Probe (5′FAM/3′TAMRA) CTT CCA ATC TGG GTT CAA TCA GGC GATT |
| Gene bIL8 | Applied Biosystems by life technologies | Bt03211906_m1 | |
| Gene bTNF-alpha | Applied Biosystems by life technologies | Custom made probes | Primer fw (5′–3′) CCT CTT CTC AAG CCT CAA GTA ACA A Primer rev (5′–3′) GAG CTG CCC CGG AGA GTT Probe (5′FAM/3′TAMRA) ATG TCG GCT ACA ACG TGG GCT ACC G |
| GENE bIL1beta | Applied Biosystems by life technologies | Custom made probes | Primer fw (5′–3′) TTA CTA CAG TGA CGA GAA TGA GCT GTT Primer rev (5′–3′) GGT CCA GGT GTT GGA TGC A Probe (5′FAM/3′TAMRA) CTC TTC ATC TGT TTA GGG TCA TCA GCC TCA A |
| RPLP0 | Applied Biosystems by life technologies | Bt03218086_m1 |
Referências
- Vos, T., et al. Global, regional, and national incidence, prevalence, and years lived with disability for 328 diseases and injuries for 195 countries, 1990-2016: a systematic analysis for the Global Burden of Disease Study 2016. The Lancet. 390 (10100), 1211-1259 (2017).
- Hoy, D., et al. Measuring the global burden of low back pain. Best Practice & Research Clinical Rheumatology. 24 (2), 155-165 (2010).
- Thiese, M. S., et al. Prevalence of low back pain by anatomic location and intensity in an occupational population. BMC Musculoskeletal Disorders. 15 (1), 283 (2014).
- Katz, J. N. Lumbar Disc Disorders and Low-Back Pain: Socioeconomic Factors and Consequences. The Journal of Bone and Joint Surgery (American). 88, 21 (2006).
- Vlaeyen, J. W. S., et al. Low back pain. Nature Reviews Disease Primers. 4 (1), 52 (2018).
- Khan, A. N., et al. Inflammatory biomarkers of low back pain and disc degeneration: a review: Biomarkers of disc degeneration and back pain. Annals of the New York Academy of Sciences. 1410 (1), 68-84 (2017).
- Kim, H. S., Wu, P. H., Jang, I. T. Lumbar Degenerative Disease Part 1: Anatomy and Pathophysiology of Intervertebral Discogenic Pain and Radiofrequency Ablation of Basivertebral and Sinuvertebral Nerve Treatment for Chronic Discogenic Back Pain: A Prospective Case Series and Review of Literature. International Journal of Molecular Sciences. 21 (4), 1483 (2020).
- Adams, M. A., Roughley, P. J. What is Intervertebral Disc Degeneration, and What Causes It. Spine. 31 (18), 2151-2161 (2006).
- Wu, P. H., Kim, H. S., Jang, I. T. Intervertebral Disc Diseases Part 2: A Review of the Current Diagnostic and Treatment Strategies for Intervertebral Disc Disease. International Journal of Molecular Sciences. 21 (6), 2135 (2020).
- Lurie, J. D., et al. Surgical Versus Nonoperative Treatment for Lumbar Disc Herniation: Eight-Year Results for the Spine Patient Outcomes Research Trial. Spine. 39 (1), 3-16 (2014).
- Risbud, M. V., Shapiro, I. M. Role of cytokines in intervertebral disc degeneration: pain and disc content. Nature Reviews Rheumatology. 10 (1), 44-56 (2014).
- Ponnappan, R. K., et al. An organ culture system to model early degenerative changes of the intervertebral disc. Arthritis Research & Therapy. 13 (5), 171 (2011).
- O’Connell, G. D., Vresilovic, E. J., Elliott, D. M. Comparison of Animals Used in Disc Research to Human Lumbar Disc Geometry. Spine. 32 (3), 328-333 (2007).
- Stannard, J. T., et al. Development of a whole organ culture model for intervertebral disc disease. Journal of Orthopaedic Translation. 5, 1-8 (2016).
- Li, Z., et al. Preclinical ex-vivo Testing of Anti-inflammatory Drugs in a Bovine Intervertebral Degenerative Disc Model. Frontiers in Bioengineering and Biotechnology. 8, 583 (2020).
- Li, Z., et al. Development of an ex vivo cavity model to study repair strategies in loaded intervertebral discs. European Spine Journal. 25 (9), 2898-2908 (2016).
- Kazezian, Z., Li, Z., Alini, M., Grad, S., Pandit, A. Injectable hyaluronic acid down-regulates interferon signaling molecules, IGFBP3 and IFIT3 in the bovine intervertebral disc. Acta Biomaterialia. 52, 118-129 (2017).
- Caprez, S., Menzel, U., Li, Z., Grad, S., Alini, M., Peroglio, M. Isolation of high-quality RNA from intervertebral disc tissue via pronase predigestion and tissue pulverization. JOR Spine. 1 (2), 1017 (2018).
- Lopa, S., Ceriani, C., Cecchinato, R., Zagra, L., Moretti, M., Colombini, A. Stability of housekeeping genes in human intervertebral disc, endplate and articular cartilage cells in multiple conditions for reliable transcriptional analysis. European Cells & Materials. 31, 395-406 (2016).
- Lang, G., et al. An intervertebral disc whole organ culture system to investigate proinflammatory and degenerative disc disease condition. Journal of Tissue Engineering and Regenerative Medicine. 12 (4), 2051-2061 (2018).
- Du, J., et al. Proinflammatory intervertebral disc cell and organ culture models induced by tumor necrosis factor alpha. JOR Spine. 3, 1104 (2020).
- Purmessur, D., Walter, B. A., Roughley, P. J., Laudier, D. M., Hecht, A. C., Iatridis, J. A role for TNFα in intervertebral disc degeneration: A non-recoverable catabolic shift. Biochemical and Biophysical Research Communications. 433 (1), 151-156 (2013).
- Walter, B. A., Likhitpanichkul, M., Illien-Junger, S., Roughley, P. J., Hecht, A. C., Iatridis, J. C. TNFα Transport Induced by Dynamic Loading Alters Biomechanics of Intact Intervertebral Discs. PLOS One. 10 (3), 0118358 (2015).
- Gullbrand, S. E., et al. A large animal model that recapitulates the spectrum of human intervertebral disc degeneration. Osteoarthritis and Cartilage. 25 (1), 146-156 (2017).
- Willems, N., et al. Safety of intradiscal injection and biocompatibility of polyester amide microspheres in a canine model predisposed to intervertebral disc degeneration: intradiscal application of pea microspheres. Journal of Biomedical Materials Research Part B: Applied Biomaterials. 105 (4), 707-714 (2017).
- Michalek, A. J., Buckley, M. R., Bonassar, L. J., Cohen, I., Iatridis, J. C. The effects of needle puncture injury on microscale shear strain in the intervertebral disc annulus fibrosus. The Spine Journal. 10 (12), 1098-1105 (2010).
- Illien-Jünger, S., et al. The combined effects of limited nutrition and high-frequency loading on intervertebral discs with endplates. Spine. 35 (19), 1744-1752 (2010).
- Gantenbein, B., et al. Organ culture bioreactors–platforms to study human intervertebral disc degeneration and regenerative therapy. Current Stem Cell Research & Therapy. 10 (4), 339-352 (2015).
- Boubriak, O. A., Watson, N., Sivan, S. S., Stubbens, N., Urban, J. P. G. Factors regulating viable cell density in the intervertebral disc: blood supply in relation to disc height. Journal of Anatomy. 222 (3), 341-348 (2013).
- Maroudas, A., Stockwell, R. A., Nachemson, A., Urban, J. Factors involved in the nutrition of the human lumbar intervertebral disc: cellularity and diffusion of glucose in vitro. Journal of Anatomy. 120, 113-130 (1975).
- Beckstein, J. C., Sen, S., Schaer, T. P., Vresilovic, E. J., Elliott, D. M. Comparison of Animal Discs Used in Disc Research to Human Lumbar Disc: Axial Compression Mechanics and Glycosaminoglycan Content. Spine. 33 (6), 166-173 (2008).
- Walter, B. A., Illien-Jünger, S., Nasser, P. R., Hecht, A. C., Iatridis, J. C. Development and validation of a bioreactor system for dynamic loading and mechanical characterization of whole human intervertebral discs in organ culture. Journal of Biomechanics. 47 (9), 2095-2101 (2014).
- Rajan, N. E., et al. Toll-Like Receptor 4 (TLR4) Expression and Stimulation in a Model of Intervertebral Disc Inflammation and Degeneration. Spine. 38 (16), 1343-1351 (2013).
- vanden Akker, G. G., Rorije, A. J., Davidson, E. N. B., vander Kraan, P. M. Phenotypic marker genes distinguish inner and outer annulus fibrosus from nucleus pulposus tissue in the bovine intervertebral disc. Osteoarthritis and Cartilage. 25, 402 (2017).
- Du, J., et al. Functional cell phenotype induction with TGF-β1 and collagen-polyurethane scaffold for annulus fibrosus rupture repair. European Cells & Materials. 39, 1-17 (2020).
- Risbud, M. V., et al. Defining the phenotype of young healthy nucleus pulposus cells: recommendations of the Spine Research Interest Group at the 2014 annual ORS meeting. Journal of Orthopaedic Research: Official Publication of the Orthopaedic Research Society. 33 (3), 283-293 (2015).

