Utilizando dispositivos de assistência ventricular percutânea em infarto agudo do miocárdio complicado por choque cardiogênico
Summary
Dispositivos de assistência ventricular percutânea estão sendo cada vez mais utilizados em pacientes com infarto agudo do miocárdio e choque cardiogênico. Aqui, discutimos o mecanismo de ação e os efeitos hemodinâmicos desses dispositivos. Também revisamos algoritmos e melhores práticas para a implantação, gerenciamento e desmaseamento desses dispositivos complexos.
Abstract
O choque cardiogênico é definido como hipotensão persistente, acompanhado de evidências de hipo-perfusão de órgãos finais. Dispositivos de assistência ventricular percutânea (PVADs) são usados para o tratamento de choque cardiogênico em um esforço para melhorar a hemodinâmica. Impella é atualmente o PVAD mais comum e bombeia ativamente sangue do ventrículo esquerdo para a aorta. Os PVADs descarregam o ventrículo esquerdo, aumentam a saída cardíaca e melhoram a perfusão coronária. Os PVADs são tipicamente colocados no laboratório de cateterismo cardíaco sob orientação fluoroscópica através da artéria femoral quando possível. Em casos de doença arterial periférica grave, os PVADs podem ser implantados através de um acesso alternativo. Neste artigo, resumimos o mecanismo de ação do PVAD e os dados que sustentam seu uso no tratamento do choque cardiogênico.
Introduction
O choque cardiogênico (SC) é definido como hipotensão persistente (pressão arterial sistólica 30 minutos, ou a necessidade de vasopressores ou inotropes), hipo-perfusão de órgãos finais (saída de urina 2 mmol/L), congestionamento pulmonar (pressão de cunha capilar pulmonar (PCWP) ≥ 15 mmHg) e diminuição do desempenho cardíaco (índice cardíaco <2,2 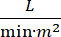 )1, 2 devido a um distúrbio cardíaco primário. Infarto agudo do miocárdio (IAM) é a causa mais comum de CS3. CS ocorre em 5-10% da AM e historicamente tem sido associado com mortalidade significativa3,4. Dispositivos de suporte circulatório mecânico (MCS) como bomba de balão intra-aórtico (IABP), dispositivos de assistência ventricular percutânea (PVAD), oxigenação de membrana extracorpórea (ECMO) e atrial esquerdo percutâneo para dispositivos aórticos são frequentemente usados em pacientes com CS5. O uso rotineiro do IABP não demonstrou melhora nos desfechos clínicos ou na sobrevida na AMI-CS1. Dado os desfechos ruins associados à AMI-CS, as dificuldades na realização de ensaios em AMI-CS, e os resultados negativos do uso do IABP na AMI-CS, os médicos estão cada vez mais olhando para outras formas de SMC.
)1, 2 devido a um distúrbio cardíaco primário. Infarto agudo do miocárdio (IAM) é a causa mais comum de CS3. CS ocorre em 5-10% da AM e historicamente tem sido associado com mortalidade significativa3,4. Dispositivos de suporte circulatório mecânico (MCS) como bomba de balão intra-aórtico (IABP), dispositivos de assistência ventricular percutânea (PVAD), oxigenação de membrana extracorpórea (ECMO) e atrial esquerdo percutâneo para dispositivos aórticos são frequentemente usados em pacientes com CS5. O uso rotineiro do IABP não demonstrou melhora nos desfechos clínicos ou na sobrevida na AMI-CS1. Dado os desfechos ruins associados à AMI-CS, as dificuldades na realização de ensaios em AMI-CS, e os resultados negativos do uso do IABP na AMI-CS, os médicos estão cada vez mais olhando para outras formas de SMC.
Os PVADs são cada vez mais utilizados em pacientes com AMI-CS6. Neste artigo, vamos focar nossa discussão principalmente no IMPELLA CP, que é o PVAD mais comum usado atualmente6. Este dispositivo utiliza uma bomba de parafuso de fluxo axial que impulsiona ativamente e continuamente o sangue do ventrículo esquerdo (LV) para a aorta ascendente(Figura 1). O dispositivo é mais frequentemente colocado no laboratório de cateterismo cardíaco sob orientação fluoroscópica através da artéria femoral. Alternativamente, pode ser implantado através de um acesso axilar ou transcaval quando necessário7,8.
Protocol
Representative Results
Discussion
Minimizando os riscos e complicações do PVAD (Tabela 2)
Os benefícios hemodinâmicos do PVAD podem ser significativamente neutralizados se ocorrerem complicações do acesso de grandes furos, como hemorragia grave e isquemia aguda de membros28,29. Por isso, é essencial minimizar o risco e as complicações do dispositivo.
Para diminuir as complicações do local de acesso e reduzir o número de tentativas de ace…
Declarações
The authors have nothing to disclose.
Acknowledgements
Nenhum
Materials
| 4 Fr-018-10 cm Silhouette Stiffened Micropuncture Set | Cook | G48002 | Microvascular access |
| 5 Fr Infiniti Pigtail Catheter | Cordis | 524-550S | pigtail catheter |
| Impella CP Intra-cardiac Assist Catheter | ABIOMED | 0048-0003 | Impella catheter kit |
Referências
- Holger, T., et al. Intraaortic Balloon Pump in Cardiogenic Shock Complicating Acute Myocardial Infarction. Circulation. 139 (3), 395-403 (2019).
- Hochman, J. S., et al. Early Revascularization in Acute Myocardial Infarction Complicated by Cardiogenic Shock. New England Journal of Medicine. 341 (9), 625-634 (1999).
- van Diepen, S., et al. Contemporary Management of Cardiogenic Shock: A Scientific Statement From the American Heart Association. Circulation. 136 (16), 232-268 (2017).
- Kolte, D. h. a. v. a. l., et al. Trends in Incidence, Management, and Outcomes of Cardiogenic Shock Complicating ST-Elevation Myocardial Infarction in the United States. Journal of the American Heart Association. 3 (1), 000590 (2014).
- Aditya, M., Sunil, R. V. Percutaneous Mechanical Circulatory Support Devices in Cardiogenic Shock. Circulation: Cardiovascular Interventions. 10 (5), 004337 (2017).
- Amit, A. P., et al. The Evolving Landscape of Impella Use in the United States Among Patients Undergoing Percutaneous Coronary Intervention With Mechanical Circulatory Support. Circulation. 141 (4), 273-284 (2020).
- Kajy, M., et al. Deploying Mechanical Circulatory Support Via the Axillary Artery in Cardiogenic Shock and High-Risk Percutaneous Coronary Intervention. The American Journal of Cardiology. 128, 127-133 (2020).
- Afana, M., et al. Transcaval access for the emergency delivery of 5.0 liters per minute mechanical circulatory support in cardiogenic shock. Catheterization and Cardiovascular Interventions. , 29235 (2020).
- Sandoval, Y., et al. Contemporary Arterial Access in the Cardiac Catheterization Laboratory. JACC: Cardiovascular Interventions. 10 (22), 2233-2241 (2017).
- Seto, A. H., et al. Real-Time Ultrasound Guidance Facilitates Femoral Arterial Access and Reduces Vascular Complications. JACC: Cardiovascular Interventions. 3 (7), 751-758 (2010).
- Mignatti, A., Friedmann, P., Slovut, D. P. Targeting the safe zone: A quality improvement project to reduce vascular access complications: Vascular Access Complications Postcardiac Catheterization. Catheterization and Cardiovascular Interventions. 91 (1), 27-32 (2018).
- Rihal, C. S., et al. 2015 SCAI/ACC/HFSA/STS Clinical Expert Consensus Statement on the Use of Percutaneous Mechanical Circulatory Support Devices in Cardiovascular Care: Endorsed by the American Heart Assocation, the Cardiological Society of India, and Sociedad Latino Americana de Cardiologia Intervencion; Affirmation of Value by the Canadian Association of Interventional Cardiology-Association Canadienne de Cardiologie d’intervention. Journal of the American College of Cardiology. 65 (19), 7-26 (2015).
- Burzotta, F., et al. Impella ventricular support in clinical practice: Collaborative viewpoint from a European expert user group. International Journal of Cardiology. 201, 684-691 (2015).
- Basir, M. B., et al. Improved Outcomes Associated with the use of Shock Protocols: Updates from the National Cardiogenic Shock Initiative. Catheterization and Cardiovascular Interventions. 93 (7), 1173-1183 (2019).
- Kaki, A., et al. Access and closure management of large bore femoral arterial access. Journal of Interventional Cardiology. 31 (6), 969-977 (2018).
- Basir, M. B., et al. Effect of Early Initiation of Mechanical Circulatory Support on Survival in Cardiogenic Shock. The American Journal of Cardiology. 119 (6), 845-851 (2017).
- Tehrani, B. N., et al. Standardized Team-Based Care for Cardiogenic Shock. Journal of the American College of Cardiology. 73 (13), 1659-1669 (2019).
- Ouweneel, D. M., et al. Percutaneous Mechanical Circulatory Support Versus Intra-Aortic Balloon Pump in Cardiogenic Shock After Acute Myocardial Infarction. Journal of the American College of Cardiology. 69 (3), 278-287 (2017).
- Alushi, B., et al. Impella versus IABP in acute myocardial infarction complicated by cardiogenic shock. Open Heart. 6 (1), 000987 (2019).
- Ginwalla, M., Tofovic, D. S. Current Status of Inotropes in Heart Failure. Heart Failure Clinics. 14 (4), 601-616 (2018).
- O’Neill, W. W., et al. Analysis of outcomes for 15,259 US patients with acute myocardial infarction cardiogenic shock (AMICS) supported with the Impella device. American Heart Journal. 202, 33-38 (2018).
- O’neill, W. W., et al. The Current Use of Impella 2.5 in Acute Myocardial Infarction Complicated by Cardiogenic Shock: Results from the USpella Registry. Journal of Interventional Cardiology. 27 (1), 1-11 (2014).
- Hernandez, G. A., et al. Trends in Utilization and Outcomes of Pulmonary Artery Catheterization in Heart Failure With and Without Cardiogenic Shock. Journal of Cardiac Failure. 25 (5), 364-371 (2019).
- Thayer, K., et al. Pulmonary Artery Catheter Usage and Mortality in Cardiogenic Shock. The Journal of Heart and Lung Transplantation. 39 (4), 54-55 (2020).
- Fincke, R., et al. Cardiac power is the strongest hemodynamic correlate of mortality in cardiogenic shock: A report from the SHOCK trial registry. Journal of the American College of Cardiology. 44 (2), 340-348 (2004).
- Lim, H. S., Gustafsson, F. Pulmonary artery pulsatility index: physiological basis and clinical application. European Journal of Heart Failure. 22 (1), 32-38 (2020).
- Korabathina, R., et al. The pulmonary artery pulsatility index identifies severe right ventricular dysfunction in acute inferior myocardial infarction. Catheterization and Cardiovascular Interventions. 80 (4), 593-600 (2012).
- Lauten, A., et al. Percutaneous left-ventricular support with the Impella-2.5-assist device in acute cardiogenic shock: results of the Impella-EUROSHOCK-registry. Circulation. Heart Failure. 6 (1), 23-30 (2013).
- Dixon, S. R., et al. A Prospective Feasibility Trial Investigating the Use of the Impella 2.5 System in Patients Undergoing High-Risk Percutaneous Coronary Intervention (The PROTECT I Trial): Initial U.S. Experience. JACC: Cardiovascular Interventions. 2 (2), 91-96 (2009).
- Abu-Fadel, M. S., et al. Fluoroscopy vs. Traditional guided femoral arterial access and the use of closure devices: A randomized controlled trial. Catheterization and Cardiovascular Interventions. 74 (4), 533-539 (2009).
- Lata, K., Kaki, A., Grines, C., Blank, N., Elder, M., Schreiber, T. Pre-close technique of percutaneous closure for delayed hemostasis of large-bore femoral sheaths. Journal of Interventional Cardiology. 31 (4), 504-510 (2018).
- Basir, M. B., et al. Feasibility of early mechanical circulatory support in acute myocardial infarction complicated by cardiogenic shock: The Detroit cardiogenic shock initiative. Catheterization and Cardiovascular Interventions. 91 (3), 454-461 (2018).
- Udesen, N. J., et al. Rationale and design of DanGer shock: Danish-German cardiogenic shock trial. American Heart Journal. 214, 60-68 (2019).
- Clinical Research. Protected PCI Community Available from: https://www.protectedpci.com/clinical-research/ (2020)
- Seyfarth, M., et al. A Randomized Clinical Trial to Evaluate the Safety and Efficacy of a Percutaneous Left Ventricular Assist Device Versus Intra-Aortic Balloon Pumping for Treatment of Cardiogenic Shock Caused by Myocardial Infarction. Journal of the American College of Cardiology. 52 (19), 1584-1588 (2008).
- Schrage, B., et al. Impella Support for Acute Myocardial Infarction Complicated by Cardiogenic Shock. Circulation. 139 (10), 1249-1258 (2019).
- Casassus, F., et al. The use of Impella 2.5 in severe refractory cardiogenic shock complicating an acute myocardial infarction. Journal of Interventional Cardiology. 28 (1), 41-50 (2015).
- Joseph, S. M., Brisco, M. A., Colvin, M., Grady, K. L., Walsh, M. N., Cook, J. L. Women With Cardiogenic Shock Derive Greater Benefit From Early Mechanical Circulatory Support: An Update From the cVAD Registry. Journal of Interventional Cardiology. 29 (3), 248-256 (2016).
- Lauten, A., et al. Percutaneous Left-Ventricular Support With the Impella-2.5-Assist Device in Acute Cardiogenic Shock. Circulation: Heart Failure. 6 (1), 23-30 (2013).
- Ouweneel, D. M., et al. Impella CP Versus Intra-Aortic Balloon Pump in Acute Myocardial Infarction Complicated by Cardiogenic Shock: The IMPRESS trial. Journal of the American College of Cardiology. , 23127 (2016).
- Badiye, A. P., Hernandez, G. A., Novoa, I., Chaparro, S. V. Incidence of Hemolysis in Patients with Cardiogenic Shock Treated with Impella Percutaneous Left Ventricular Assist Device. ASAIO Journal. 62 (1), 11-14 (2016).

