Ganglioside extractie, zuivering en profilering
Summary
Gangliosiden zijn siaalzuurhoudende glycosfingolipiden die bijzonder overvloedig aanwezig zijn in de hersenen. Hun amfipathische aard vereist organische /waterige extractie- en zuiveringstechnieken om optimaal herstel en nauwkeurige analyses te garanderen. Dit artikel biedt een overzicht van analytische en preparatieve schaal ganglioside extractie, zuivering en dunne laag chromatografie analyse.
Abstract
Gangliosiden zijn glycosfingolipiden die een of meer siaalzuurresiduen bevatten. Ze zijn te vinden op alle gewervelde cellen en weefsels, maar zijn vooral overvloedig aanwezig in de hersenen. Voornamelijk uitgedrukt op de buitenste folder van de plasmamembranen van cellen, moduleren ze de activiteiten van celoppervlakeiwitten via laterale associatie, fungeren ze als receptoren in cel-celinteracties en zijn ze doelwitten voor pathogenen en toxines. Genetische ontregeling van ganglioside biosynthese bij de mens resulteert in ernstige aangeboren aandoeningen van het zenuwstelsel. Vanwege hun amfipathische aard vereisen extractie, zuivering en analyse van gangliosiden technieken die door veel onderzoekers in de 80 jaar sinds hun ontdekking zijn geoptimaliseerd. Hier beschrijven we bench-level methoden voor de extractie, zuivering en voorlopige kwalitatieve en kwantitatieve analyses van belangrijke gangliosiden uit weefsels en cellen die in een paar uur kunnen worden voltooid. We beschrijven ook methoden voor grootschalige isolatie en zuivering van belangrijke ganglioside soorten uit de hersenen. Samen bieden deze methoden analytische en preparatieve schaaltoegang tot deze klasse van bioactieve moleculen.
Introduction
Gangliosiden worden gedefinieerd als glycosfingolipiden met een of meer siaalzuurresiduen1. Ze komen voornamelijk tot expressie aan het celoppervlak met hun hydrofobe ceramide lipidegroep ingebed in de buitenste klep van het plasmamembraan en hun hydrofiele glycanen die zich uitstrekken tot in de extracellulaire ruimte2. Hoewel ze wijd verspreid zijn in gewervelde cellen en weefsels, zijn ze vooral overvloedig aanwezig in de hersenen van gewervelde dieren3, waar ze voor het eerst werden ontdekt en benoemd4.
De structuren van ganglioside glycanen variëren en vormen de basis voor hun nomenclatuur (figuur 1). Ganglioside glycanen bestaan uit een neutrale suikerkern met verschillende nummers en verdelingen van siaalzuren. Het kleinste ganglioside, GM4, heeft slechts twee suikers (siaalzuur gebonden aan galactose)5. Grotere natuurlijk voorkomende gangliosiden kunnen meer dan een dozijn totale suikers6 of maximaal zeven siaalzuren bevatten op een enkele neutrale kern7. Hun ceramide lipide moieties variëren ook, met verschillende sfingosine lengtes en een verscheidenheid aan vetzuuramiden. In de hersenen van gewervelde dieren overheersen vier ganglioside-soorten, GM1, GD1a, GD1b en GT1b. Ganglioside-expressie is ontwikkelingsreguleerd, weefselspecifiek en celtypespecifiek.
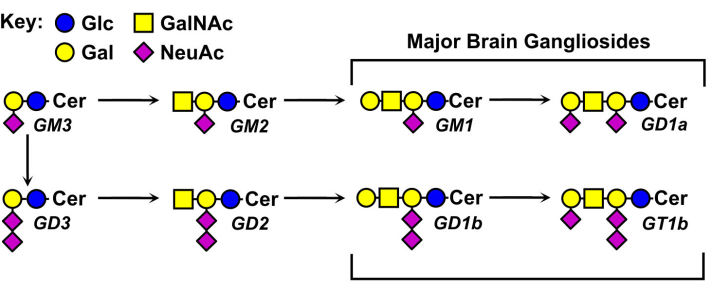
Figuur 1: Belangrijke hersengangliosiden en hun biosynthetische voorlopers. Structuren worden weergegeven met behulp van symboolnomenclatuur voor glycanen11. Klik hier om een grotere versie van deze figuur te bekijken.
Gangliosiden functioneren op moleculair niveau door eiwitten in hun eigen membranen te betrekken en te moduleren (cis-regulatie) of door glycaanbindende eiwitten in het extracellulaire milieu te betrekken, inclusief bacteriële toxines en lectines op andere cellen (transherkenning)3. Specifieke binding van gangliosiden aan regulerende eiwitten en / of zelfassociatie met andere moleculen in lipidevlotten resulteert in veranderingen in celgedrag die van invloed zijn op de structuur en functie van het zenuwstelsel, kankerprogressie, metabolisme, ontsteking, neuronale proteïnopathieën en infectieziekten8. Vanwege hun diverse cellulaire rollen kunnen methoden voor hun isolatie en analyse verbeterde inzichten bieden in de regulatie van fysiologische en pathologische processen. Hier worden gevalideerde methoden voor snelle kleinschalige extractie en analyse en preparatieve schaalisolatie van gangliosiden uit de hersenen verstrekt. Kansen en uitdagingen voor toepassing op andere weefsels worden besproken.
Protocol
Representative Results
Discussion
De methoden voor kleine en grootschalige ganglioside-extractie en -isolatie die hier worden gerapporteerd, zijn niet uniek – er zijn veel verschillende oplosmiddelextractie- en zuiveringsbenaderingen die uitstekende resultaten opleveren12. De hier gerapporteerde methoden voor kleinschalige zuivering uit de hersenen, van Fredman en Svennerholm13, bleken het herstel te optimaliseren en hebben gedurende vele jaren in ons laboratorium bewezen robuust en eenvoudig te zijn. Isola…
Declarações
The authors have nothing to disclose.
Acknowledgements
Dit werk werd ondersteund door national institutes of health (NIH) Common Fund for Glycoscience grant U01CA241953. MJP werd ondersteund door het Chemistry-Biology Interface Program van Johns Hopkins (T32GM080189).
Materials
| Bovine brain, stripped | PelFreez | 57105-1 | |
| Ganglioside standards | Matreya | GM1, 1061; GD1a, 1062; GD1b, 1501; GT1b, 1063 | |
| Glass bottle with PTFE-lined cap | Fisher Scientific | 02-911-739 | |
| Glass centrifuge bottle | Fisher Scientific | 05-586B | |
| Glass culture tubes, 16 x 125 mm | VWR | 60825-430 | for collecting HPLC fractions |
| Glass separatory funnel (2 L) | Pyrex | 6400-2L | |
| Injection syringe – Hamilton 1750 gastight 500 µl | Hamilton | 81265 | |
| p-Anisaldehyde, 98% | Sigma-Aldrich | A88107 | |
| Potter-Elvhjem Homogenizer | Fisher Scientific | 08-414-14A | Choose appropriate volume option |
| Reprosil 100 NH2 10µm 5x4mm guard columns | Analytics-Shop | AAVRS1N-100540-5 | |
| Reprospher 100 NH2, 5 μm, 250 mm x 20 mm HPLC column | Analytics-Shop | custom packed | other sizes available |
| Resorcinol | Sigma-Aldrich | 30752-1 | |
| Rotary evaporator | Buchi | R-300 | |
| Sample loop for Model 7725 Injector (5 ml) | Sigma-Aldrich | 57632 | |
| Sep-Pak tC18 Cartidges Vac 35 cc (10 g) | Waters | WAT043350 | |
| Sep-Pak tC18 Plus Short Cartridge, 400 mg | Waters | WAT036810 | |
| Spotting syringe – Hamilton 701N 10 µl | Hamilton | 80300 | |
| Thick-walled 13-mm diameter test tubes with PFTE lined caps | Fisher Scientific | 14-933A | |
| Threaded 2-ml vials with PFTE lined caps | Fisher Scientific | 14-955-323 | For ganglioside storage |
| TLC plates, HPTLC Silica gel 60 F254 Multiformat | Fisher Scientific | M1056350001 | Fluorescence impregnation (F254) stabilizes the sorbent surface |
| TLC reagent sprayer | Fisher Scientific | 05-723-26A | |
| TLC running chamber for 10 x 10 cm plates | Camag | 22.5155 | |
| Waring 1-Liter Stainless Steal Explosion Resistant Blender | Waring | E8520 |
Referências
- Schnaar, R. L. The Biology of Gangliosides. Advances in Carbohydrate Chemistry and Biochemistry. 76, 113-148 (2019).
- DeMarco, M. L., Woods, R. J. Atomic-resolution conformational analysis of the GM3 ganglioside in a lipid bilayer and its implications for ganglioside-protein recognition at membrane surfaces. Glycobiology. 19 (4), 344-355 (2009).
- Schnaar, R. L. Gangliosides of the vertebrate nervous system. Journal of Molecular Biology. 428, 3325-3336 (2016).
- Klenk, E. Über die Ganglioside, eine neue Gruppe von zuckerhaltigen Gehirnlipoiden [About gangliosides, a new group of sugar-containing brain lipids]. Hoppe-Seyler’s Zeitschrift für Physiologische Chemie. 273, 76-86 (1942).
- Uemura, S., Go, S., Shishido, F., Inokuchi, J. Expression machinery of GM4: the excess amounts of GM3/GM4S synthase (ST3GAL5) are necessary for GM4 synthesis in mammalian cells. Glycoconjugate Journal. 31 (2), 101-108 (2014).
- Nimrichter, L., et al. E-selectin receptors on human leukocytes. Blood. 112 (9), 3744-3752 (2008).
- Saito, M., Kitamura, H., Sugiyama, K. A novel heptasialosyl c-series ganglioside in embryonic chicken brain: its structure and stage-specific expression. Biochimica et Biophysica Acta (BBA) – Bioenergetics. 1571 (1), 18-26 (2002).
- Todeschini, A. R., Hakomori, S. I. Functional role of glycosphingolipids and gangliosides in control of cell adhesion, motility, and growth, through glycosynaptic microdomains. Biochimica et Biophysica Acta (BBA) – Bioenergetics. 1780 (3), 421-433 (2008).
- Sturgill, E. R., et al. Biosynthesis of the major brain gangliosides GD1a and GT1b. Glycobiology. 22, 1289-1301 (2012).
- Cavdarli, S., Delannoy, P., Groux-Degroote, S. O-Acetylated gangliosides as targets for cancer immunotherapy. Cells. 9 (3), (2020).
- Varki, A., et al. Symbol nomenclature for graphical representations of glycans. Glycobiology. 25 (12), 1323-1324 (2015).
- Schnaar, R. L. Isolation of glycosphingolipids. Methods in Enzymology. 230, 348-370 (1994).
- Svennerholm, L., Fredman, P. A procedure for the quantitative isolation of brain gangliosides. Biochimica et Biophysica Acta (BBA) – Bioenergetics. 617, 97-109 (1980).
- Tettamanti, G., Bonali, F., Marchesini, S., Zambotti, V. A new procedure for the extraction, purification and fractionation of brain gangliosides. Biochimica et Biophysica Acta (BBA) – Bioenergetics. 296, 160-170 (1973).
- Gazzotti, G., Sonnino, S., Ghidoni, R. Normal-phase high-performance liquid chromatographic separation of non-derivatized ganglioside mixtures. Journal of Chromatography. 348, 371-378 (1985).
- Schnaar, R. L., Needham, L. K. Thin-layer chromatography of glycosphingolipids. Methods in Enzymology. 230, 371-389 (1994).
- Ledeen, R. W., Yu, R. K. Gangliosides: structure, isolation, and analysis. Methods in Enzymology. 83, 139-191 (1982).
- Lopez, P. H., et al. Mice lacking sialyltransferase ST3Gal-II develop late-onset obesity and insulin resistance. Glycobiology. 27 (2), 129-139 (2017).

