ガングリオシドの抽出、精製、プロファイリング
Summary
ガングリオシドは、シアル酸を含むスフィンゴ糖脂質であり、脳内に特に豊富に存在する。それらの両親媒性の性質は、最適な回収と正確な分析を確実にするために有機/水性抽出および精製技術を必要とする。この記事では、分析および分取スケールのガングリオシドの抽出、精製、および薄層クロマトグラフィー分析の概要を提供します。
Abstract
ガングリオシドは、1つ以上のシアル酸残基を含むスフィンゴ糖脂質である。それらはすべての脊椎動物の細胞および組織に見られるが、脳に特に豊富に存在する。主に細胞の原形質膜の外側小葉に発現し、横方向の会合を介して細胞表面タンパク質の活性を調節し、細胞間相互作用における受容体として作用し、病原体および毒素の標的である。ヒトにおけるガングリオシド生合成の遺伝的調節不全は、重度の先天性神経系障害をもたらす。ガングリオシドの両親媒性の性質上、ガングリオシドの抽出、精製、および分析には、発見以来80年間に多くの研究者によって最適化された技術が必要です。ここでは、数時間で完了できる組織および細胞からの主要なガングリオシドの抽出、精製、および予備的な定性的および定量的分析のためのベンチレベルの方法について説明する。我々はまた、脳からの主要なガングリオシド種のより大きなスケールの単離および精製のための方法を記述する。一緒に、これらの方法は、生理活性分子のこのクラスへの分析的および分取スケールアクセスを提供します。
Introduction
ガングリオシドは、1つ以上のシアル酸残基を有するスフィンゴ糖脂質1として定義される。それらは主に細胞表面で発現し、その疎水性セラミド脂質部分は原形質膜の外小葉に埋め込まれ、親水性グリカンは細胞外空間に広がっています2。脊椎動物の細胞や組織に広く分布していますが、脊椎動物の脳3に特に豊富に存在しており、そこで最初に発見され命名されました4。
ガングリオシドグリカンの構造はさまざまで、その命名法の基礎となっている(図1)。ガングリオシドグリカンは、シアル酸の異なる数および分布を有する中性糖コアからなる。最小のガングリオシドであるGM4は、2つの糖(ガラクトースに結合したシアル酸)のみを有する5。より大きな天然に存在するガングリオシドは、単一の中性コア上に1ダース以上の総糖6 または最大7つのシアル酸を含むことができる7。それらのセラミド脂質部分も変化し、異なるスフィンゴシン長および様々な脂肪酸アミドを有する。脊椎動物の脳では、4つのガングリオシド種、GM1、GD1a、GD1b、およびGT1bが優勢である。ガングリオシド発現は、発生的に調節され、組織特異的であり、かつ細胞型特異的である。
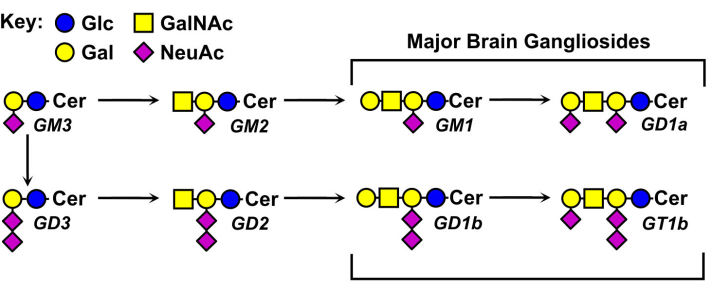
図1:主要な脳ガングリオシドおよびその生合成前駆体。 構造は、グリカン11のシンボル命名法を用いて示されている。 この図の拡大版を表示するには、ここをクリックしてください。
ガングリオシドは、自身の膜にタンパク質を関与させ調節することによって(シス調節)、または他の細胞上の細菌毒素およびレクチンを含む細胞外環境におけるグリカン結合タンパク質を関与させること(トランス認識)によって分子レベルで機能する3。ガングリオシドの調節タンパク質への特異的結合および/または他の分子との脂質ラフトへの自己会合は、神経系の構造および機能、癌の進行、代謝、炎症、神経細胞タンパク質障害、および感染症に影響を与える細胞挙動の変化をもたらす8。それらの多様な細胞の役割のために、それらの単離および分析のための方法は、生理学的および病理学的プロセスの調節に関する強化された洞察を提供することができる。ここでは、迅速な小規模抽出および分析のための検証された方法、および脳からのガングリオシドの分取スケール単離が提供される。他の組織への適用のための機会と課題が議論される。
Protocol
Representative Results
Discussion
ここで報告された小規模および大規模のガングリオシドの抽出および単離の方法は、独自のものではなく、優れた結果を提供する多くの異なる溶媒抽出および精製アプローチがあります12。FredmanとSvennerholm13からの脳からの小規模精製のためにここで報告された方法は、回復を最適化することが示され、私たちの研究室で長年にわたって堅牢で簡単であるこ…
Declarações
The authors have nothing to disclose.
Acknowledgements
この研究は、米国国立衛生研究所(NIH)の共通基金(Common Fund for Glycoscience)助成金U01CA241953の支援を受けた。MJPは、ジョンズ・ホプキンス大学の化学-生物学界面プログラム(T32GM080189)の支援を受けた。
Materials
| Bovine brain, stripped | PelFreez | 57105-1 | |
| Ganglioside standards | Matreya | GM1, 1061; GD1a, 1062; GD1b, 1501; GT1b, 1063 | |
| Glass bottle with PTFE-lined cap | Fisher Scientific | 02-911-739 | |
| Glass centrifuge bottle | Fisher Scientific | 05-586B | |
| Glass culture tubes, 16 x 125 mm | VWR | 60825-430 | for collecting HPLC fractions |
| Glass separatory funnel (2 L) | Pyrex | 6400-2L | |
| Injection syringe – Hamilton 1750 gastight 500 µl | Hamilton | 81265 | |
| p-Anisaldehyde, 98% | Sigma-Aldrich | A88107 | |
| Potter-Elvhjem Homogenizer | Fisher Scientific | 08-414-14A | Choose appropriate volume option |
| Reprosil 100 NH2 10µm 5x4mm guard columns | Analytics-Shop | AAVRS1N-100540-5 | |
| Reprospher 100 NH2, 5 μm, 250 mm x 20 mm HPLC column | Analytics-Shop | custom packed | other sizes available |
| Resorcinol | Sigma-Aldrich | 30752-1 | |
| Rotary evaporator | Buchi | R-300 | |
| Sample loop for Model 7725 Injector (5 ml) | Sigma-Aldrich | 57632 | |
| Sep-Pak tC18 Cartidges Vac 35 cc (10 g) | Waters | WAT043350 | |
| Sep-Pak tC18 Plus Short Cartridge, 400 mg | Waters | WAT036810 | |
| Spotting syringe – Hamilton 701N 10 µl | Hamilton | 80300 | |
| Thick-walled 13-mm diameter test tubes with PFTE lined caps | Fisher Scientific | 14-933A | |
| Threaded 2-ml vials with PFTE lined caps | Fisher Scientific | 14-955-323 | For ganglioside storage |
| TLC plates, HPTLC Silica gel 60 F254 Multiformat | Fisher Scientific | M1056350001 | Fluorescence impregnation (F254) stabilizes the sorbent surface |
| TLC reagent sprayer | Fisher Scientific | 05-723-26A | |
| TLC running chamber for 10 x 10 cm plates | Camag | 22.5155 | |
| Waring 1-Liter Stainless Steal Explosion Resistant Blender | Waring | E8520 |
Referências
- Schnaar, R. L. The Biology of Gangliosides. Advances in Carbohydrate Chemistry and Biochemistry. 76, 113-148 (2019).
- DeMarco, M. L., Woods, R. J. Atomic-resolution conformational analysis of the GM3 ganglioside in a lipid bilayer and its implications for ganglioside-protein recognition at membrane surfaces. Glycobiology. 19 (4), 344-355 (2009).
- Schnaar, R. L. Gangliosides of the vertebrate nervous system. Journal of Molecular Biology. 428, 3325-3336 (2016).
- Klenk, E. Über die Ganglioside, eine neue Gruppe von zuckerhaltigen Gehirnlipoiden [About gangliosides, a new group of sugar-containing brain lipids]. Hoppe-Seyler’s Zeitschrift für Physiologische Chemie. 273, 76-86 (1942).
- Uemura, S., Go, S., Shishido, F., Inokuchi, J. Expression machinery of GM4: the excess amounts of GM3/GM4S synthase (ST3GAL5) are necessary for GM4 synthesis in mammalian cells. Glycoconjugate Journal. 31 (2), 101-108 (2014).
- Nimrichter, L., et al. E-selectin receptors on human leukocytes. Blood. 112 (9), 3744-3752 (2008).
- Saito, M., Kitamura, H., Sugiyama, K. A novel heptasialosyl c-series ganglioside in embryonic chicken brain: its structure and stage-specific expression. Biochimica et Biophysica Acta (BBA) – Bioenergetics. 1571 (1), 18-26 (2002).
- Todeschini, A. R., Hakomori, S. I. Functional role of glycosphingolipids and gangliosides in control of cell adhesion, motility, and growth, through glycosynaptic microdomains. Biochimica et Biophysica Acta (BBA) – Bioenergetics. 1780 (3), 421-433 (2008).
- Sturgill, E. R., et al. Biosynthesis of the major brain gangliosides GD1a and GT1b. Glycobiology. 22, 1289-1301 (2012).
- Cavdarli, S., Delannoy, P., Groux-Degroote, S. O-Acetylated gangliosides as targets for cancer immunotherapy. Cells. 9 (3), (2020).
- Varki, A., et al. Symbol nomenclature for graphical representations of glycans. Glycobiology. 25 (12), 1323-1324 (2015).
- Schnaar, R. L. Isolation of glycosphingolipids. Methods in Enzymology. 230, 348-370 (1994).
- Svennerholm, L., Fredman, P. A procedure for the quantitative isolation of brain gangliosides. Biochimica et Biophysica Acta (BBA) – Bioenergetics. 617, 97-109 (1980).
- Tettamanti, G., Bonali, F., Marchesini, S., Zambotti, V. A new procedure for the extraction, purification and fractionation of brain gangliosides. Biochimica et Biophysica Acta (BBA) – Bioenergetics. 296, 160-170 (1973).
- Gazzotti, G., Sonnino, S., Ghidoni, R. Normal-phase high-performance liquid chromatographic separation of non-derivatized ganglioside mixtures. Journal of Chromatography. 348, 371-378 (1985).
- Schnaar, R. L., Needham, L. K. Thin-layer chromatography of glycosphingolipids. Methods in Enzymology. 230, 371-389 (1994).
- Ledeen, R. W., Yu, R. K. Gangliosides: structure, isolation, and analysis. Methods in Enzymology. 83, 139-191 (1982).
- Lopez, P. H., et al. Mice lacking sialyltransferase ST3Gal-II develop late-onset obesity and insulin resistance. Glycobiology. 27 (2), 129-139 (2017).

