Лучевая терапия на основе позитронно-эмиссионной томографии в модели крысы с использованием платформы радиационных исследований мелких животных
Summary
Здесь мы представляем протокол для выполнения доклинической позитронно-эмиссионной томографии на основе лучевой терапии в модели глиобластомы крыс с использованием алгоритмов, разработанных собственными силами для оптимизации точности и эффективности.
Abstract
Ранее была создана модель глиобластомы крыс для имитации химиолучевого лечения глиобластомы человека в клинике. Подобно клиническому лечению, компьютерная томография (КТ) и магнитно-резонансная томография (МРТ) были объединены в процессе планирования лечения. Впоследствии была добавлена позитронно-эмиссионная томография (ПЭТ) для реализации увеличения субобъема с использованием системы микрооблучения. Тем не менее, объединение трех методов визуализации (КТ, МРТ и ПЭТ) с использованием системы микролучения оказалось трудоемким, поскольку мультимодальная визуализация, планирование лечения и доставка дозы должны быть завершены последовательно в доклинических условиях. Это также приводит к рабочему процессу, который более подвержен человеческим ошибкам. Поэтому был реализован удобный алгоритм для дальнейшей оптимизации доклинического планирования лучевой терапии на основе мультимодальной визуализации. Этот программный инструмент был использован для оценки точности и эффективности лучевой терапии с микролучением с использованием дизайна исследования in silico . Новая методология лучевой терапии дозовым окрашиванием превосходит ранее описанный метод с точки зрения точности, эффективности времени и внутри- и межпользовательской изменчивости. Это также важный шаг на пути к внедрению обратного планирования лечения на микрооблучателях, где по-прежнему широко используется перспективное планирование, в отличие от клинических систем.
Introduction
Глиобластома (ГБ) является злокачественной и очень агрессивной первичной опухолью головного мозга. GB представляет собой твердую гетерогенную опухоль, обычно характеризующуюся инфильтративными границами, ядерной атипией и некрозом1. Наличие гематоэнцефалического барьера и статус мозга как иммунно-привилегированного сайта делает открытие новых мишеней для химио- и иммунотерапии сложной задачей2,3,4. Примечательно, что лечение пациентов с ГБ практически не изменилось с момента введения в 2005 году протокола Ступпа, который сочетает в себе внешнюю лучевую терапию (РТ) с сопутствующим темозоломидом, за которым обычно следует адъювант темозоломид5. Как правило, протоколу Ступпа предшествует максимальная хирургическая резекция. Поэтому альтернативные подходы к лечению имеют решающее значение.
Современная лучевая терапия для пациентов с глиобластомой доставляет однородную дозу облучения к определенному объему опухоли. В радиационной онкологии существует важная корреляция доза-реакция для глиобластомы с увеличением дозы, которая, по-видимому, ограничивается около 60 Гр из-за повышенной токсичности для нормального мозга6,7. Однако опухоли могут быть очень (радиобиологически) гетерогенными, с градиентами уровня кислорода и/или большими различиями в клеточной плотности. Методы метаболической визуализации, такие как ПЭТ, могут визуализировать эти биологические особенности и могут быть использованы для настройки назначения дозы. Этот подход известен как дозовая покраска RT. Этот термин был введен Ling et al. в 2000 году. Авторы определили дозовую живопись RT как производящую «изысканно конформные распределения доз в пределах ограничений распространения и рассеяния радиации»8.
Существует два типа дозовой окраски РТ, роспись дозы контурами (DPBC), с помощью которой доза назначается набору вложенных подтомов, и роспись дозы по числам (DPBN), при которой доза назначается на уровне вокселя. Распределение дозы для DPBN RT может быть извлечено из функциональных изображений. Доза в каждом вокселе определяется интенсивностью I соответствующего вокселя на изображении, с нижним и верхним пределом, чтобы убедиться, что, с одной стороны, достаточная доза доставляется в каждую часть опухоли. С другой стороны, дозы не превышают верхнего предела, чтобы защитить органы, подверженные риску, и избежать токсичности. Наиболее простым методом является линейная интерполяция (см. Экв. 1) между минимальной дозой Dmin и максимальной дозой Dmax, пропорционально варьирующаяся между минимальной интенсивностью Imax и максимальной интенсивностью в пределах целевого объема9,10
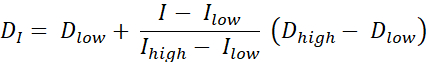 Экв. 1
Экв. 1
Поскольку существует некоторый скептицизм в отношении обеспечения качества DPBN RT, осаждение дозы должно быть проверено с помощью доклинических и клинических исследований10. Тем не менее, только ограниченные данные могут быть получены из клинических испытаний, и было высказано предположение, что больше информации может быть получено путем уменьшения масштаба до лабораторных животных11,12. Следовательно, доклинические исследования с использованием прецизионных исследовательских платформ излучения с визуальным контролем, которые позволяют сочетаться с некоторыми очень специфическими методами, такими как ауторадиография, подходят для изучения открытых вопросов и прокладывания пути к персонализированной медицине и новым стратегиям лечения, таким как покраска доз RT13,14. Однако интерпретация доклинических данных должна выполняться с осторожностью, а недостатки этих доклинических установок должны быть рассмотрены14.
Системы микроизлучения, такие как Платформа радиационных исследований мелких животных (SARRP), оснащены технологиями, аналогичными их клиническому аналогу. Они включают в себя бортовую конусно-лучевую КТ (КЛКТ), доклиническую систему планирования лечения (PCTPS) и обеспечивают субмиллиметровую точность. Расчеты клинической дозы выполняются путем обратного планирования лечения, в результате чего инициируется с желаемого распределения дозы определение лучей с помощью итеративного алгоритма. Доклинические облучатели часто используют перспективное планирование. При перспективном планировании выбирается необходимое количество и угол луча, а затем PCTPS рассчитывает распределение дозы. Оптимизация планов выполняется методом ручной итерации, что является трудоемким15.
После 2009 года новые разработки сделали возможной реализацию обратного планирования на этих исследовательских платформах16,17,18. Для увеличения сходства с клиническим методом был разработан моторизованный переменный прямоугольный коллиматор (MVC) в качестве доклинического аналога многолистного коллиматора. Метод двумерной дозовой окраски с использованием переменного коллиматора был опубликован Cho et al.19. Эта исследовательская группа внедрила трехмерный (3D) обратный протокол планирования лечения на микрооблучателе и определила минимальные и максимальные дозы для целевого объема и максимальную дозу для органов риска. Эти методы в основном оценивались in silico, и их доклинические применения должны быть изучены.
В этой статье представлено исследование in silico для сравнения двух методологий для [18F]-фтор-этил-L-тирозина ([18F]FET) пэт-покраски дозы на основе ПЭТ в модели крыс GB20,21,22 с использованием платформы исследования радиации на малых животных. Этими двумя методологиями являются (1) увеличение подобъёма с использованием предопределенных размеров пучка и (2) окраска дозы с использованием моторизованного переменного коллиматора, где размеры челюсти изменяются в зависимости от поглощения ПЭТ-индикатора в объеме опухоли. [18Ф] FET является ПЭТ-индикатором, часто используемым в нейроонкологии из-за его способности обнаруживать опухоли головного мозга23. [18Ф] FET представляет собой искусственную аминокислоту, которая интернализуется в опухолевые клетки, но не включается в клеточные белки. [18Ф] Поглощение FET соответствует скорости пролиферации клеток, плотности опухолевых клеток и ангиогенезу24. Поскольку это наиболее часто используемый онкологический ПЭТ-индикатор мозга в институте этих авторов, этот радиоиндикатор был выбран для оценки нового рабочего процесса.
Protocol
Representative Results
Discussion
Ранее была описана модель ГБ крысы для имитации химиолучевого лечения в клинике для пациентов с глиобластомой20. Подобно клиническому методу, КТ и МРТ были объединены в процессе планирования лечения для получения более точного облучения. Мультимодальная кровать для миним?…
Declarações
The authors have nothing to disclose.
Acknowledgements
Авторы хотели бы поблагодарить Фонд Lux Luka за поддержку этой работы.
Materials
| Cell culture | |||
| F98 Glioblastoma Cell Line | ATCC | CRL-2397 | https://www.lgcstandards-atcc.org/products/all/CRL-2397 |
| Dulbeco's Modified Eagle Medium | Thermo Fisher Scientific | 22320-030 | |
| Cell culture flasks | Thermo Fisher Scientific | 178883 | 75 cm² |
| FBS | Thermo Fisher Scientific | 10270106 | |
| L-Glutamine | Thermo Fisher Scientific | 25030-032 | 200 mM |
| Penicilline-Streptomycin | Thermo Fisher Scientific | 15140-148 | 10,000 U/mL |
| Phosphate-Buffered Saline (PBS) | Thermo Fisher Scientific | 14040-224 | |
| Trypsin-EDTA | Thermo Fisher Scientific | 25300-062 | 0.05% |
| GB Rat Model | |||
| Ball-shaped burr | Foredom | A-228 | 1.8 mm |
| Bone Wax | Aesculap | 1029754 | https://www.aesculapusa.com/en/healthcare-professionals/or-solutions/or-solutions-cranial-closure/hemostatic-bone-wax.html |
| Ethilon | Ethicon | 662G/662H | FS-2, 4-0, 3/8, 19 mm |
| Fischer F344/Ico crl Rats | Charles River | – | |
| Insulin Syringe Microfine | Beckton-Dickinson | 320924 | 1 mL, 29 G |
| IR Lamp | Philips | HP3616/01 | |
| Meloxicam (Metacam) | Boehringer Ingelheim | – | 2 mg/mL |
| Micromotor rotary tool | Foredom | K.1090-22 | |
| Micropump system | Stoelting Co. | 53312 | Stoelting Stereotaxic Injector |
| Stereotactic frame | Stoelting Co. | 51600 | |
| Xylocaine (1%, with adrenaline 1:200,000) | Aspen | – | 1%, with adrenaline 1:200,000 |
| Xylocaine gel (2%) | Aspen | – | 2% |
| Animal Irradiation | |||
| Micro-irradiator | X-Strahl | SARRP | Version 4.2.0 |
| Software | X-Strahl | Muriplan | Preclinical treatment planning system (PCTPC), version 2.2.2 |
| Small Animal PET | |||
| [18F]FET | Inhouse made | – | PET tracer; along with Prohance: MRI/PET agent |
| Micro-PET | Molecubes | Beta-Cube | https://www.molecubes.com/b-cube/ |
| Small Animal MRI | |||
| Micro-MRI | Bruker Biospin | Pharmascan 70/16 | https://www.bruker.com/products/mr/preclinical-mri/pharmascan.html |
| 30 G Needle for IV injection | Beckton-Dickinson | 305128 | |
| PE 10 Tubing | Instech Laboratories Inc | BTPE-10 | BTPE-10, polyethylene tubing 0.011 x 0.024 in (0.28 x 60 mm), non sterile, 30 m (98 ft) spool, Instech laboratories, Inc Plymouth meeting PA USA- (800) 443-4227- http://www.instechlabs.com |
| Prohance contrast agent | Bracco Imaging | – | 279.3 mg/mL, gadolinium-contrast agent (along with [18F]FET: MRI/PET agent) |
| Tx/Rx Rat Brain – Mouse Whole Body Volumecoil | Bruker Biospin | – | 40 mm diameter |
| Water-based Heating Unit | Bruker Biospin | MT0125 | |
| Consumables | |||
| Isoflurane | Zoetis | B506 | Anesthesia |
| Insulin Syringe Microfine | Beckton-Dickinson | 320924 | 1 mL, 29 G |
| Image Analysis | |||
| MATLAB | Mathworks | – | Version R2019b |
| PMOD | PMOD technologies LLC | Preclinical and molecular imaging software |
Referências
- Louis, D. N., et al. The 2016 World Health Organization classification of tumors of the central nervous system: a summary. Acta Neuropathologica. 131 (6), 803-820 (2016).
- Wadajkar, A. S., et al. Tumor-targeted nanotherapeutics: Overcoming treatment barriers for glioblastoma. Wiley Interdisciplinary Reviews. Nanomedicine & Nanobiotechnology. 9 (4), (2016).
- Lim, M., Xia, Y., Bettegowda, C., Weller, M. Current state of immunotherapy for glioblastoma. Nature Reviews. Clinical Oncology. 15 (7), 422 (2018).
- McGranahan, T., Li, G., Nagpal, S. History and current state of immunotherapy in glioma and brain metastasis. Therapeutic Advances in Medical Oncology. 9 (5), 347-368 (2017).
- Stupp, R., et al. Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma. The New England Journal of Medicine. 352 (10), 987-996 (2005).
- Von Neubeck, C., Seidlitz, A., Kitzler, H. H., Beuthien-Baumann, B., Krause, M. Glioblastoma multiforme: Emerging treatments and stratification markers beyond new drugs. The British Journal of Radiology. 88 (1053), 20150354 (2015).
- Mann, J., Ramakrishna, R., Magge, R., Wernicke, A. G. Advances in radiotherapy for glioblastoma. Frontiers in Neurology. 8, 748 (2018).
- Ling, C. C., et al. Towards multidimensional radiotherapy (MD-CRT): Biological imaging and biological conformality. International Journal of Radiation Oncolology, Biology, Physics. 47 (3), 551-560 (2000).
- Bentzen, S. M., Gregoire, V. Molecular imaging-based dose painting: a novel paradigm for radiation therapy prescription. Seminars in Radiation Oncology. 21 (2), 101-110 (2011).
- Bentzen, S. M. Theragnostic imaging for radiation oncology: Dose-painting by numbers. The Lancet. Oncology. 6 (2), 112-117 (2005).
- Wong, J., et al. High-resolution, small animal radiation research platform with X-ray tomographic guidance capabilities. International Journal of Radiation Oncolology, Biology, Physics. 71 (5), 1591-1599 (2008).
- Van Hoof, S. J., Granton, P. V., Verhaegen, F. Development and validation of a treatment planning system for small animal radiotherapy: SmART-Plan. Radiotherapy and Oncology. 109 (3), 361-366 (2013).
- Verhaegen, F., Granton, P., Tryggestad, E. Small animal radiotherapy research platforms. Physics in Medicine & Biology. 56 (12), 55-83 (2011).
- Butterworth, K. T., Prise, K. M., Verhaegen, F. Small animal image-guided radiotherapy: Status, considerations and potential for translational impact. The British Journal of Radiology. 88 (1045), 20140634 (2015).
- Nasr, A., Habash, A. Dosimetric analytic comparison of inverse and forward planned IMRT techniques in the treatment of head and neck cancer. Journal of the Egyptian National Cancer Institute. 26 (3), 119-125 (2014).
- Matinfar, M., Iyer, S., Ford, E., Wong, J., Kazanzides, P. Image guided complex dose delivery for small animal radiotherapy. IEEE International Symposium on Biomedical Imaging: From Nano to Macro. , 1243-1246 (2009).
- Matinfar, M., Iordachita, I., Wong, J., Kazanzides, P. Robotic delivery of complex radiation volumes for small animal research. IEEE International Conference on Robotics and Automation. , 2056-2061 (2010).
- Balvert, M., et al. A framework for inverse planning of beam-on times for 3D small animal radiotherapy using interactive multi-objective optimisation. Physics in Medicine & Biology. 60 (14), 5681-5698 (2015).
- Cho, N. B., Wong, J., Kazanzides, P. Dose Painting with a Variable Collimator for the Small Animal Radiation Research Platform (SARRP). The Midas Journal. , 1-8 (2014).
- Bolcaen, J., et al. MRI-guided 3D conformal arc micro-irradiation of a F98 glioblastoma rat model using the Small Animal Radiation Research Platform (SARRP). Journal of Neuro-oncology. 120 (2), 257-266 (2014).
- Bolcaen, J., Descamps, B., Boterberg, T., Vanhove, C., Goethals, I. PET and MRI guided irradiation of a glioblastoma rat model using a micro-irradiator. Journal of Visualized Experiments: JoVE. (130), e56601 (2017).
- Verhoeven, J., et al. Technical feasibility of [18F]FET and [18F]FAZA PET guided radiotherapy in a F98 glioblastoma rat model. Radiation Oncology. 14 (1), 89 (2019).
- Hutterer, M., et al. FET PET: a valuable diagnostic tool in neuro-oncology, but not all that glitters is glioma. Neuro-oncology. 15 (3), 341-351 (2013).
- Stockhammer, F., Plotkin, M., Amthauer, H., Landeghem, F. K. H., Woiciechowsky, C. Correlation of F-18-fluoro-ethyl-tyrosin uptake with vascular and cell density in non-contrast-enhancing gliomas. Journal of Neuro-oncology. 88 (2), 205-210 (2008).
- . Mricron dicom to nifti converter. neuroimaging informatics tools and resources clearinghouse (nitrc) Available from: https://www.nitrc.org/projects/mricron (2015)
- . SPM12 Manual Available from: https://www.fil.ion.ucl.ac.uk/spm/doc/spm12_manual.pdf (2014)
- España, S., Marcinkowski, R., Keereman, V., Vandenberghe, S., Van Holen, R. DigiPET: Sub-millimeter spatial resolution small-animal PET imaging using thin monolithic scintillators. Physics in Medicine & Biology. 59 (13), 3405-3420 (2014).

