Positronemissie Tomografie-gebaseerde dosis schilderen Bestralingstherapie in een glioblastoom rat model met behulp van het Small Animal Radiation Research Platform
Summary
Hier presenteren we een protocol om preklinische positronemissietomografie-gebaseerde radiotherapie uit te voeren in een rattenglioblastoommodel met behulp van algoritmen die intern zijn ontwikkeld om de nauwkeurigheid en efficiëntie te optimaliseren.
Abstract
Een rattenglioblastoommodel om chemo-bestraling van menselijk glioblastoom in de kliniek na te bootsen, werd eerder vastgesteld. Net als bij de klinische behandeling werden computertomografie (CT) en magnetische resonantiebeeldvorming (MRI) gecombineerd tijdens het behandelingsplanningsproces. Positron emissie tomografie (PET) beeldvorming werd vervolgens toegevoegd om sub-volume boost te implementeren met behulp van een micro-bestralingssysteem. Het combineren van drie beeldvormingsmodaliteiten (CT, MRI en PET) met behulp van een microbestralingssysteem bleek echter arbeidsintensief te zijn omdat multimodale beeldvorming, behandelingsplanning en dosisafgifte achtereenvolgens moeten worden voltooid in de preklinische setting. Dit resulteert ook in een workflow die meer vatbaar is voor menselijke fouten. Daarom werd een gebruiksvriendelijk algoritme geïmplementeerd om de preklinische multimodale beeldvormingsgebaseerde bestralingsplanning verder te optimaliseren. Deze softwaretool werd gebruikt om de nauwkeurigheid en efficiëntie van dosisschilderende bestralingstherapie met micro-bestraling te evalueren met behulp van een in silico-studieontwerp . De nieuwe methodologie voor dosisschilderende bestralingstherapie is superieur aan de eerder beschreven methode in termen van nauwkeurigheid, tijdsefficiëntie en intra- en inter-user variabiliteit. Het is ook een belangrijke stap in de richting van de implementatie van omgekeerde behandelingsplanning op micro-bestralingstoestellen, waar voorwaartse planning nog steeds vaak wordt gebruikt, in tegenstelling tot klinische systemen.
Introduction
Glioblastoom (GB) is een kwaadaardige en zeer agressieve primaire hersentumor. GB is een solide heterogene tumor die meestal wordt gekenmerkt door infiltratieve grenzen, nucleaire atypie en necrose1. De aanwezigheid van de bloed-hersenbarrière en de status van de hersenen als immuun-bevoorrechte site maakt de ontdekking van nieuwe doelwitten voor chemo- en immunotherapie een ontmoedigende taak2,3,4. Het is opmerkelijk dat de behandeling van GB-patiënten nauwelijks is veranderd sinds de introductie, in 2005, van het Stupp-protocol dat externe bestralingstherapie (RT) combineert met gelijktijdig temozolomide, meestal gevolgd door adjuvante temozolomide5. Meestal wordt het Stupp-protocol voorafgegaan door maximale chirurgische resectie. Daarom zijn alternatieve behandelingsbenaderingen van cruciaal belang.
De huidige bestralingstherapie voor glioblastoompatiënten levert een uniforme stralingsdosis aan het gedefinieerde tumorvolume. In de radiotherapie-oncologie is er een belangrijke dosis-responscorrelatie voor glioblastoom met toenemende dosis, die rond 60 Gy lijkt te liggen, als gevolg van verhoogde toxiciteit voor de normale hersenen6,7. Tumoren kunnen echter zeer (radiobiologisch) heterogeen zijn, met gradiënten van zuurstofgehalte en/of grote verschillen in cellulaire dichtheid. Metabole beeldvormingstechnieken, zoals PET, kunnen deze biologische kenmerken visualiseren en kunnen worden gebruikt om het dosisvoorschrift aan te passen. Deze aanpak staat bekend als dose painting RT. Deze term werd geïntroduceerd door Ling et al. in 2000. De auteurs definieerden dosisschildering RT als het produceren van “prachtig conforme dosisverdelingen binnen de beperkingen van stralingsvoortplanting en -verstrooiing”8.
Er zijn twee soorten dosisschildering RT, dosisschildering door contouren (DPBC), waarbij een dosis wordt voorgeschreven aan een set geneste subvolumes, en dosisschildering door getallen (DPBN), waarbij een dosis wordt voorgeschreven op voxelniveau. De dosisverdeling voor DPBN RT kan worden geëxtraheerd uit functionele beelden. De dosis in elke voxel wordt bepaald door de intensiteit I van de overeenkomstige voxel in het beeld, met een onder- en bovengrens, om ervoor te zorgen dat aan de ene kant een voldoende dosis wordt toegediend aan elk deel van de tumor. Aan de andere kant overschrijden doses een bovengrens niet om risicoorganen te beschermen en toxiciteit te voorkomen. De meest eenvoudige methode is een lineaire interpolatie (zie Eq. 1) tussen de minimale dosis Dmin en de maximale dosis Dmax, proportioneel variërend tussen de minimale intensiteit Imax en de maximale intensiteit binnen het streefvolume9,10
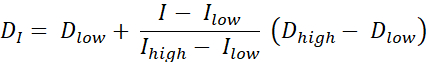 Eq. 1
Eq. 1
Omdat er enige scepsis bestaat over de kwaliteitsborging van DPBN RT, moet de afzetting van de dosis worden geverifieerd door preklinisch en klinisch onderzoek10. Er kunnen echter slechts beperkte gegevens worden verkregen uit klinische onderzoeken en er is verondersteld dat meer inzichten kunnen worden verkregen door af te schalen naar proefdieren11,12. Vandaar dat preklinische studies met behulp van precisiebeeldgeleide stralingsonderzoeksplatforms die koppeling met enkele zeer specifieke technieken mogelijk maken, zoals autoradiografie, geschikt zijn voor het onderzoeken van open problemen en het effenen van de weg naar gepersonaliseerde geneeskunde en nieuwe behandelingsstrategieën, zoals dosisschilderen RT13,14. De interpretatie van preklinische gegevens moet echter met de nodige voorzichtigheid worden uitgevoerd en de nadelen van deze preklinische opstellingen moeten worden overwogen14.
Microbestralingssystemen, zoals het Small Animal Radiation Research Platform (SARRP), zijn uitgerust met vergelijkbare technologieën als hun klinische tegenhanger. Ze omvatten on-board cone-beam CT (CBCT) beeldvorming, een preklinisch behandelingsplanningssysteem (PCTPS) en bieden sub-millimeter precisie. Klinische dosisberekeningen worden uitgevoerd door middel van inverse behandelingsplanning, waarbij men vanuit de gewenste dosisverdeling de bundels bepaalt via een iteratief algoritme. Preklinische bestralingen maken vaak gebruik van voorwaartse planning. Bij de toekomstplanning worden de vereiste hoeveelheid en hoek van de bundels geselecteerd en de PCTPS berekent vervolgens de dosisverdeling. De optimalisatie van de plannen wordt uitgevoerd door handmatige iteratie, die arbeidsintensief is15.
Na 2009 hebben nieuwe ontwikkelingen de implementatie van inverse planning op deze onderzoeksplatforms mogelijk gemaakt16,17,18. Om de gelijkenis met de klinische methode te vergroten, werd een gemotoriseerde variabele rechthoekige collimator (MVC) ontwikkeld als een preklinische tegenhanger van de meerbladige collimator. Een tweedimensionale dosisschildermethode met behulp van een variabele collimator werd gepubliceerd door Cho et al.19. Deze onderzoeksgroep implementeerde een driedimensionaal (3D) invers behandelingsplanningsprotocol op een micro-bestralingsapparaat en bepaalde minimale en maximale doses voor het doelvolume en een maximale dosis voor de risicoorganen. Deze technieken zijn voornamelijk geëvalueerd in silico en hun preklinische toepassingen moeten worden onderzocht.
Dit artikel presenteert een in silico studie om twee methodologieën te vergelijken voor [18F]-fluoro-ethyl-L-tyrosine ([18F]FET) PET-gebaseerde dosisschildering in een GB rat model20,21,22 met behulp van een klein dierlijk stralingsonderzoeksplatform. Deze twee methodologieën zijn (1) subvolumeverhoging met behulp van vooraf gedefinieerde bundelgroottes en (2) dosisschildering met behulp van een gemotoriseerde variabele collimator waarbij kaakafmetingen worden gewijzigd op basis van de PET-traceropname in het tumorvolume. [18F] FET is een PET-tracer die vaak wordt gebruikt in de neuro-oncologie vanwege het vermogen om hersentumoren te detecteren23. [18F] FET is een kunstmatig aminozuur dat wordt geïnternaliseerd in tumorcellen, maar niet wordt opgenomen in celeiwitten. [18F] FET-opname komt overeen met celproliferatiesnelheid, tumorceldichtheid en angiogenese24. Omdat dit de meest gebruikte oncologische brain PET tracer is in het instituut van deze auteurs, werd deze radiotracer gekozen om de nieuwe workflow te evalueren.
Protocol
Representative Results
Discussion
Een rat GB-model om de chemo-bestralingsbehandeling in de kliniek voor glioblastoompatiënten na te bootsen, werd eerder beschreven20. Net als bij de klinische methode werden CT en MRI gecombineerd tijdens het behandelingsplanningsproces om een nauwkeurigere bestraling te verkrijgen. Een multimodaliteitsbed om (hoofd)beweging te minimaliseren werd gebruikt wanneer het dier van het ene beeldvormingssysteem naar het andere werd verplaatst. Vervolgens werd PET-beeldvorming toegevoegd aan het behandel…
Declarações
The authors have nothing to disclose.
Acknowledgements
De auteurs willen Stichting Lux Luka bedanken voor het ondersteunen van dit werk.
Materials
| Cell culture | |||
| F98 Glioblastoma Cell Line | ATCC | CRL-2397 | https://www.lgcstandards-atcc.org/products/all/CRL-2397 |
| Dulbeco's Modified Eagle Medium | Thermo Fisher Scientific | 22320-030 | |
| Cell culture flasks | Thermo Fisher Scientific | 178883 | 75 cm² |
| FBS | Thermo Fisher Scientific | 10270106 | |
| L-Glutamine | Thermo Fisher Scientific | 25030-032 | 200 mM |
| Penicilline-Streptomycin | Thermo Fisher Scientific | 15140-148 | 10,000 U/mL |
| Phosphate-Buffered Saline (PBS) | Thermo Fisher Scientific | 14040-224 | |
| Trypsin-EDTA | Thermo Fisher Scientific | 25300-062 | 0.05% |
| GB Rat Model | |||
| Ball-shaped burr | Foredom | A-228 | 1.8 mm |
| Bone Wax | Aesculap | 1029754 | https://www.aesculapusa.com/en/healthcare-professionals/or-solutions/or-solutions-cranial-closure/hemostatic-bone-wax.html |
| Ethilon | Ethicon | 662G/662H | FS-2, 4-0, 3/8, 19 mm |
| Fischer F344/Ico crl Rats | Charles River | – | |
| Insulin Syringe Microfine | Beckton-Dickinson | 320924 | 1 mL, 29 G |
| IR Lamp | Philips | HP3616/01 | |
| Meloxicam (Metacam) | Boehringer Ingelheim | – | 2 mg/mL |
| Micromotor rotary tool | Foredom | K.1090-22 | |
| Micropump system | Stoelting Co. | 53312 | Stoelting Stereotaxic Injector |
| Stereotactic frame | Stoelting Co. | 51600 | |
| Xylocaine (1%, with adrenaline 1:200,000) | Aspen | – | 1%, with adrenaline 1:200,000 |
| Xylocaine gel (2%) | Aspen | – | 2% |
| Animal Irradiation | |||
| Micro-irradiator | X-Strahl | SARRP | Version 4.2.0 |
| Software | X-Strahl | Muriplan | Preclinical treatment planning system (PCTPC), version 2.2.2 |
| Small Animal PET | |||
| [18F]FET | Inhouse made | – | PET tracer; along with Prohance: MRI/PET agent |
| Micro-PET | Molecubes | Beta-Cube | https://www.molecubes.com/b-cube/ |
| Small Animal MRI | |||
| Micro-MRI | Bruker Biospin | Pharmascan 70/16 | https://www.bruker.com/products/mr/preclinical-mri/pharmascan.html |
| 30 G Needle for IV injection | Beckton-Dickinson | 305128 | |
| PE 10 Tubing | Instech Laboratories Inc | BTPE-10 | BTPE-10, polyethylene tubing 0.011 x 0.024 in (0.28 x 60 mm), non sterile, 30 m (98 ft) spool, Instech laboratories, Inc Plymouth meeting PA USA- (800) 443-4227- http://www.instechlabs.com |
| Prohance contrast agent | Bracco Imaging | – | 279.3 mg/mL, gadolinium-contrast agent (along with [18F]FET: MRI/PET agent) |
| Tx/Rx Rat Brain – Mouse Whole Body Volumecoil | Bruker Biospin | – | 40 mm diameter |
| Water-based Heating Unit | Bruker Biospin | MT0125 | |
| Consumables | |||
| Isoflurane | Zoetis | B506 | Anesthesia |
| Insulin Syringe Microfine | Beckton-Dickinson | 320924 | 1 mL, 29 G |
| Image Analysis | |||
| MATLAB | Mathworks | – | Version R2019b |
| PMOD | PMOD technologies LLC | Preclinical and molecular imaging software |
Referências
- Louis, D. N., et al. The 2016 World Health Organization classification of tumors of the central nervous system: a summary. Acta Neuropathologica. 131 (6), 803-820 (2016).
- Wadajkar, A. S., et al. Tumor-targeted nanotherapeutics: Overcoming treatment barriers for glioblastoma. Wiley Interdisciplinary Reviews. Nanomedicine & Nanobiotechnology. 9 (4), (2016).
- Lim, M., Xia, Y., Bettegowda, C., Weller, M. Current state of immunotherapy for glioblastoma. Nature Reviews. Clinical Oncology. 15 (7), 422 (2018).
- McGranahan, T., Li, G., Nagpal, S. History and current state of immunotherapy in glioma and brain metastasis. Therapeutic Advances in Medical Oncology. 9 (5), 347-368 (2017).
- Stupp, R., et al. Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma. The New England Journal of Medicine. 352 (10), 987-996 (2005).
- Von Neubeck, C., Seidlitz, A., Kitzler, H. H., Beuthien-Baumann, B., Krause, M. Glioblastoma multiforme: Emerging treatments and stratification markers beyond new drugs. The British Journal of Radiology. 88 (1053), 20150354 (2015).
- Mann, J., Ramakrishna, R., Magge, R., Wernicke, A. G. Advances in radiotherapy for glioblastoma. Frontiers in Neurology. 8, 748 (2018).
- Ling, C. C., et al. Towards multidimensional radiotherapy (MD-CRT): Biological imaging and biological conformality. International Journal of Radiation Oncolology, Biology, Physics. 47 (3), 551-560 (2000).
- Bentzen, S. M., Gregoire, V. Molecular imaging-based dose painting: a novel paradigm for radiation therapy prescription. Seminars in Radiation Oncology. 21 (2), 101-110 (2011).
- Bentzen, S. M. Theragnostic imaging for radiation oncology: Dose-painting by numbers. The Lancet. Oncology. 6 (2), 112-117 (2005).
- Wong, J., et al. High-resolution, small animal radiation research platform with X-ray tomographic guidance capabilities. International Journal of Radiation Oncolology, Biology, Physics. 71 (5), 1591-1599 (2008).
- Van Hoof, S. J., Granton, P. V., Verhaegen, F. Development and validation of a treatment planning system for small animal radiotherapy: SmART-Plan. Radiotherapy and Oncology. 109 (3), 361-366 (2013).
- Verhaegen, F., Granton, P., Tryggestad, E. Small animal radiotherapy research platforms. Physics in Medicine & Biology. 56 (12), 55-83 (2011).
- Butterworth, K. T., Prise, K. M., Verhaegen, F. Small animal image-guided radiotherapy: Status, considerations and potential for translational impact. The British Journal of Radiology. 88 (1045), 20140634 (2015).
- Nasr, A., Habash, A. Dosimetric analytic comparison of inverse and forward planned IMRT techniques in the treatment of head and neck cancer. Journal of the Egyptian National Cancer Institute. 26 (3), 119-125 (2014).
- Matinfar, M., Iyer, S., Ford, E., Wong, J., Kazanzides, P. Image guided complex dose delivery for small animal radiotherapy. IEEE International Symposium on Biomedical Imaging: From Nano to Macro. , 1243-1246 (2009).
- Matinfar, M., Iordachita, I., Wong, J., Kazanzides, P. Robotic delivery of complex radiation volumes for small animal research. IEEE International Conference on Robotics and Automation. , 2056-2061 (2010).
- Balvert, M., et al. A framework for inverse planning of beam-on times for 3D small animal radiotherapy using interactive multi-objective optimisation. Physics in Medicine & Biology. 60 (14), 5681-5698 (2015).
- Cho, N. B., Wong, J., Kazanzides, P. Dose Painting with a Variable Collimator for the Small Animal Radiation Research Platform (SARRP). The Midas Journal. , 1-8 (2014).
- Bolcaen, J., et al. MRI-guided 3D conformal arc micro-irradiation of a F98 glioblastoma rat model using the Small Animal Radiation Research Platform (SARRP). Journal of Neuro-oncology. 120 (2), 257-266 (2014).
- Bolcaen, J., Descamps, B., Boterberg, T., Vanhove, C., Goethals, I. PET and MRI guided irradiation of a glioblastoma rat model using a micro-irradiator. Journal of Visualized Experiments: JoVE. (130), e56601 (2017).
- Verhoeven, J., et al. Technical feasibility of [18F]FET and [18F]FAZA PET guided radiotherapy in a F98 glioblastoma rat model. Radiation Oncology. 14 (1), 89 (2019).
- Hutterer, M., et al. FET PET: a valuable diagnostic tool in neuro-oncology, but not all that glitters is glioma. Neuro-oncology. 15 (3), 341-351 (2013).
- Stockhammer, F., Plotkin, M., Amthauer, H., Landeghem, F. K. H., Woiciechowsky, C. Correlation of F-18-fluoro-ethyl-tyrosin uptake with vascular and cell density in non-contrast-enhancing gliomas. Journal of Neuro-oncology. 88 (2), 205-210 (2008).
- . Mricron dicom to nifti converter. neuroimaging informatics tools and resources clearinghouse (nitrc) Available from: https://www.nitrc.org/projects/mricron (2015)
- . SPM12 Manual Available from: https://www.fil.ion.ucl.ac.uk/spm/doc/spm12_manual.pdf (2014)
- España, S., Marcinkowski, R., Keereman, V., Vandenberghe, S., Van Holen, R. DigiPET: Sub-millimeter spatial resolution small-animal PET imaging using thin monolithic scintillators. Physics in Medicine & Biology. 59 (13), 3405-3420 (2014).

