العلاج الإشعاعي القائم على التصوير الإشعاعي بجرعة التصوير المقطعي القائم على البوزيترون في نموذج الفئران الورم الأرومي الدبقي باستخدام منصة أبحاث الإشعاع الحيواني الصغير
Summary
نقدم هنا بروتوكولا لإجراء العلاج الإشعاعي القائم على التصوير الإشعاعي القائم على التصوير المقطعي بالإصدار البوزيتروني قبل السريري في نموذج الورم الأرومي الدبقي للفئران باستخدام خوارزميات تم تطويرها داخليا لتحسين الدقة والكفاءة.
Abstract
تم إنشاء نموذج الورم الأرومي الدبقي للفئران لمحاكاة العلاج الكيميائي الإشعاعي للورم الأرومي الدبقي البشري في العيادة. على غرار العلاج السريري ، تم الجمع بين التصوير المقطعي المحوسب (CT) والتصوير بالرنين المغناطيسي (MRI) أثناء عملية تخطيط العلاج. تمت إضافة التصوير المقطعي بالإصدار البوزيتروني (PET) لاحقا لتنفيذ تعزيز الحجم الفرعي باستخدام نظام تشعيع صغير. ومع ذلك ، فإن الجمع بين ثلاث طرق تصوير (التصوير المقطعي المحوسب والتصوير بالرنين المغناطيسي والتصوير المقطعي بالإصدار البوزيتروني ) باستخدام نظام التشعيع الجزئي أثبت أنه كثيف العمالة لأن التصوير متعدد الوسائط وتخطيط العلاج وتسليم الجرعة يجب أن يكتمل بالتتابع في الإعداد قبل السريري. ينتج عن ذلك أيضا سير عمل أكثر عرضة للخطأ البشري. لذلك ، تم تنفيذ خوارزمية سهلة الاستخدام لزيادة تحسين تخطيط العلاج الإشعاعي القائم على التصوير الإشعاعي قبل السريري متعدد الوسائط. تم استخدام هذه الأداة البرمجية لتقييم دقة وكفاءة العلاج الإشعاعي بالطلاء بالجرعة باستخدام التشعيع الجزئي باستخدام تصميم دراسة في سيليكو . تتفوق المنهجية الجديدة للعلاج الإشعاعي بالطلاء بالجرعة على الطريقة الموصوفة سابقا من حيث الدقة وكفاءة الوقت والتباين داخل المستخدمين وفيما بينهم. كما أنها خطوة مهمة نحو تنفيذ تخطيط العلاج العكسي على أجهزة التشعيع الدقيقة، حيث لا يزال التخطيط المستقبلي شائعا، على عكس النظم السريرية.
Introduction
الورم الأرومي الدبقي (GB) هو ورم دماغي أولي خبيث وعدواني للغاية. GB هو ورم صلب غير متجانس يتميز عادة بحدود التسلل ، وعدم النمط النووي ، والنخر 1. إن وجود الحاجز الدموي الدماغي ووضع الدماغ كموقع متميز بالمناعة يجعل اكتشاف أهداف جديدة للعلاج الكيميائي والمناعي مهمة شاقة2،3،4. من الجدير بالذكر أن علاج مرضى GB بالكاد تغير منذ إدخال بروتوكول Stupp في عام 2005 الذي يجمع بين العلاج الإشعاعي بالحزمة الخارجية (RT) و temozolomide المصاحب ، والذي يتبعه عادة temozolomide5 المساعد. عادة ، يسبق بروتوكول Stupp استئصال جراحي أقصى. لذلك ، فإن نهج العلاج البديلة ذات أهمية محورية.
يقدم العلاج الإشعاعي الحالي لمرضى الورم الأرومي الدبقي جرعة إشعاعية موحدة لحجم الورم المحدد. في علم الأورام الإشعاعي ، هناك علاقة مهمة بين الجرعة والاستجابة للورم الأرومي الدبقي مع زيادة الجرعة ، والتي يبدو أنها تبلغ حوالي 60 Gy ، بسبب زيادة السمية للدماغ الطبيعي6,7. ومع ذلك ، يمكن أن تكون الأورام غير متجانسة للغاية (إشعاعيا) ، مع تدرجات مستوى الأكسجين و / أو اختلافات كبيرة في الكثافة الخلوية. يمكن لتقنيات التصوير الأيضي ، مثل PET ، تصور هذه الميزات البيولوجية ويمكن استخدامها لتخصيص وصفة الجرعة. يعرف هذا النهج باسم جرعة الطلاء RT. تم إدخال هذا المصطلح من قبل Ling et al. في عام 2000. عرف المؤلفون لوحة الجرعة RT بأنها تنتج “توزيعات جرعات مطابقة بشكل رائع ضمن قيود انتشار الإشعاع وتشتته”8.
هناك نوعان من الطلاء بالجرعة RT ، رسم الجرعة حسب الخطوط (DPBC) ، والتي يتم من خلالها وصف جرعة لمجموعة من المجلدات الفرعية المتداخلة ، ورسم الجرعة بالأرقام (DPBN) ، حيث يتم وصف جرعة على مستوى voxel. يمكن استخراج توزيع الجرعة ل DPBN RT من الصور الوظيفية. يتم تحديد الجرعة في كل فوكسل من خلال شدة I من voxel المقابلة في الصورة ، مع حد أدنى وأعلى ، للتأكد من أنه ، من ناحية ، يتم تسليم جرعة كافية إلى كل جزء من الورم. من ناحية أخرى ، لا تتجاوز الجرعات الحد الأعلى لحماية الأعضاء المعرضة للخطر وتجنب السمية. الطريقة الأكثر وضوحا هي الاستيفاء الخطي (انظر Eq. 1) بين الحد الأدنى للجرعة Dmin والحد الأقصى للجرعة Dmax ، وتختلف نسبيا بين الحد الأدنى للكثافة Imax والحد الأقصى للكثافة داخل الحجم المستهدف9,10
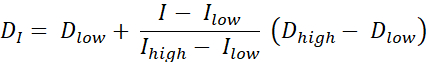 مكافئ 1
مكافئ 1
نظرا لوجود بعض الشكوك حول ضمان جودة DPBN RT ، يجب التحقق من ترسب الجرعة من خلال الأبحاث قبل السريرية والسريرية10. ومع ذلك، لا يمكن الحصول إلا على بيانات محدودة من التجارب السريرية، وقد افترض أنه يمكن الحصول على المزيد من الأفكار عن طريق تقليص حجم الحيوانات المختبرية11،12. وبالتالي ، فإن الدراسات قبل السريرية التي تستخدم منصات أبحاث إشعاعية دقيقة موجهة بالصور تسمح بالاقتران مع بعض التقنيات المحددة للغاية ، مثل التصوير الشعاعي الذاتي ، مناسبة لدراسة القضايا المفتوحة وتمهيد الطريق نحو الطب الشخصي واستراتيجيات العلاج الجديدة ، مثل طلاء الجرعة RT13,14. ومع ذلك ، يجب إجراء تفسير البيانات قبل السريرية بحذر ، ويجب النظر في عيوب هذه الإعدادات قبل السريرية14.
وقد تم تجهيز أنظمة التشعيع الجزئي، مثل منصة البحوث الإشعاعية الحيوانية الصغيرة (SARRP)، بتكنولوجيات مماثلة لنظيرتها السريرية. وهي تشمل التصوير المقطعي المحوسب على متن الطائرة بالشعاع المخروطي (CBCT) ، ونظام تخطيط العلاج قبل السريري (PCTPS) ، وتوفر دقة دون الملليمتر. يتم إجراء حسابات الجرعة السريرية عن طريق تخطيط العلاج العكسي ، حيث يبدأ المرء من توزيع الجرعة المطلوب لتحديد الحزم عبر خوارزمية تكرارية. غالبا ما تستخدم أجهزة التشعيع قبل السريرية التخطيط المستقبلي. في التخطيط المسبق ، يتم اختيار الكمية والزاوية المطلوبتين للحزم ، ثم تقوم معاهدة التعاون بشأن البراءات بحساب توزيع الجرعة. يتم تنفيذ تحسين الخطط عن طريق التكرار اليدوي ، وهو كثيف العمالة15.
بعد عام 2009 ، جعلت التطورات الجديدة تنفيذ التخطيط العكسي على منصات البحث هذه ممكنا16،17،18. لزيادة التشابه مع الطريقة السريرية ، تم تطوير مصادم مستطيل متغير آلي (MVC) كنظير قبل سريري للمصادم متعدد الأوراق. تم نشر طريقة طلاء الجرعة ثنائية الأبعاد باستخدام مصادم متغير بواسطة Cho et al.19. نفذت هذه المجموعة البحثية بروتوكول تخطيط العلاج العكسي ثلاثي الأبعاد (3D) على جهاز تشعيع دقيق وحددت الحد الأدنى والحد الأقصى للجرعات للحجم المستهدف والجرعة القصوى للأعضاء المعرضة للخطر. تم تقييم هذه التقنيات بشكل رئيسي في سيليكو ، ويجب استكشاف تطبيقاتها قبل السريرية.
تقدم هذه الورقة دراسة في سيليكو لمقارنة منهجيتين ل [18F] – فلورو – إيثيل – L-التيروزين ([18F]FET) على أساس الحيوانات الأليفة الرسم في نموذج الفئران GB 20،21،22 باستخدام منصة أبحاث الإشعاع الحيواني الصغيرة. هاتان المنهجيتان هما (1) تعزيز الحجم الفرعي باستخدام أحجام شعاع محددة مسبقا و (2) طلاء الجرعة باستخدام مصادم متغير بمحرك حيث يتم تعديل أبعاد الفك بناء على امتصاص مقتفي PET في حجم الورم. [18 واو] FET هو متتبع PET يستخدم غالبا في علم الأورام العصبية بسبب قدرته على اكتشاف أورام الدماغ23. [18 واو] FET هو حمض أميني اصطناعي يتم استيعابه في الخلايا الوترية ولكن لا يتم دمجه في بروتينات الخلايا. [18 واو] يتوافق امتصاص FET مع معدل تكاثر الخلايا وكثافة الخلايا السرطانية وتكوين الأوعية24. نظرا لأن هذا هو متتبع PET الدماغي الأكثر استخداما في معهد هؤلاء المؤلفين ، فقد تم اختيار هذا المقتفي الإشعاعي لتقييم سير العمل الجديد.
Protocol
Representative Results
Discussion
تم وصف نموذج الفئران GB لمحاكاة العلاج الكيميائي الإشعاعي في العيادة لمرضى الورم الأرومي الدبقي سابقا20. على غرار الطريقة السريرية ، تم الجمع بين التصوير المقطعي المحوسب والتصوير بالرنين المغناطيسي أثناء عملية تخطيط العلاج للحصول على تشعيع أكثر دقة. تم استخدام سرير متعدد الو?…
Declarações
The authors have nothing to disclose.
Acknowledgements
يود المؤلفون أن يشكروا مؤسسة لوكس لوكا على دعم هذا العمل.
Materials
| Cell culture | |||
| F98 Glioblastoma Cell Line | ATCC | CRL-2397 | https://www.lgcstandards-atcc.org/products/all/CRL-2397 |
| Dulbeco's Modified Eagle Medium | Thermo Fisher Scientific | 22320-030 | |
| Cell culture flasks | Thermo Fisher Scientific | 178883 | 75 cm² |
| FBS | Thermo Fisher Scientific | 10270106 | |
| L-Glutamine | Thermo Fisher Scientific | 25030-032 | 200 mM |
| Penicilline-Streptomycin | Thermo Fisher Scientific | 15140-148 | 10,000 U/mL |
| Phosphate-Buffered Saline (PBS) | Thermo Fisher Scientific | 14040-224 | |
| Trypsin-EDTA | Thermo Fisher Scientific | 25300-062 | 0.05% |
| GB Rat Model | |||
| Ball-shaped burr | Foredom | A-228 | 1.8 mm |
| Bone Wax | Aesculap | 1029754 | https://www.aesculapusa.com/en/healthcare-professionals/or-solutions/or-solutions-cranial-closure/hemostatic-bone-wax.html |
| Ethilon | Ethicon | 662G/662H | FS-2, 4-0, 3/8, 19 mm |
| Fischer F344/Ico crl Rats | Charles River | – | |
| Insulin Syringe Microfine | Beckton-Dickinson | 320924 | 1 mL, 29 G |
| IR Lamp | Philips | HP3616/01 | |
| Meloxicam (Metacam) | Boehringer Ingelheim | – | 2 mg/mL |
| Micromotor rotary tool | Foredom | K.1090-22 | |
| Micropump system | Stoelting Co. | 53312 | Stoelting Stereotaxic Injector |
| Stereotactic frame | Stoelting Co. | 51600 | |
| Xylocaine (1%, with adrenaline 1:200,000) | Aspen | – | 1%, with adrenaline 1:200,000 |
| Xylocaine gel (2%) | Aspen | – | 2% |
| Animal Irradiation | |||
| Micro-irradiator | X-Strahl | SARRP | Version 4.2.0 |
| Software | X-Strahl | Muriplan | Preclinical treatment planning system (PCTPC), version 2.2.2 |
| Small Animal PET | |||
| [18F]FET | Inhouse made | – | PET tracer; along with Prohance: MRI/PET agent |
| Micro-PET | Molecubes | Beta-Cube | https://www.molecubes.com/b-cube/ |
| Small Animal MRI | |||
| Micro-MRI | Bruker Biospin | Pharmascan 70/16 | https://www.bruker.com/products/mr/preclinical-mri/pharmascan.html |
| 30 G Needle for IV injection | Beckton-Dickinson | 305128 | |
| PE 10 Tubing | Instech Laboratories Inc | BTPE-10 | BTPE-10, polyethylene tubing 0.011 x 0.024 in (0.28 x 60 mm), non sterile, 30 m (98 ft) spool, Instech laboratories, Inc Plymouth meeting PA USA- (800) 443-4227- http://www.instechlabs.com |
| Prohance contrast agent | Bracco Imaging | – | 279.3 mg/mL, gadolinium-contrast agent (along with [18F]FET: MRI/PET agent) |
| Tx/Rx Rat Brain – Mouse Whole Body Volumecoil | Bruker Biospin | – | 40 mm diameter |
| Water-based Heating Unit | Bruker Biospin | MT0125 | |
| Consumables | |||
| Isoflurane | Zoetis | B506 | Anesthesia |
| Insulin Syringe Microfine | Beckton-Dickinson | 320924 | 1 mL, 29 G |
| Image Analysis | |||
| MATLAB | Mathworks | – | Version R2019b |
| PMOD | PMOD technologies LLC | Preclinical and molecular imaging software |
Referências
- Louis, D. N., et al. The 2016 World Health Organization classification of tumors of the central nervous system: a summary. Acta Neuropathologica. 131 (6), 803-820 (2016).
- Wadajkar, A. S., et al. Tumor-targeted nanotherapeutics: Overcoming treatment barriers for glioblastoma. Wiley Interdisciplinary Reviews. Nanomedicine & Nanobiotechnology. 9 (4), (2016).
- Lim, M., Xia, Y., Bettegowda, C., Weller, M. Current state of immunotherapy for glioblastoma. Nature Reviews. Clinical Oncology. 15 (7), 422 (2018).
- McGranahan, T., Li, G., Nagpal, S. History and current state of immunotherapy in glioma and brain metastasis. Therapeutic Advances in Medical Oncology. 9 (5), 347-368 (2017).
- Stupp, R., et al. Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma. The New England Journal of Medicine. 352 (10), 987-996 (2005).
- Von Neubeck, C., Seidlitz, A., Kitzler, H. H., Beuthien-Baumann, B., Krause, M. Glioblastoma multiforme: Emerging treatments and stratification markers beyond new drugs. The British Journal of Radiology. 88 (1053), 20150354 (2015).
- Mann, J., Ramakrishna, R., Magge, R., Wernicke, A. G. Advances in radiotherapy for glioblastoma. Frontiers in Neurology. 8, 748 (2018).
- Ling, C. C., et al. Towards multidimensional radiotherapy (MD-CRT): Biological imaging and biological conformality. International Journal of Radiation Oncolology, Biology, Physics. 47 (3), 551-560 (2000).
- Bentzen, S. M., Gregoire, V. Molecular imaging-based dose painting: a novel paradigm for radiation therapy prescription. Seminars in Radiation Oncology. 21 (2), 101-110 (2011).
- Bentzen, S. M. Theragnostic imaging for radiation oncology: Dose-painting by numbers. The Lancet. Oncology. 6 (2), 112-117 (2005).
- Wong, J., et al. High-resolution, small animal radiation research platform with X-ray tomographic guidance capabilities. International Journal of Radiation Oncolology, Biology, Physics. 71 (5), 1591-1599 (2008).
- Van Hoof, S. J., Granton, P. V., Verhaegen, F. Development and validation of a treatment planning system for small animal radiotherapy: SmART-Plan. Radiotherapy and Oncology. 109 (3), 361-366 (2013).
- Verhaegen, F., Granton, P., Tryggestad, E. Small animal radiotherapy research platforms. Physics in Medicine & Biology. 56 (12), 55-83 (2011).
- Butterworth, K. T., Prise, K. M., Verhaegen, F. Small animal image-guided radiotherapy: Status, considerations and potential for translational impact. The British Journal of Radiology. 88 (1045), 20140634 (2015).
- Nasr, A., Habash, A. Dosimetric analytic comparison of inverse and forward planned IMRT techniques in the treatment of head and neck cancer. Journal of the Egyptian National Cancer Institute. 26 (3), 119-125 (2014).
- Matinfar, M., Iyer, S., Ford, E., Wong, J., Kazanzides, P. Image guided complex dose delivery for small animal radiotherapy. IEEE International Symposium on Biomedical Imaging: From Nano to Macro. , 1243-1246 (2009).
- Matinfar, M., Iordachita, I., Wong, J., Kazanzides, P. Robotic delivery of complex radiation volumes for small animal research. IEEE International Conference on Robotics and Automation. , 2056-2061 (2010).
- Balvert, M., et al. A framework for inverse planning of beam-on times for 3D small animal radiotherapy using interactive multi-objective optimisation. Physics in Medicine & Biology. 60 (14), 5681-5698 (2015).
- Cho, N. B., Wong, J., Kazanzides, P. Dose Painting with a Variable Collimator for the Small Animal Radiation Research Platform (SARRP). The Midas Journal. , 1-8 (2014).
- Bolcaen, J., et al. MRI-guided 3D conformal arc micro-irradiation of a F98 glioblastoma rat model using the Small Animal Radiation Research Platform (SARRP). Journal of Neuro-oncology. 120 (2), 257-266 (2014).
- Bolcaen, J., Descamps, B., Boterberg, T., Vanhove, C., Goethals, I. PET and MRI guided irradiation of a glioblastoma rat model using a micro-irradiator. Journal of Visualized Experiments: JoVE. (130), e56601 (2017).
- Verhoeven, J., et al. Technical feasibility of [18F]FET and [18F]FAZA PET guided radiotherapy in a F98 glioblastoma rat model. Radiation Oncology. 14 (1), 89 (2019).
- Hutterer, M., et al. FET PET: a valuable diagnostic tool in neuro-oncology, but not all that glitters is glioma. Neuro-oncology. 15 (3), 341-351 (2013).
- Stockhammer, F., Plotkin, M., Amthauer, H., Landeghem, F. K. H., Woiciechowsky, C. Correlation of F-18-fluoro-ethyl-tyrosin uptake with vascular and cell density in non-contrast-enhancing gliomas. Journal of Neuro-oncology. 88 (2), 205-210 (2008).
- . Mricron dicom to nifti converter. neuroimaging informatics tools and resources clearinghouse (nitrc) Available from: https://www.nitrc.org/projects/mricron (2015)
- . SPM12 Manual Available from: https://www.fil.ion.ucl.ac.uk/spm/doc/spm12_manual.pdf (2014)
- España, S., Marcinkowski, R., Keereman, V., Vandenberghe, S., Van Holen, R. DigiPET: Sub-millimeter spatial resolution small-animal PET imaging using thin monolithic scintillators. Physics in Medicine & Biology. 59 (13), 3405-3420 (2014).

