Améliorer la reproductibilité pour répondre aux informations minimales pour les études sur les vésicules extracellulaires 2018 Lignes directrices dans l’analyse de suivi des nanoparticules
Summary
L’analyse de suivi des nanoparticules (NTA) est une méthode largement utilisée pour caractériser les vésicules extracellulaires. Cet article met en évidence les paramètres expérimentaux et les contrôles de la NTA ainsi qu’une méthode uniforme d’analyse et de caractérisation des échantillons et des diluants nécessaires pour compléter les lignes directrices proposées par MISEV2018 et EV-TRACK pour la reproductibilité entre les laboratoires.
Abstract
L’analyse de suivi des nanoparticules (NTA) est l’une des nombreuses méthodes de caractérisation utilisées pour la recherche sur les vésicules extracellulaires (EV) depuis 2006. Beaucoup considèrent que les instruments NTA et leurs progiciels peuvent être facilement utilisés après une formation minimale et que l’étalonnage de la taille est réalisable en interne. Comme l’acquisition de NTA et l’analyse logicielle constituent toutes deux une caractérisation des VE, elles sont abordées dans Minimal Information for Studies of Extracellular Vesicles 2018 (MISEV2018). En outre, ils ont été surveillés par Transparent Reporting and Centralizing Knowledge in Extracellular Vesicle Research (EV-TRACK) afin d’améliorer la robustesse des expériences sur les VE (par exemple, minimiser les variations expérimentales dues à des facteurs incontrôlés).
Malgré les efforts déployés pour encourager la déclaration des méthodes et des contrôles, de nombreux documents de recherche publiés ne rendent pas compte des paramètres critiques nécessaires pour reproduire les observations originales de la NTA. Peu d’articles rapportent la caractérisation par la NTA de témoins négatifs ou de diluants, en supposant évidemment que les produits disponibles dans le commerce, tels que la solution saline tamponnée au phosphate ou l’eau distillée ultrapure, sont exempts de particules. De même, les témoins positifs ou les normes de taille sont rarement rapportés par les chercheurs pour vérifier le dimensionnement des particules. L’équation de Stokes-Einstein incorpore des variables de viscosité et de température de l’échantillon pour déterminer le déplacement des particules. Le signalement de la température stable de la chambre laser pendant toute la collecte vidéo de l’échantillon est donc une mesure de contrôle essentielle pour une réplication précise. La filtration des échantillons ou des diluants n’est pas non plus systématiquement rapportée et, dans l’affirmative, les spécificités du filtre (fabricant, matériau de la membrane, taille des pores) et les conditions de stockage sont rarement incluses. Les normes minimales de détails expérimentaux acceptables de l’International Society for Extracellular Vesicle (ISEV) devraient inclure un protocole NTA bien documenté pour la caractérisation des VE. L’expérience suivante fournit des preuves qu’un protocole d’analyse NTA doit être établi par le chercheur individuel et inclus dans les méthodes de publications qui utilisent la caractérisation NTA comme l’une des options pour répondre aux exigences MISEV2018 pour la caractérisation de vésicules uniques.
Introduction
L’analyse précise et reproductible des véhicules électriques et d’autres particules à l’échelle nanométrique présente de nombreux défis dans la recherche et l’industrie. La réplication de la recherche sur les véhicules électriques a été difficile, en partie, en raison du manque d’uniformité dans la déclaration des paramètres nécessaires associés à la collecte de données. Pour remédier à ces lacunes, l’ISEV a proposé des lignes directrices de l’industrie en tant qu’ensemble minimal de normes biochimiques, biophysiques et fonctionnelles pour les chercheurs en VE et les a publiées sous forme d’énoncé de position, communément appelé MISEV20141. L’accélération du rythme de la recherche sur les véhicules électriques nécessitait une mise à jour des lignes directrices, et le « MISEV2018 : un énoncé de position de l’ISEV » a élargi les lignes directrices MISEV20142. Le document MISEV2018 comprenait des tableaux, des aperçus de protocoles suggérés et des étapes à suivre pour documenter la caractérisation spécifique associée aux VE. En tant que mesure supplémentaire pour faciliter l’interprétation et la réplication des expériences, EV-TRACK a été développé en tant que base de connaissances sur le crowdsourcing (http://evtrack.org) pour permettre des rapports plus transparents sur la biologie des VE et la méthodologie utilisée pour les résultatspubliés 3. Malgré ces recommandations pour la déclaration normalisée des méthodes, le domaine continue de souffrir de la réplication et de la confirmation des résultats publiés.
S’inscrivant dans les efforts des National Institutes of Health et de la National Science Foundation pour les outils d’évaluation de la qualité, cet article suggère que l’ISEV exige des rapports normalisés sur les méthodes et les détails afin que les outils d’évaluation des données puissent être appliqués dans le but de reproduire les résultats entre les laboratoires. La déclaration des sources cellulaires, les procédures de culture cellulaire et les méthodes d’isolement des VE sont des facteurs importants pour définir les qualités de la population de VE. Parmi les instruments de la NTA, des facteurs tels que les paramètres de détection, l’indice de réfraction du fluide porteur, les populations de particules hétérogènes contribuant à la polydispersité, l’absence d’exigences de déclaration normalisées et l’absence de résultats de mesure intra- et inter-observateurs rendent la comparaison de la NTA entre les laboratoires difficile, voire impossible.
Utilisée depuis 2006, la NTA est une méthode populaire pour la détermination de la taille et de la concentration des nanoparticules qui est actuellement utilisée par environ 80 % des chercheurs sur les VE4. Les lignes directrices MISEV2018 exigent deux formes d’analyse d’une seule vésicule, dont la NTA est l’une des options populaires. La NTA continue d’être couramment utilisée pour la caractérisation des véhicules électriques en raison de sa grande accessibilité, de son faible coût par échantillon et de sa théorie fondatrice simple (l’équation de Stokes-Einstein). L’évaluation ev par NTA génère une estimation de la distribution granulométrique et de la concentration à l’aide de la diffusion de la lumière laser et de l’analyse du mouvement brownien, la limite inférieure de détection étant déterminée par l’indice de réfraction de l’EV. Lors de l’utilisation d’un échantillon de fluide de viscosité et de température connues, les trajectoires des VE sont suivies pour déterminer leur déplacement moyen-carré en deux dimensions. Cela permet de calculer le coefficient de diffusion des particules et de le convertir en un diamètre hydrodynamique équivalent à une sphère par une équation de Stokes-Einstein modifiée 5,6,7. L’analyse particule à particule de NTA a moins d’interférences par des agglomérats ou des particules plus grosses dans une population hétérogène de VE que d’autres méthodes de caractérisation7. Alors que quelques particules plus grosses ont un impact minimal sur la précision du dimensionnement, la présence de quantités même infimes de grosses particules à diffusion de lumière élevée entraîne une réduction notable de la détection de particules plus petites en raison de la réduction de la détection et du suivi des VÉHICULES électriques par logiciel8. En tant que technique de mesure, la NTA est généralement considérée comme n’étant pas biaisée en faveur de particules plus grosses ou d’agrégats de particules, mais peut résoudre des populations de plusieurs tailles grâce à une analyse individuelle des particules9. En raison de l’utilisation de la diffusion de la lumière par les particules, l’une des limites de l’analyse NTA est que toute particule telle que la poussière, le plastique ou la poudre ayant des attributs de réfraction et de taille similaires à ceux des véhicules électriques ne peut pas être différenciée des véhicules électriques réels par cette méthode de caractérisation.
Le NanoSight LM10 (analyseur de taille de nanoparticules) et le LM14 (module laser) sont vendus depuis 2006, et bien que de nouveaux modèles de cet instrument aient été développés, ce modèle particulier se trouve dans de nombreuses installations de base et est considéré comme un cheval de bataille fiable. Une formation est nécessaire pour optimiser correctement les paramètres NTA pour les mesures à haute résolution de la taille et de la concentration. Les deux paramètres importants nécessaires pour des enregistrements vidéo optimaux sont (1) le niveau de la caméra et (2) le seuil de détection. Ceux-ci doivent être définis par l’opérateur en fonction des caractéristiques de l’échantillon. L’une des principales contraintes de l’analyse NTA est la recommandation de concentrations d’échantillon comprises entre 107 et 109 particules/mL, pour atteindre cette dilution d’échantillon peut être nécessaire10. Les solutions utilisées pour la dilution, telles que la solution saline tamponnée au phosphate, la solution saline 0,15 M ou l’eau ultrapure, sont rarement exemptes de particules de moins de 220 μm, ce qui peut affecter les mesures de la NTA. La caractérisation NTA des solutions utilisées pour la dilution doit être effectuée au même niveau de caméra et au même seuil de détection que les échantillons de nanoparticules analysés. La taille et la concentration des nanoparticules présentes dans les diluants utilisés pour les dilutions d’échantillons de VE sont rarement incluses dans les publications impliquant l’analyse NTA des VE.
Ce protocole utilise l’analyse NTA de liposomes synthétiques de type EV évalués à l’aide de niveaux de caméra sélectionnés, de seuils de détection et de filtrage mécanique des échantillons pour analyser les effets systématiques du niveau de la caméra, du seuil de détection ou de la filtration des échantillons sur l’ensemble de données NTA. Les liposomes ont été synthétisés comme décrit dans le fichier supplémentaire S1. Les liposomes synthétiques ont été utilisés dans cette expérience en raison de leur uniformité de taille, de leurs caractéristiques physiques et de leur stabilité dans le stockage à 4 ° C. Bien que des échantillons réels de ves aient pu être utilisés, l’hétérogénicité et la stabilité des VE pendant le stockage peuvent avoir compliqué cette étude et son interprétation. Les similitudes dans les rapports NTA des liposomes (A) et des VE (B) indiquent que les effets systématiques révélés pour les liposomes dans cet article s’appliqueront probablement aussi à la caractérisation des VE (Figure 1). Ensemble, ces résultats appuient l’idée que la déclaration complète des paramètres logiciels critiques et la description du traitement des échantillons, tels que le diluant, la dilution et la filtration, ont une incidence sur la reproductibilité des données NTA.
Le but de cet article est de démontrer que la variation des paramètres NTA (température, niveau de la caméra et seuil de détection) et de la préparation des échantillons modifie les résultats recueillis : des différences systématiques et significatives de taille et de concentration ont été obtenues. Comme le NTA est l’une des options populaires pour répondre à la spécification de caractérisation MISEV2018, ces résultats démontrent l’importance de déclarer la préparation des échantillons et les paramètres NTA pour assurer la reproductibilité.
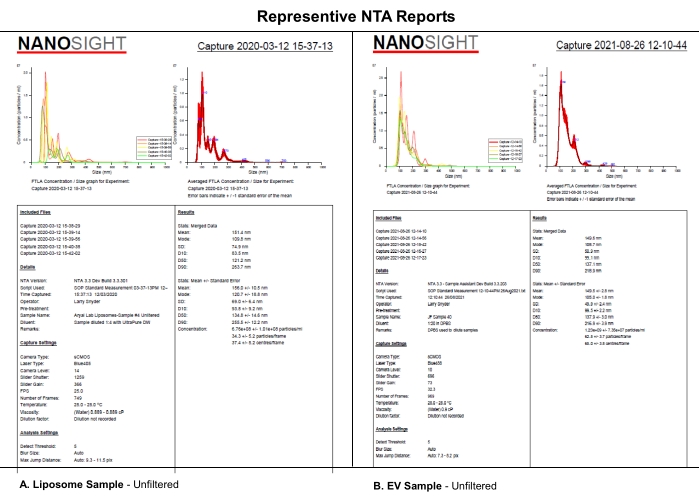
Figure 1 : Rapports représentatifs de la NTA pour comparer les liposomes aux ve. (A) Liposomes: échantillon non filtré caractérisé sur NTA le 12 mars 2020. B) VE: échantillon non filtré caractérisé sur NTA le 26 août 2021. Abréviations : NTA = Analyse de suivi des nanoparticules; VE = vésicules extracellulaires. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Protocol
Representative Results
Discussion
Il existe plusieurs méthodes pour estimer la taille et la concentration des nanoparticules11. Il s’agit notamment de méthodes d’ensemble qui génèrent une estimation de la taille à partir d’une population, y compris la diffusion dynamique de la lumière (DLS), la sédimentation centrifuge et l’analyse au niveau d’une seule particule – microscopie électronique, NTA, microscopie à force atomique et détection d’impulsion résistive accordable. Parmi ceux-ci, DLS et NTA sont des mé…
Declarações
The authors have nothing to disclose.
Acknowledgements
Le travail a été soutenu par l’État du Kansas au Midwest Institute for Comparative Stem Cell Biology (MICSCB), au Johnson Cancer Research Center à MLW et NIH R21AG066488 à LKC. OLS a reçu le soutien de la GRA du MICSCB. Les auteurs remercient le Dr Santosh Aryal d’avoir fourni les liposomes utilisés dans ce projet et les membres des laboratoires Weiss et Christenson pour des conversations et des commentaires utiles. Le Dr Hong He est remercié pour son soutien technique. MLW remercie Betti Goren Weiss pour son soutien et ses conseils.
Materials
| Automatic Pipetter | |||
| Centrifuge Tubes, Conical, Nunc 15 mL | Thermo Sci. | 339650 | |
| Kimwipes | |||
| Lens Cleaner | |||
| Lens Paper | |||
| NanoSight LM-10 | Malvern Panalytical | ||
| NanoSight LM-14 Laser Module | Malvern Panalytical | ||
| Nanosight NTA Software Ver. 3.2 | Malvern Panalytical | ||
| Paper Towels | |||
| Pipette Tips, 1-200 µL, Filtered, Sterile, Low Binding | BioExpress | P -3243-200X | |
| Pipette Tips, 50-1,000 µL, Filtered, Sterile | BioExpress | P-3243-1250 | |
| Saline, Dulbecco's Phosphate Buffered (No Ca or Mg) | Gibco | 14190-144 | |
| Standards, Latex Transfer- 100 nm (3 mL) | Malvern | NTA4088 | |
| Standards, Latex Transfer- 50 nm (3 mL) | Malvern | NTA4087 | |
| Syringe Filter, 33 mm, .22 µm, MCE, Sterile | Fisher brand | 09-720-004 | |
| Syringe, TB, 1 mL, slip tip | Becton Dickinson | 309659 | |
| Waste fluid container |
Referências
- Lotvall, J., et al. Minimal experimental requirements for definition of extracellular vesicles and their functions: a position statement from the International Society for Extracellular Vesicles. Journal of Extracellular Vesicles. 3 (1), (2014).
- Thery, C., et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): a position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. Journal of Extracellular Vesicles. 7 (1), 1535750 (2018).
- Consortium, E. -. T., et al. EV-TRACK: transparent reporting and centralizing knowledge in extracellular vesicle research. Nature Methods. 14 (3), 228-232 (2017).
- Gardiner, C., et al. Techniques used for the isolation and characterization of extracellular vesicles: results of a worldwide survey. Journal of Extracellular Vesicles. 5, 32945 (2016).
- Maas, S. L., et al. Possibilities and limitations of current technologies for quantification of biological extracellular vesicles and synthetic mimics. Journal of Controlled Release. 200, 87-96 (2015).
- Danaei, M., et al. Impact of particle size and polydispersity index on the clinical applications of lipidic nanocarrier systems. Pharmaceutics. 10 (2), 57 (2018).
- Kestens, V., Bozatzidis, V., De Temmerman, P. J., Ramaye, Y., Roebben, G. Validation of a particle tracking analysis method for the size determination of nano- and microparticles. Journal of Nanoparticle Research. 19 (8), 271 (2017).
- Filipe, V., Hawe, A., Jiskoot, W. Critical evaluation of nanoparticle tracking analysis (NTA) by NanoSight for the measurement of nanoparticles and protein aggregates. Pharmaceutical Research. 27 (5), 796-810 (2010).
- Hole, P., et al. Interlaboratory comparison of size measurements on nanoparticles using nanoparticle tracking analysis (NTA). Journal of Nanoparticle Research. 15 (12), 2101 (2013).
- Malvern analytical Ltd. . NanoSight LM10 Operating Manual-P550H. , (2013).
- Kim, A., Ng, W. B., Bernt, W., Cho, N. J. Validation of size estimation of nanoparticle tracking analysis on polydisperse macromolecule assembly. Scientific Reports. 9 (1), 2639 (2019).
- Gollwitzer, C., et al. A comparison of techniques for size measurement of nanoparticles in cell culture medium. Analytical Methods. 8 (26), 5272-5282 (2016).
- vander Pol, E., et al. Particle size distribution of exosomes and microvesicles determined by transmission electron microscopy, flow cytometry, nanoparticle tracking analysis, and resistive pulse sensing. Journal of Thrombosis and Haemostasis. 12 (7), 1182-1192 (2014).

