ナノ粒子追跡解析における細胞外小胞の研究のための最小限の情報を満たす再現性の向上2018ガイドライン
Summary
ナノ粒子追跡分析(NTA)は、細胞外小胞を特徴付けるために広く使用されている方法です。この論文では、NTAの実験パラメータと対照に加えて、実験室間の再現性のためにMISEV2018とEV-TRACKによって提案されたガイドラインを補完するために必要なサンプルと希釈剤の均一な分析と特性評価方法に焦点を当てます。
Abstract
ナノ粒子追跡解析(NTA)は、2006年以来、細胞外小胞(EV)研究に使用されているいくつかの特性評価方法の1つです。多くの人は、NTA機器とそのソフトウェアパッケージは最小限のトレーニングで簡単に利用でき、サイズ校正は社内で実現可能であると考えています。NTA取得とソフトウェア解析の両方がEV特性評価を構成するため、それらは細胞外小胞の研究のための最小情報2018(MISEV2018)で扱われています。さらに、EV実験の堅牢性を向上させるために、細胞外小胞研究における透明な報告および集中化知識(EV-TRACK)によって監視されています(例えば、制御されていない要因による実験変動を最小限に抑えます)。
方法と対照の報告を奨励する努力にもかかわらず、多くの出版された研究論文は、元のNTA観測を再現するために必要な重要な設定を報告していない。ネガティブコントロールまたは希釈剤のNTA特性評価を報告する論文はほとんどなく、明らかにリン酸緩衝生理食塩水や超純粋な蒸留水などの市販品が粒子を含まないと仮定しています。同様に、陽性対照またはサイズ基準は、粒子サイズを検証するために研究者によって報告されることはめったにありません。ストークス-アインシュタイン方程式には、サンプルの粘度と温度変数が組み込まれており、粒子の変位が決定されます。したがって、サンプルビデオ収集全体を通して安定したレーザーチャンバー温度を報告することは、正確な複製に不可欠な制御手段です。サンプルまたは希釈剤のろ過も日常的に報告されておらず、そうであれば、フィルターの詳細(製造業者、膜材料、孔径)および保管条件はほとんど含まれない。国際細胞外小胞学会(ISEV)の許容可能な実験詳細の最小基準には、EVの特性評価のための十分に文書化されたNTAプロトコルを含めるべきである。次の実験は、NTA分析プロトコルを個々の研究者によって確立し、単一小胞特性評価のためのMISEV2018要件を満たすためのオプションの1つとしてNTA特性評価を使用する出版物の方法に含める必要があるという証拠を提供する。
Introduction
EVやその他のナノメートルスケールの粒子の正確で再現性のある分析は、研究や業界全体で多くの課題を提示しています。EV研究の再現は、データ収集に関連する必要なパラメータの報告に統一性がないために、部分的には困難であった。これらの欠陥に対処するために、ISEVは、EV研究者のための生化学的、生物物理学的、および機能的基準の最小セットとして業界ガイドラインを提案し、一般にMISEV20141と呼ばれるポジションステートメントとして公開しました。EV研究の加速に伴い、ガイドラインの更新が必要となり、「MISEV2018:ISEVの立場表明」はMISEV2014ガイドライン2を拡張した。MISEV2018の論文には、表、推奨されるプロトコルの概要、および特定のEV関連の特性評価を文書化するための手順が含まれていました。実験の解釈と複製を容易にするためのさらなる措置として、EV-TRACKは、EV生物学および公表された結果に使用される方法論のより透明な報告を可能にするクラウドソーシングナレッジベース(http://evtrack.org)として開発されました3。方法の標準化された報告のためのこれらの勧告にもかかわらず、この分野は公表された結果の複製および確認に関して引き続き苦しんでいる。
この論文は、米国国立衛生研究所と米国国立科学財団の品質評価ツールに対する取り組みに合致して、ISEVが、実験室間で結果を複製する目的でデータ評価ツールを適用できるように、方法と詳細の標準化された報告を必要とすることを示唆している。細胞源、細胞培養手順、およびEV単離方法の報告は、EV集団の品質を定義する重要な要素です。NTA機器の中では、検出設定、キャリア流体の屈折率、多分散性に寄与する不均一な粒子集団、標準化された報告要件の欠如、および観察者間および観察者間の測定結果の欠如などの要因により、ラボ間のNTA比較は困難または不可能になります。
2006年以来使用されているNTAは、現在EV研究者の約80%によって使用されているナノ粒子サイズと濃度測定のための一般的な方法です4。MISEV2018ガイドラインでは、2つの形式の単一小胞分析が必要であり、そのうちNTAは一般的な選択肢の1つです。NTAは、その広いアクセシビリティ、サンプルあたりの低コスト、およびその簡単な創設理論(ストークス – アインシュタイン方程式)のために、EV特性評価に引き続き一般的に使用されています。NTAによるEV評価は、レーザー光散乱とブラウン運動解析を用いて粒度分布と濃度推定値を生成し、検出の下限はEVの屈折率によって決定される。既知の粘度と温度の流体サンプルを使用する場合、EVの軌道を追跡して、2次元で平均二乗変位を決定します。これにより、粒子拡散係数を計算し、修正されたストークス・アインシュタイン式5,6,7によって球相当流体力学的直径に変換することができる。NTAの粒子間分析は、他の特性評価方法よりも、EVの不均一な集団における凝集体またはより大きな粒子による干渉が少ない7。いくつかの大きな粒子はサイジング精度への影響を最小限に抑えますが、たとえ微量の大きくて高い光散乱粒子が存在すると、ソフトウェアEV検出と追跡の減少により、より小さな粒子の検出が著しく減少します8。測定技術として、NTAは一般に、より大きな粒子または粒子の凝集体に偏っていないと考えられているが、個々の粒子分析9を通じて複数のサイズの集団を解決できる。NTA解析の限界の1つは、粒子による光散乱を使用するため、粉塵、プラスチック、粉末などの屈折率やサイズ属性がEVと比較して類似している粒子は、この特性評価方法では実際のEVと区別できないことです。
NanoSight LM10(ナノ粒子サイズアナライザー)とLM14(レーザーモジュール)は2006年から販売されており、この装置の新しいモデルが開発されていますが、この特定のモデルは多くのコア施設で見つかっており、信頼性の高い主力製品と考えられています。サイズと濃度の高解像度測定のためにNTA設定を適切に最適化するには、トレーニングが必要です。最適なビデオ録画に必要な2つの重要な設定は、(1)カメラレベルと(2)検出しきい値です。これらは、サンプルの特性に基づいてオペレータが設定する必要があります。NTA分析の主な制約の1つは、107 〜109 粒子/ mLの間のサンプル濃度の推奨であり、このサンプル希釈を達成するためには10が必要であり得る。リン酸緩衝生理食塩水、0.15 M 生理食塩水、超純水などの希釈に使用される溶液には、サイズが 220 μm 未満の粒子が含まれていないことはめったになく、NTA 測定に影響を与える可能性があります。希釈に使用される溶液のNTA特性評価は、分析中のナノ粒子サンプルと同じカメラレベルおよび検出閾値で実施されるべきである。EVサンプル希釈に使用される希釈剤中に存在するナノ粒子のサイズおよび濃度は、EVのNTA分析を含む出版物にはほとんど含まれていない。
このプロトコルは、選択されたカメラレベル、検出閾値、およびサンプルの機械的フィルタリングを使用して評価された合成EV様リポソームのNTA分析を使用して、NTAデータセットに対するカメラレベル、検出閾値、またはサンプル濾過の体系的な影響を分析する。リポソームは、 補足ファイルS1に記載されるように合成した。合成リポソームは、そのサイズ均一性、物理的特性、および4°Cでの保存における安定性のために、この実験で使用された。 EVの実際のサンプルを使用する可能性があったが、貯蔵中のEVの異質性と安定性は、この研究とその解釈を複雑にした可能性がある。(A)リポソームと(B)EVからのNTA報告の類似性は、本論文でリポソームについて明らかにされた系統的効果がEV特性評価にも適用される可能性が高いことを示している(図1)。これらの知見は、重要なソフトウェア設定の完全なレポートと、希釈剤、希釈液、ろ過などのサンプル処理の説明がNTAデータの再現性に影響を与えるという考えを支持している。
この論文の目的は、NTA設定(温度、カメラレベル、および検出閾値)およびサンプル調製を変更すると、収集された結果(体系的で、サイズおよび濃度の有意な差)が得られたことを実証することである。NTAはMISEV2018特性評価仕様を満たすための一般的なオプションの1つであるため、これらの結果は、再現性を確保するためにサンプル調製とNTA設定を報告することの重要性を示しています。
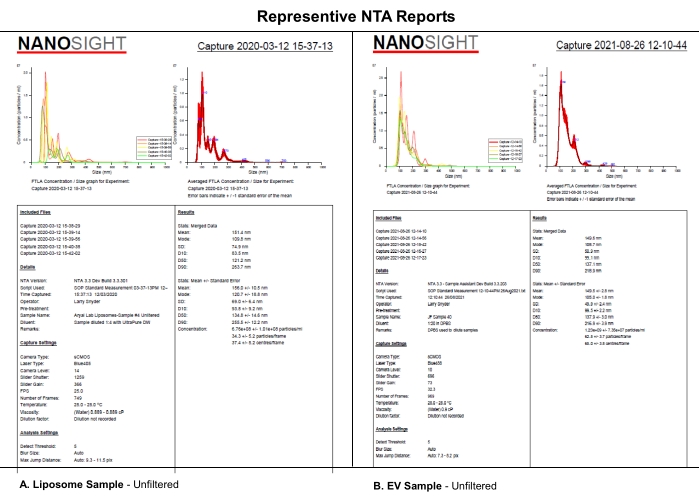
図1:代表的なNTAは、リポソームをEVと比較すると報告している。 (A)リポソーム:2020年3月12日にNTAを特徴とする未濾過サンプル。(B)EV:2021年8月26日に国税庁で特徴付けられた未濾過サンプル。略語: NTA = ナノ粒子追跡分析;EVs=細胞外小胞。 この図の拡大版を表示するには、ここをクリックしてください。
Protocol
Representative Results
Discussion
ナノ粒子11のサイズおよび濃度を推定するために利用可能ないくつかの方法がある。これらには、動的光散乱(DLS)、遠心沈降、および単一粒子レベルの分析 – 電子顕微鏡、NTA、原子間力顕微鏡、および調整可能な抵抗パルスセンシングを含む、集団からサイズ推定値を生成するアンサンブル法が含まれる。これらのうち、DLSおよびNTAは、理想的な媒体中でのブラウン運動に基…
Declarações
The authors have nothing to disclose.
Acknowledgements
この研究は、カンザス州から中西部比較幹細胞生物学研究所(MICSCB)、ジョンソンがん研究センターからMLW、NIH R21AG066488からLKCに支援されました。OLSはMICSCBからGRA支援を受けた。著者らは、このプロジェクトで使用されたリポソームを提供してくれたSantosh Aryal博士と、WeissとChristensonの研究室のメンバーに有益な会話とフィードバックに感謝している。ホン・ヘ博士は技術サポートに感謝しています。MLWはベッティ・ゴレン・ワイスのサポートと助言に感謝する。
Materials
| Automatic Pipetter | |||
| Centrifuge Tubes, Conical, Nunc 15 mL | Thermo Sci. | 339650 | |
| Kimwipes | |||
| Lens Cleaner | |||
| Lens Paper | |||
| NanoSight LM-10 | Malvern Panalytical | ||
| NanoSight LM-14 Laser Module | Malvern Panalytical | ||
| Nanosight NTA Software Ver. 3.2 | Malvern Panalytical | ||
| Paper Towels | |||
| Pipette Tips, 1-200 µL, Filtered, Sterile, Low Binding | BioExpress | P -3243-200X | |
| Pipette Tips, 50-1,000 µL, Filtered, Sterile | BioExpress | P-3243-1250 | |
| Saline, Dulbecco's Phosphate Buffered (No Ca or Mg) | Gibco | 14190-144 | |
| Standards, Latex Transfer- 100 nm (3 mL) | Malvern | NTA4088 | |
| Standards, Latex Transfer- 50 nm (3 mL) | Malvern | NTA4087 | |
| Syringe Filter, 33 mm, .22 µm, MCE, Sterile | Fisher brand | 09-720-004 | |
| Syringe, TB, 1 mL, slip tip | Becton Dickinson | 309659 | |
| Waste fluid container |
Referências
- Lotvall, J., et al. Minimal experimental requirements for definition of extracellular vesicles and their functions: a position statement from the International Society for Extracellular Vesicles. Journal of Extracellular Vesicles. 3 (1), (2014).
- Thery, C., et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): a position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. Journal of Extracellular Vesicles. 7 (1), 1535750 (2018).
- Consortium, E. -. T., et al. EV-TRACK: transparent reporting and centralizing knowledge in extracellular vesicle research. Nature Methods. 14 (3), 228-232 (2017).
- Gardiner, C., et al. Techniques used for the isolation and characterization of extracellular vesicles: results of a worldwide survey. Journal of Extracellular Vesicles. 5, 32945 (2016).
- Maas, S. L., et al. Possibilities and limitations of current technologies for quantification of biological extracellular vesicles and synthetic mimics. Journal of Controlled Release. 200, 87-96 (2015).
- Danaei, M., et al. Impact of particle size and polydispersity index on the clinical applications of lipidic nanocarrier systems. Pharmaceutics. 10 (2), 57 (2018).
- Kestens, V., Bozatzidis, V., De Temmerman, P. J., Ramaye, Y., Roebben, G. Validation of a particle tracking analysis method for the size determination of nano- and microparticles. Journal of Nanoparticle Research. 19 (8), 271 (2017).
- Filipe, V., Hawe, A., Jiskoot, W. Critical evaluation of nanoparticle tracking analysis (NTA) by NanoSight for the measurement of nanoparticles and protein aggregates. Pharmaceutical Research. 27 (5), 796-810 (2010).
- Hole, P., et al. Interlaboratory comparison of size measurements on nanoparticles using nanoparticle tracking analysis (NTA). Journal of Nanoparticle Research. 15 (12), 2101 (2013).
- Malvern analytical Ltd. . NanoSight LM10 Operating Manual-P550H. , (2013).
- Kim, A., Ng, W. B., Bernt, W., Cho, N. J. Validation of size estimation of nanoparticle tracking analysis on polydisperse macromolecule assembly. Scientific Reports. 9 (1), 2639 (2019).
- Gollwitzer, C., et al. A comparison of techniques for size measurement of nanoparticles in cell culture medium. Analytical Methods. 8 (26), 5272-5282 (2016).
- vander Pol, E., et al. Particle size distribution of exosomes and microvesicles determined by transmission electron microscopy, flow cytometry, nanoparticle tracking analysis, and resistive pulse sensing. Journal of Thrombosis and Haemostasis. 12 (7), 1182-1192 (2014).

