提高可重复性以满足细胞外囊泡研究的最少信息 2018纳米颗粒跟踪分析指南
Summary
纳米颗粒跟踪分析(NTA)是一种广泛使用的表征细胞外囊泡的方法。本文重点介绍了NTA实验参数和对照,以及样品和稀释剂的统一分析和表征方法,这是补充MISEV2018和EV-TRACK提出的实验室之间可重复性指南所必需的。
Abstract
自2006年以来,纳米颗粒跟踪分析(NTA)一直是用于细胞外囊泡(EV)研究的几种表征方法之一。许多人认为,NTA仪器及其软件包可以在最少的培训后轻松使用,并且尺寸校准在内部是可行的。由于NTA采集和软件分析都构成了EV表征,因此在2018年细胞外囊泡研究的最小信息(MISEV2018)中进行了讨论。此外,它们还通过透明报告和集中细胞外囊泡研究(EV-TRACK)知识进行监测,以提高EV实验的稳健性(例如,最大限度地减少由于不受控制的因素引起的实验变异)。
尽管努力鼓励报告方法和控制,但许多已发表的研究论文未能报告重现原始NTA观察结果所需的关键环境。很少有论文报道阴性对照或稀释剂的NTA表征,显然假设市售产品,如磷酸盐缓冲盐水或超纯蒸馏水,是无颗粒的。同样,研究人员也很少报告阳性对照或尺寸标准来验证颗粒大小。斯托克斯-爱因斯坦方程结合了样品粘度和温度变量来确定颗粒位移。因此,在整个样品视频采集过程中报告稳定的激光室温度是准确复制的重要控制措施。样品或稀释剂的过滤也不是常规报告的,如果是这样,过滤器的细节(制造商,膜材料,孔径)和储存条件很少包括在内。国际细胞外囊泡学会(ISEV)可接受的实验细节的最低标准应包括用于EV表征的有据可查的NTA方案。以下实验提供了证据,证明NTA分析方案需要由个体研究人员建立,并包含在使用NTA表征作为满足MISEV2018单囊泡表征要求的选项之一的出版物方法中。
Introduction
对电动汽车和其他纳米级颗粒进行准确和可重复的分析给整个研究和行业带来了许多挑战。电动汽车研究的复制一直很困难,部分原因是报告与数据收集相关的必要参数缺乏统一性。为了解决这些缺陷,ISEV提出了行业指南,作为EV研究人员的最小生化,生物物理和功能标准集,并将其作为立场声明发布,通常称为MISEV20141。电动汽车研究步伐的加快需要更新指南,而“MISEV2018:ISEV的立场声明”扩展了MISEV2014指南2。MISEV2018论文包括表格,建议协议的概述以及记录特定EV相关表征的步骤。作为促进实验解释和复制的进一步措施,EV-TRACK被开发为众包知识库(http://evtrack.org),以实现EV生物学和用于已发表结果的方法的更透明报告3。尽管提出了这些关于方法标准化报告的建议,但该领域在复制和确认已公布的结果方面继续受到影响。
与美国国立卫生研究院和美国国家科学基金会在质量评估工具方面的努力相吻合,本文表明ISEV需要标准化的方法和细节报告,以便数据评估工具可以应用于实验室之间复制结果的目标。报告细胞源、细胞培养程序和 EV 分离方法是确定 EV 群体质量的重要因素。在NTA仪器中,检测设置,载体流体的折射率,导致多分散性的非均相颗粒群体,缺乏标准化的报告要求以及缺乏观察点内和观察者之间的测量结果等因素使得实验室之间的NTA比较变得困难或不可能。
自2006年开始使用以来,NTA是一种流行的纳米颗粒尺寸和浓度测定方法,目前约有80%的EV研究人员使用4。MISEV2018指南要求两种形式的单囊泡分析,其中NTA是流行的选择之一。NTA由于其广泛的可访问性,每个样品的低成本以及其直接的创始理论(斯托克斯 – 爱因斯坦方程)而继续被普遍用于EV表征。NTA的EV评估使用激光散射和布朗运动分析生成粒度分布和浓度估计,检测的下限由EV的折射率确定。当使用已知粘度和温度的流体样品时,将跟踪EV的轨迹以确定其在二维中的均方位移。这允许通过修正的斯托克斯 – 爱因斯坦方程5,6,7计算粒子扩散系数并将其转换为球面等效流体动力学直径。与其他表征方法相比,NTA的颗粒间分析在非均相EV群体中受到团聚物或更大颗粒的干扰较少7。虽然一些较大的颗粒对定量精度的影响很小,但即使微量的大的、高光散射颗粒的存在,由于软件EV检测和跟踪的减少,也会显著减少对较小颗粒的检测。作为一种测量技术,NTA通常被认为不偏向于较大的颗粒或颗粒聚集体,但可以通过单个颗粒分析9解决多个大小的群体。由于使用颗粒光散射,NTA分析的局限性之一是,与EV相比具有相似折射和尺寸属性的任何颗粒物(例如灰尘,塑料或粉末)都无法通过这种表征方法与实际EV区分开来。
NanoSight LM10(纳米颗粒尺寸分析仪)和LM14(激光模块)自2006年以来一直销售,尽管已经开发了该仪器的新型号,但这种特殊型号在许多核心设施中都可以找到,被认为是可靠的主力。需要进行培训以正确优化NTA设置,以实现高分辨率的尺寸和浓度测量。最佳视频录制所需的两个重要设置是(1)相机电平和(2)检测阈值。这些必须由操作员根据样品的特性进行设置。NTA分析的主要制约因素之一是建议样品浓度在107 和109 个颗粒/mL之间,要达到该样品稀释可能需要10个。用于稀释的溶液,如磷酸盐缓冲盐水、0.15 M盐水或超纯水,很少不含小于220μm的颗粒,这可能会影响NTA测量。用于稀释的溶液的NTA表征应在与正在分析的纳米颗粒样品相同的相机水平和检测阈值下进行。用于EV样品稀释的稀释剂中存在的纳米颗粒的大小和浓度很少包含在涉及EV的NTA分析的出版物中。
该协议使用合成EV样脂质体的NTA分析,这些脂质体使用选定的相机水平,检测阈值和样品的机械过滤来分析相机水平,检测阈值或样品过滤对NTA数据集的系统影响。脂质体的合成如 补充文件S1中所述。本实验使用合成脂质体,因为它们的尺寸均匀性,物理特性和在4°C下储存的稳定性。 虽然可以使用电动汽车的实际样品,但电动汽车在储存过程中的异质性和稳定性可能使这项研究及其解释复杂化。来自(A)脂质体和(B)EV的NTA报告中的相似性表明,本文中揭示的脂质体的系统效应可能也适用于EV表征(图1)。总之,这些发现支持了这样一种观点,即关键软件设置的完整报告和样品处理的描述,如稀释剂,稀释和过滤,会影响NTA数据的可重复性。
本文的目的是证明改变NTA设置(温度,相机水平和检测阈值)和样品制备会改变收集的结果:获得系统,显着的尺寸和浓度差异。由于NTA是满足MISEV2018表征规范的常用选项之一,这些结果证明了报告样品制备和NTA设置以确保可重复性的重要性。
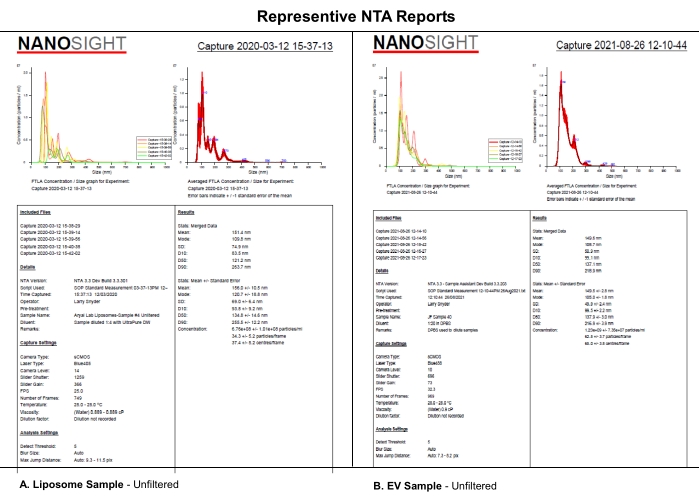
图1:代表性的NTA报告将脂质体与EV进行比较。 (A)脂质体:2020年3月12日在NTA上表征的未过滤样品。(B) EV:2021年8月26日在NTA上表征的未经过滤的样品。缩写:NTA =纳米颗粒跟踪分析;EV = 细胞外囊泡。 请点击此处查看此图的大图。
Protocol
Representative Results
Discussion
有几种方法可用于估计纳米颗粒的大小和浓度11。这些包括从群体生成尺寸估计值的集合方法,包括动态光散射(DLS),离心沉降和单颗粒水平分析电子显微镜,NTA,原子力显微镜和可调谐电阻脉冲传感。其中,DLS和NTA是广泛使用的无损尺寸和浓度测量方法,基于布朗运动的理想介质。DLS依赖于光的散射,强度与粒子体积的平方成正比。因此,DLS比NTA对大颗粒,聚集体或多分散?…
Declarações
The authors have nothing to disclose.
Acknowledgements
这项工作得到了堪萨斯州对中西部比较干细胞生物学研究所(MICSCB),约翰逊癌症研究中心对MLW和NIH R21AG066488对LKC的支持。OLS得到了MICSCB的GRA支持。作者感谢Santosh Aryal博士提供本项目中使用的脂质体,并感谢Weiss和Christenson实验室的成员进行有益的对话和反馈。感谢何鸿博士的技术支持。MLW感谢Betti Goren Weiss的支持和建议。
Materials
| Automatic Pipetter | |||
| Centrifuge Tubes, Conical, Nunc 15 mL | Thermo Sci. | 339650 | |
| Kimwipes | |||
| Lens Cleaner | |||
| Lens Paper | |||
| NanoSight LM-10 | Malvern Panalytical | ||
| NanoSight LM-14 Laser Module | Malvern Panalytical | ||
| Nanosight NTA Software Ver. 3.2 | Malvern Panalytical | ||
| Paper Towels | |||
| Pipette Tips, 1-200 µL, Filtered, Sterile, Low Binding | BioExpress | P -3243-200X | |
| Pipette Tips, 50-1,000 µL, Filtered, Sterile | BioExpress | P-3243-1250 | |
| Saline, Dulbecco's Phosphate Buffered (No Ca or Mg) | Gibco | 14190-144 | |
| Standards, Latex Transfer- 100 nm (3 mL) | Malvern | NTA4088 | |
| Standards, Latex Transfer- 50 nm (3 mL) | Malvern | NTA4087 | |
| Syringe Filter, 33 mm, .22 µm, MCE, Sterile | Fisher brand | 09-720-004 | |
| Syringe, TB, 1 mL, slip tip | Becton Dickinson | 309659 | |
| Waste fluid container |
Referências
- Lotvall, J., et al. Minimal experimental requirements for definition of extracellular vesicles and their functions: a position statement from the International Society for Extracellular Vesicles. Journal of Extracellular Vesicles. 3 (1), (2014).
- Thery, C., et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): a position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. Journal of Extracellular Vesicles. 7 (1), 1535750 (2018).
- Consortium, E. -. T., et al. EV-TRACK: transparent reporting and centralizing knowledge in extracellular vesicle research. Nature Methods. 14 (3), 228-232 (2017).
- Gardiner, C., et al. Techniques used for the isolation and characterization of extracellular vesicles: results of a worldwide survey. Journal of Extracellular Vesicles. 5, 32945 (2016).
- Maas, S. L., et al. Possibilities and limitations of current technologies for quantification of biological extracellular vesicles and synthetic mimics. Journal of Controlled Release. 200, 87-96 (2015).
- Danaei, M., et al. Impact of particle size and polydispersity index on the clinical applications of lipidic nanocarrier systems. Pharmaceutics. 10 (2), 57 (2018).
- Kestens, V., Bozatzidis, V., De Temmerman, P. J., Ramaye, Y., Roebben, G. Validation of a particle tracking analysis method for the size determination of nano- and microparticles. Journal of Nanoparticle Research. 19 (8), 271 (2017).
- Filipe, V., Hawe, A., Jiskoot, W. Critical evaluation of nanoparticle tracking analysis (NTA) by NanoSight for the measurement of nanoparticles and protein aggregates. Pharmaceutical Research. 27 (5), 796-810 (2010).
- Hole, P., et al. Interlaboratory comparison of size measurements on nanoparticles using nanoparticle tracking analysis (NTA). Journal of Nanoparticle Research. 15 (12), 2101 (2013).
- Malvern analytical Ltd. . NanoSight LM10 Operating Manual-P550H. , (2013).
- Kim, A., Ng, W. B., Bernt, W., Cho, N. J. Validation of size estimation of nanoparticle tracking analysis on polydisperse macromolecule assembly. Scientific Reports. 9 (1), 2639 (2019).
- Gollwitzer, C., et al. A comparison of techniques for size measurement of nanoparticles in cell culture medium. Analytical Methods. 8 (26), 5272-5282 (2016).
- vander Pol, E., et al. Particle size distribution of exosomes and microvesicles determined by transmission electron microscopy, flow cytometry, nanoparticle tracking analysis, and resistive pulse sensing. Journal of Thrombosis and Haemostasis. 12 (7), 1182-1192 (2014).

