Получение энантиопурных неактивированных азиридинов и синтез биемамида B, D и эпиалло-изомускарина
Summary
В этом исследовании мы получаем как энантиомеры азиридина-2-карбоксилата, которые используются в асимметричном синтезе алкалоидов, включая биемамид B и D, так и (-)-эпиалло-изомускарин.
Abstract
Азотсодержащие гетероцикловые азиридины синтетически очень ценны для получения азациклических и ациклических молекул. Однако очень трудно и трудоемко производить азиридины в оптически чистых формах в больших масштабах для применения асимметричного синтеза аза-соединений. К счастью, мы успешно достигли как энантиомеров (2R)-, так и (2S)-азиридин-2-карбоксилатов с электрон-донорной α-метилбензиловой группой на кольцевом азоте в качестве неактивированных азиридинов. Эти исходные азиридины имеют две различные функциональные группы – высокореактивное трехчленное кольцо и универсальный карбоксилат. Они применимы при кольцевом раскрытии или кольцевом превращении с азиридином и в функциональном групповом превращении в другие из карбоксилата. Оба этих энантиомера использовали при получении биологически важных аминоациклических и/или аза-гетероциклических соединений асимметричным образом. В частности, в настоящем отчете описывается первый целесообразный асимметричный синтез обоих энантиомеров 5, 6-дигидроурациловых морских натуральных продуктов биемамида B и D в качестве потенциальных ингибиторов TGF-β. Этот синтез состоял из регио- и стереоселективной реакции открытия кольца азиридина-2-карбоксилата и последующего образования 4-аминотетерагидропиримидина-2,4-диона. Еще один пример в этом протоколе касался высокостимаселективной реакции Мукайяма азиридина-2-карбоксилата и силиленолового эфира после внутримолекулярного открытия кольца азиридина для обеспечения легкого и легкого доступа к (-)-эпиалло-изомускарину.
Introduction
Небольшие кольца, состоящие из циклопропанов, оксиранов и азиридинов, содержатся в различных соединениях, таких как натуральные продукты и препараты 1,2. Они в основном используются в качестве исходных материалов, использующих их кольцевую деформацию. Среди трехкольцевых соединений азиридин изучен менее широко из-за его нестабильности и неконтролируемой реакционной способности3. Как показано на картах электростатических потенциалов (рисунок 1), группа, присоединенная к азиридиновому кольцу-азоту, будь то донорство электронов или притяжение электронов, делает основу азота различной. Это различие обеспечивает разительный контраст с реактивностью и селективностью соответствующих азиридинов.
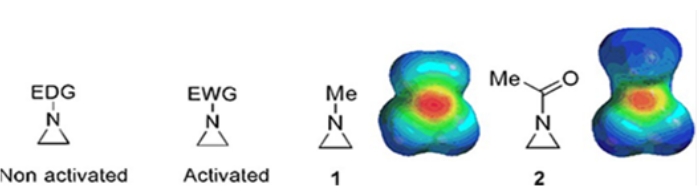
Рисунок 1: Химические структуры «активированных» и «неактивированных» азиридинов и карты электростатических потенциалов их репрезентативных примеров N-метилазиридина и N-ацетилазиридина4. Эта цифра была изменена с разрешения Ranjith et al.4. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Когда кольцевой азот имеет электрон-выводящую группу, такую как сульфонат, фосфонат и карбамат, мы называем его «активированным» азиридином. Это легко реагирует с нуклеофилами, чтобы компенсировать его нестабильность с ограниченным объемом региохимии. Эти активированные азиридины получают различными каталитическими методами и используют в качестве исходного материала. Большая часть недавней химии азиридина имела дело с этими активированными азиридинами. Однако активированные азиридины страдают от определенных ограничений, обусловленных их нестабильностью и ограниченным объемом реакции на открытие кольца. С другой стороны, азиридины, несущие электрон-донорные заместители, такие как алкильные или замещенные алкильные группы, в кольцевом азоте, называемом «неактивированным»4, относительно стабильны в большинстве случаев и могут оставаться на стенде в течение длительного времени без значительного разложения. Нуклеофильные реакции открытия кольца неактивированного азиридина происходят путем образования ионов азиридиния. Большинство реакций открытия кольца азиридина и превращений колец протекают высокорегиохимическим образом. Однако очень немногие литературные отчеты обсуждают получение оптически чистых неактивированных азиридинов с заместителями в позициях С2 или С3 5,6.
В данной работе показано успешное получение α-метилбензилгрупп-содержащих хирал азиридин-2-карбоксилат производных, в частности (-)-ментолил(1R)-фенилэтилазиридин-2-карбоксилатов в качестве его диастереомерной смеси, из реакции 2,3-дибромпропионата и (1R)-фенилэтиламина. Из этой диастереомерной смеси энантиопура (1R)-фенилэтил-(2R)- и (2S)-азиридин-2-карбоксилаты в качестве их (-)-ментолиловых эфиров были получены в оптически чистых формах путем селективной рекристаллизации из MeOH и n-пентана на многосоткилометровых шкалах (рисунок 1)7. Эти (-)-ментолиловые эфиры могут быть легко преобразованы в их этиловые или метиловые эфиры путем переэтерификации в присутствии карбоната магния или калия7. Эти соединения также могут быть легко получены в лабораторных масштабах из реакций алкил-2,3-дибромпропионатов или винилэрифлата α-кетоэстера с хиральным 2-фенилэтиламином с последующим разделением диастереомерной смеси с помощью простой флэш-колоночной хроматографии8.
Получив энантиопуру хиральный азиридин-2-карбоксилат, можно синтезировать различные циклические и ациклические азотсодержащие биологически важные молекулы-мишени на основе функциональных групповых превращений карбоксилата и высокорегио- и стереоселективных реакций открытия азиридинового кольца 6,9,10. Первый целесообразный асимметричный синтез был применен для обоих энантиомеров 5, 6-дигидроурациловых морских натуральных продуктов биемамида В и D в качестве потенциальных ингибиторов TGF-β11,12. Во-вторых, диастереозелективный синтез β-(азиридин-2-ил)-β-гидроксикетонов был достигнут реакцией альдола Мукайяма оптически чистого 1-(1-фенилэтил)-азиридина-2-карбоксальдегида и различных еноловых силанов в присутствииZnCl2, в высоком выходе (>82%) с почти идеальной стереоселективностью (98:2 др) через хелатно-контролируемое переходное состояние. Они использовались для асимметричного синтеза эпиалло-изомускариновых алкалоидов 13,14,15.
Protocol
Representative Results
Discussion
Азиридины как азотсодержащие трехчленные гетероциклы обладают огромным потенциалом для синтетических стартовых боевых или промежуточных продуктов для получения богатых азотом органических молекул. Исходя из группы, несущей на кольцевом кольце азот, они классифицируются как «актив?…
Declarações
The authors have nothing to disclose.
Acknowledgements
Это исследование было поддержано Национальным исследовательским фондом Кореи (NRF-2020R1A2C1007102 и 2021R1A5A6002803) с Центром новых направлений в органическом синтезе и грантом HUFS 2022.
Materials
| (2R)-1-[(1R)-1-Phenylethyl]-2-aziridinecarboxylic acid (-)-menthol ester, 98% | Sigma-Aldrich | 57054-0 | |
| (2S)-1-[(1R)-1-Phenylethyl]-2-aziridinecarboxylic acid (-)-menthol ester | Sigma-Aldrich | 57051-6 | |
| 1-(3-Dimethylaminopropyl)-3-ethylcarbodiimide hydrochloride | TCI | 424331-25 g | CAS No: 25952-53-8 |
| 1,4-Dioxane | SAMCHUN | D0654-1 kg | CAS No: 123-91-1 |
| 1-Hydroxybenzotriazole hydrate | Aldrich | 219-989-7-50 g | CAS No: 123333-53-9 |
| 2,6-Lutidine | Alfa Aesar | A10478-AP, 500 mL | CAS No: 108-48-5 |
| Acetonitrile | SAMCHUN | A0127-18 L | CAS No: 75-05-8 |
| Acetonitrile-d3 | Cambridge Isotope Laboratories, | 15G-744-25 g | CAS No: 2206-26-0 |
| Aluminum chloride hexahydrate | Aldrich | 231-208-1, 500 g | CAS No : 7784-13-6 |
| Bruker AVANCE III HD (400 MHz) spectrometer | Bruker | NA | |
| Chloroform-d | Cambridge Isotope Laboratories, | 100 g | CAS No: 865-49-6 |
| Dichloromethane | SAMCHUN | M0822-18 L | CAS No: 75-09-2 |
| Dimethyl sulfoxide-d6 | Cambridge Isotope Laboratories, | 25 g | CAS No: 2206-27-1 |
| Ethanol | EMSURE | 1009831000,1L | CAS No: 64-17-5 |
| Ethyl acetate | SAMCHUN | E0191-18 L | CAS No: 141-78-6 |
| High resolution mass spectra/MALDI-TOF/TOF Mass Spectrometry | AB SCIEX | 4800 Plus | High resolution mass spectra |
| JASCO P-2000 | JASCO | P-2000 | For optical rotation |
| Lithium aluminum hydride | TCI | L0203-100 g | CAS No: 16853-85-3 |
| L-Selectride, 1 M solution in THF | Acros | 176451000, 100 mL | CAS No: 38721-52-7 |
| Methanol | SAMCHUN | M0585-18 L | CAS No: 67-56-1 |
| N-[(9H-Fluoren-9-ylmethoxy)carbonyl]-β-alanine | TCI | F08825G-5 g | CAS No: 35737-10-1 |
| N-Ethyldiisopropylamine | Aldrich | 230-392-0, 100 mL | CAS No: 7087-68-5 |
| n-Hexane | SAMCHUN | H0114-18 L | CAS No: 110-54-3 |
| Ninhydrin | Alfa Aesar | A10409-250 g | CAS No: 485-47-2 |
| p-Anisaldehyde | aldrich | A88107-5 g | CAS No: 123-11-5 |
| Phosphomolybdic acid hydrate | TCI | P1910-100 g | CAS No: 51429-74-4 |
| Sodium azide | D.S.P | 703301-500 g | CAS No: 26628-22-8 |
| Sodium Hydride 60% dispersion in mineral oil | Sigma-Aldrich | 452912-100 G | CAS No: 7646-69-7 |
| Sodium hydroxide | DUKSAN | A31226-1 kg | CAS No: 1310-73-2 |
| Sodium sulfate | SAMCHUN | S1011-1 kg | CAS No: 7757-82-6 |
| Thin Layer Chromatography (TLC) | Merck | 100390 | |
| Tert-Butyldimethylsilyl trifluoromethanesulfonate, 98% | Aldrich | 274-102-0, 25 g | CAS NO: 69739-34-0 |
| Tetrahydrofuran | SAMCHUN | T0148-18 L | CAS No: 109-99-9 |
| Triethylethylamine | DAEJUNG | 8556-4400-1 L | CAS No: 121-44-8 |
| UV light | Korea Ace Sci | TN-4C | 254 nm |
| Zinc chloride, anhydrous, 98+% | Alfa Aesar | A16281-22100 g | CAS No : 7646-85-7 |
Referências
- Pitzer, K. S. Strain energies of cyclic hydrocarbons. Science. 101 (2635), 672 (1945).
- Dudev, T., Lim, C. Ring strain energies from ab initio calculations. Journal of the American Chemical Society. 120 (18), 4450-4458 (1998).
- D’hooghe, M., Ha, H. -. J. . Synthesis of 4- to 7-Membered Heterocycles by Ring Expansion. , (2016).
- Ranjith, J., Ha, H. -. J. Synthetic applications of aziridinium ions. Molecules. 26 (6), 1744 (2021).
- Sweeney, J. B. Aziridines: epoxides’ ugly cousins. Chemical Society Reviews. 31 (5), 247-258 (2002).
- Stankovic, S., et al. Regioselectivity in the ring opening of non-activated aziridines. Chemical Society Reviews. 41 (2), 643-665 (2012).
- Lee, W. K., Ha, H. -. J. Highlights of the chemistry of enantiomerically pure aziridine-2-carboxylates. Aldrichimica Acta. 36 (2), 57-63 (2003).
- Tranchant, M. J., Dalla, V., Jabin, I., Decroix, B. Reaction of vinyl triflates of α-keto esters with primary amines: efficient synthesis of aziridine carboxylates. Tetrahedron. 58 (42), 8425-8432 (2002).
- Ha, H. -. J., Jung, J. -. H., Lee, W. K. Application of regio- and stereoselective functional group transformation of chiral aziridine-2-carboxylate. Asian Journal of Organic Chemistry. 3 (10), 1020-1035 (2014).
- Kim, Y., et al. Preparation of 2,3-diaminopropionate from ring opening of aziridine-2-carboxylate. Tetrahedron Letters. 46 (25), 4407-4409 (2005).
- Srivastava, N., Macha, L., Ha, H. -. J. Total synthesis and stereochemical revision of biemamides B and D. Organic Letters. 21 (22), 8992-8996 (2019).
- Zhang, F., et al. Biemamides A-E, inhibitors of the TGF-β pathway that block the epithelial to mesenchymal transition. Organic Letters. 20 (18), 5529-5532 (2018).
- Srivastava, N., Ha, H. -. J. Highly efficient and stereoselective Mukaiyama Aldol reaction with chiral aziridine-2-carboxaldehyde and its synthetic applications. Asian Journal of Organic Chemistry. 11 (1), 2021005671 (2021).
- Kempter, I., et al. Synthesis and structural characterization of the isomuscarines. Tetrahedron. 70 (10), 1918-1927 (2014).
- Pirrrung, M. C., DeAmicis, C. V. Total synthesis of the muscarines. Tetrahedron Letters. 29 (2), 159-162 (1988).

