Evaluación del daño térmico de la craneotomía perforada por robot para la cirugía de ventana craneal en ratones
Summary
Las ventanas craneales se han convertido en una técnica quirúrgica implementada ubicuamente para permitir imágenes intravitales en ratones transgénicos. Este protocolo describe el uso de un robot quirúrgico que realiza perforaciones óseas semiautomáticas de ventanas craneales y puede ayudar a reducir la variabilidad de cirujano a cirujano y mitigar parcialmente el daño de la barrera térmica hematoencefálica.
Abstract
La cirugía de ventana craneal permite la obtención de imágenes del tejido cerebral en ratones vivos con el uso de multifotones u otras técnicas de imagen intravital. Sin embargo, cuando se realiza cualquier craneotomía a mano, a menudo hay daño térmico al tejido cerebral, que es inherentemente variable de cirugía a cirugía y puede depender de la técnica individual del cirujano. La implementación de un robot quirúrgico puede estandarizar la cirugía y conducir a una disminución del daño térmico asociado con la cirugía. En este estudio, se probaron tres métodos de perforación robótica para evaluar el daño térmico: horizontal, punto por punto y pulsado punto por punto. La perforación horizontal utiliza un esquema de perforación continua, mientras que punto por punto perfora varios agujeros que abarcan la ventana craneal. El pulsado punto por punto agrega un esquema de perforación “2 s encendido, 2 s apagado” para permitir el enfriamiento entre perforaciones. Las imágenes fluorescentes del tinte Evans Blue (EB) inyectado por vía intravenosa miden el daño al tejido cerebral, mientras que un termopar colocado debajo del sitio de perforación mide el daño térmico. Los resultados del termopar indican una disminución significativa en el cambio de temperatura en el grupo pulsado punto por punto (6.90 °C ± 1.35 °C) en comparación con los grupos horizontal (16.66 °C ± 2.08 °C) y punto por punto (18.69 °C ± 1.75 °C). Del mismo modo, el grupo pulsado punto por punto también mostró significativamente menos presencia de EB después de la perforación de la ventana craneal en comparación con el método horizontal, lo que indica menos daño a los vasos sanguíneos en el cerebro. Por lo tanto, un método de perforación pulsado punto por punto parece ser el esquema óptimo para reducir el daño térmico. Un taladro robótico es una herramienta útil para ayudar a minimizar el entrenamiento, la variabilidad y reducir el daño térmico. Con el uso cada vez mayor de imágenes multifotónicas en los laboratorios de investigación, es importante mejorar el rigor y la reproducibilidad de los resultados. Los métodos abordados aquí ayudarán a informar a otros sobre cómo utilizar mejor estos robots quirúrgicos para avanzar aún más en el campo.
Introduction
Las ventanas craneales se han utilizado ubicuamente en los campos de la neurociencia, la ingeniería neuronal y la biología para permitir la visualización directa y la obtención de imágenes de la corteza en animales vivos 1,2,3,4,5,6,7,8,9,10,11 . La poderosa combinación de ratones transgénicos e imágenes multifotónicas ha proporcionado información extremadamente valiosa sobre la actividad del circuito y otras ideas biológicas en el cerebro in vivo 12,13,14,15,16,17,18. Los microscopios en miniatura montados en el cráneo han ampliado aún más estas capacidades para permitir grabaciones en animales despiertos que se mueven libremente19. El proceso de creación de una ventana craneal requiere perforación eléctrica para adelgazar o eliminar completamente el hueso craneal para producir craneotomías lo suficientemente grandes como para asegurar una pieza transparente de vidrio sobre la corteza20. El polidimetilsiloxano (PDMS) y otros polímeros también han sido probados como materiales de ventana craneal 9,21. En última instancia, la ventana craneal ideal es aquella que no altera ni interfiere con la actividad endógena normal debajo. Sin embargo, es comúnmente aceptado que la perforación de la ventana craneal agrava el tejido subyacente, lo que lleva a daños en el cerebro, alteración del medio ambiente y meninges hasta el punto de ocluir la profundidad de la imagen multifotónica22. La neuroinflamación resultante tiene una amplia gama de efectos que van desde la permeabilidad de la barrera hematoencefálica (BHE) hasta la activación y el reclutamiento de células gliales alrededor del sitio del implante23. Por lo tanto, la caracterización de métodos de perforación de ventanas craneales más seguros y reproducibles es crucial para una calidad de imagen consistente y reducir los factores de confusión.
Mientras que se tiene cuidado de minimizar el trauma en el tejido subyacente, el acto de perforar el hueso tiene el potencial de causar perturbaciones térmicas y mecánicas al cerebro24,25. El trauma mecánico por penetración accidental del taladro en la duramadre puede inducir diversos grados de lesión cortical24. En un estudio de Shoffstall et al.25, el calor de la perforación ósea resultó en un aumento de la permeabilidad BBB, como lo indica la presencia de colorante Evans Blue (EB) en el parénquima cerebral 25. El colorante EB, inyectado por vía intravenosa, se une a la albúmina circulante en el torrente sanguíneo y, por lo tanto, normalmente no cruza una barrera hematoencefálica saludable en concentraciones apreciables. Como resultado, el colorante EB se utiliza comúnmente como un marcador sensible de la permeabilidad BBB26,27. Si bien su estudio no midió directamente el impacto de la permeabilidad de la BHE en las secuelas biológicas posteriores en estudio, estudios previos han correlacionado la permeabilidad de la BHE con una mayor respuesta neuroinflamatoria a microelectrodos implantados crónicamente y alteraciones en la función motora28.
Dependiendo de los objetivos del estudio, la magnitud del daño térmico y mecánico puede contribuir a una fuente de error experimental, afectando negativamente el rigor y la reproducibilidad del estudio. Hay docenas de métodos citados para producir ventanas craneales, cada uno utilizando diferentes equipos de perforación, velocidades, técnicas y usuarios 1,2,3,4,5,6,7,8,9,10,11. Shoffstall et al.25 informaron que la variación observada en los resultados de calentamiento se atribuyó a la variabilidad en la fuerza aplicada, la velocidad de avance y el ángulo de aplicación del taladro, entre otros aspectos que no pueden controlarse cuando se perfora a mano 25. Existe la creencia de que los sistemas de perforación automatizados y otros equipos estereotáxicos pueden mejorar la reproducibilidad y la consistencia de los resultados, pero los estudios de métodos publicados no han evaluado rigurosamente la temperatura o la permeabilidad de la barrera hematoencefálica como uno de los resultados. Por lo tanto, existe la necesidad de métodos más reproducibles y consistentemente aplicados para producir ventanas craneales, así como métodos rigurosamente aplicados para evaluar el impacto de la perforación de ventanas craneales en el tejido neural subyacente.
El objetivo de este estudio es determinar y desarrollar métodos de perforación consistentes y seguros para ventanas craneales. El tamaño de la craneotomía para la instalación de la ventana craneal es significativamente mayor que las craneotomías estándar para microelectrodos implantados en el cerebro. Tales craneotomías no pueden completarse con un solo orificio de rebaba cuando se utiliza equipo estándar, introduciendo así más variabilidad de la técnica intercirujano cuando se realiza a mano20. Los robots de perforación quirúrgica se han introducido en el campo, pero no han sido ampliamente adoptados 1,6,29. La automatización de la perforación ofrece control sobre las variables que contribuyen a la variación observada de ensayo a ensayo, lo que sugiere que el uso del equipo puede reducir los efectos inter e intracirujanos. Esto es de particular interés dada la dificultad añadida de la craneotomía más grande necesaria para la colocación de la ventana craneal. Si bien se podría suponer que hay beneficios claros para el control proporcionado por la automatización de la perforación, ha habido poca evaluación de la implementación de estos equipos. Aunque no se han observado lesiones visibles5, se desea la prueba de mayor sensibilidad con EB.
Aquí, la permeabilidad BBB se mide utilizando un robot de perforación quirúrgica disponible comercialmente con el software correspondiente, que permite la programación de coordenadas estereotáxicas, planificación / mapeo de craneotomía y una selección de estilos de perforación (“punto por punto” vs “horizontal”), refiriéndose a la trayectoria enrutada de la broca. Inicialmente, se perforan ocho puntos de “semilla” (Figura 1A), delineando la ventana craneal. A partir de aquí, el espacio entre las semillas se corta utilizando el método de perforación “punto por punto” u “horizontal”. “Punto por punto” realiza cortes verticales de orificios piloto (similares a una prensa de perforación CNC), mientras que “horizontal” realiza cortes horizontales a lo largo de la circunferencia de la ventana craneal que delinea el orificio (similar a un enrutador CNC). El resultado para ambos métodos es un pedazo de cráneo que se puede quitar para revelar la ventana craneal. Para aislar el daño de la perforación, la ventana craneal no se retira físicamente, a fin de evitar cualquier daño adicional. Se utiliza una combinación de colorante EB junto con imágenes fluorescentes para medir la permeabilidad BBB después de realizar craneotomías en ratones, y un termopar insertado se utiliza para medir directamente la temperatura de la superficie cerebral durante la perforación (Figura 1B, C). Observaciones anteriores indicaron que la perforación pulsada encendido / apagado con intervalos de 2 s fue suficiente para mitigar el calentamiento de la perforación25, y por lo tanto se incorpora al enfoque experimental para el robot quirúrgico.
La intención del trabajo presentado es demostrar métodos para evaluar el daño térmico de la perforación de craneotomía. Si bien los métodos se presentan en el contexto de la perforación automatizada, dichos métodos también se pueden aplicar a los esquemas de perforación manual. Estos métodos se pueden utilizar para validar el uso de equipos y / o esquemas de perforación antes de adoptarlos como procedimiento estándar.
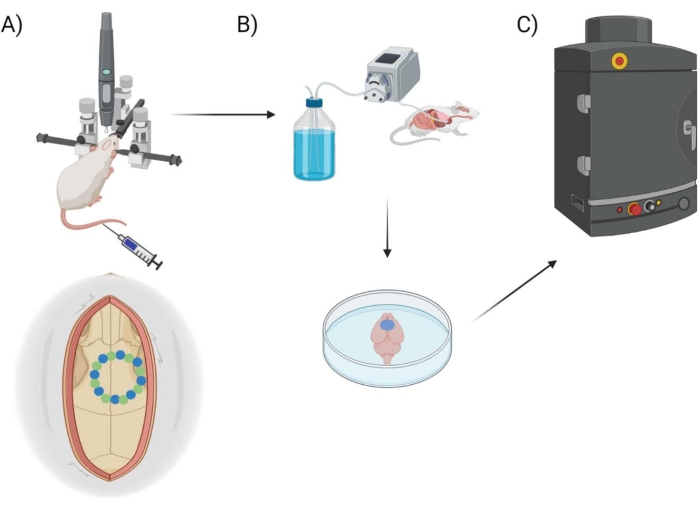
Figura 1: Esquema experimental de tuberías. Esquema que demuestra el proceso al que se sometieron los animales para el procedimiento de cuantificación de EB después de la ventana craneal. (A) Configuración esquemática del ratón con el marco estereotáxico y el taladro quirúrgico del robot. Un ejemplo de ventana craneal se muestra sobre la corteza motora con puntos semilla (verde) y puntos de borde (azul). (B) La configuración de perfusión incluye inyectar 1x solución salina tamponada con fosfato (PBS) en todo el animal para eliminar cualquier sangre, seguida de la extracción del cerebro. (C) Luego, el cerebro se coloca en la cámara del sistema de imágenes fluorescentes EB para realizar imágenes fluorescentes en el tinte Evans Blue. Haga clic aquí para ver una versión más grande de esta figura.
Protocol
Representative Results
Discussion
El uso del tinte EB y las imágenes es sencillo, rápido y útil para evaluar el daño vascular en el cerebro para nuevos métodos y técnicas. Ya sea utilizando un robot quirúrgico o confirmando los métodos que se realizan actualmente en el laboratorio, es importante validar los métodos quirúrgicos para aislar los efectos de los tratamientos experimentales frente al impacto quirúrgico y mejorar el bienestar animal. Una configuración de termopar también es útil para evaluar los métodos de perforación para garan…
Declarações
The authors have nothing to disclose.
Acknowledgements
Este estudio fue apoyado en parte por los premios de revisión de mérito GRANT12418820 (Capadona) y GRANTI01RX003420 (Shoffstall / Capadona), y el Premio al Científico de Carrera de Investigación # GRANT12635707 (Capadona) del Servicio de Investigación y Desarrollo de Rehabilitación del Departamento de Asuntos de Veteranos de los Estados Unidos (EE. Además, este trabajo también fue apoyado en parte por el Instituto Nacional de Salud, el Instituto Nacional de Trastornos Neurológicos y Accidentes Cerebrovasculares GRANT12635723 (Capadona) y el Instituto Nacional de Imágenes Biomédicas y Bioingeniería, T32EB004314, (Capadona / Kirsch). Este material se basa en el trabajo apoyado por la National Science Foundation Graduate Research Fellowship bajo la subvención No. GRANT12635723. Cualquier opinión, hallazgo, conclusión o recomendación expresada en este material son las de los autores y no reflejan necesariamente los puntos de vista de la National Science Foundation.
Materials
| 1x Phosphate Buffered Saline Type: Reagent |
VWR | MRGF-6235 | For Evans Blue dilution |
| Aura Software Type: Tool |
Spectral Instruments Imaging | Open access imaging processing software for Lumina imaging sytems | |
| Buprenorphine Type: Drug |
Sourced from Animal Facility | ||
| Carbide Drill Bit, 0.6mm (Robot Drill) Type: Tool |
Stoelting | 58640-1 | |
| Carprofen Type: Drug |
Sourced from Animal Facility | ||
| Cefazolin Type: Drug |
Sourced from Animal Facility | ||
| Evans Blue Dye Type: Reagent |
Millipore Sigma | E2129 | Reconstituted in 1x phosphate-buffered saline |
| Isoflurane Type: Drug |
Sourced from Animal Facility | ||
| IVIS Lumina II Type: Tool |
Perkin Elmer | CLS136334 | IVIS Lumina III currently in place of Lumina II on the market |
| Jenco Linearizing Thermometer Type: Tool |
Jenco | 765JF | For Thermocouple setup |
| Ketamine Type: Drug |
Sourced from Animal Facility | ||
| LivingImage Type: Tool |
Perkin Elmer | Software for IVIS Lumina III | |
| Marcaine Type: Drug |
Sourced from Animal Facility | ||
| Neurostar Software Type: Tool |
Stoelting | Comes with surgical robot purchase | |
| Physiosuite with MouseSTAT® Pulse Oximeter & Heart Rate Monitor Type: Tool |
Kent Scientific | PS-03 | Used to monitor vitals |
| PrismPlus mice Type: Animal |
Jackson Labortory | 031478, RRID:IMSR_JAX:031478, Male, ~8 months old | Animals used for the study |
| Stoelting Drill and Injection Robot for Motorized Stereotaxic Instruments Type: Tool |
Stoelting | 58640 | Main robotic drill with stereotaxic frame |
| Thermocouple Type: Tool |
TC Direct | 206-557 | For Thermocouple setup |
| USB-6008 Multifunction I/O DAQ Type: Tool |
National Instruments | USB-6008 | For Thermocouple setup |
| Xylazine Type: Drug |
Sourced from Animal Facility |
Referências
- Kilic, K., et al. Chronic cranial windows for long term multimodal neurovascular imaging in mice. Frontiers in Physiology. 11, 612678 (2020).
- Goldey, G. J., et al. Removable cranial windows for long-term imaging in awake mice. Nature Protocols. 9 (11), 2515-2538 (2014).
- Augustinaite, S., Kuhn, B. Intrinsic optical signal imaging and targeted injections through a chronic cranial window of a head-fixed mouse. STAR Protocols. 2 (3), 100779 (2021).
- Wang, X., et al. A skull-removed chronic cranial window for ultrasound and photoacoustic imaging of the rodent brain. Frontiers in Neuroscience. 15, 673740 (2021).
- Wang, Y., Xi, L. Chronic cranial window for photoacoustic imaging: a mini review. Visual Computing for Industry, Biomedicine, and Art. 4 (1), 15 (2021).
- Augustinaite, S., Kuhn, B. Chronic cranial window for imaging cortical activity in head-fixed mice. STAR Protocols. 1 (3), 100194 (2020).
- Kunori, N., Takashima, I. An implantable cranial window using a collagen membrane for chronic voltage-sensitive dye imaging. Micromachines. 10 (11), 789 (2019).
- Beckmann, L., et al. Longitudinal deep-brain imaging in mouse using visible-light optical coherence tomography through chronic microprism cranial window. Biomedical Optics Express. 10 (10), 5235-5250 (2019).
- Heo, C., et al. A soft, transparent, freely accessible cranial window for chronic imaging and electrophysiology. Scientific Reports. 6, 27818 (2016).
- Holtmaat, A., et al. Imaging neocortical neurons through a chronic cranial window. Cold Spring Harbor Protocols. 2012 (6), 694-701 (2012).
- Holtmaat, A., et al. high-resolution imaging in the mouse neocortex through a chronic cranial window. Nature Protocols. 4 (8), 1128-1144 (2009).
- Sundaram, G. S., et al. Characterization of a brain permeant fluorescent molecule and visualization of Abeta parenchymal plaques, using real-time multiphoton imaging in transgenic mice. Organic Letters. 16 (14), 3640-3643 (2014).
- Spires, T. L., et al. Dendritic spine abnormalities in amyloid precursor protein transgenic mice demonstrated by gene transfer and intravital multiphoton microscopy. Journal of Neuroscience. 25 (31), 7278-7287 (2005).
- Price, D. L., et al. High-resolution large-scale mosaic imaging using multiphoton microscopy to characterize transgenic mouse models of human neurological disorders. Neuroinformatics. 4 (1), 65-80 (2006).
- Kimchi, E. Y., Kajdasz, S., Bacskai, B. J., Hyman, B. T. Analysis of cerebral amyloid angiopathy in a transgenic mouse model of Alzheimer disease using in vivo multiphoton microscopy. Journal of Neuropathology and Experimental Neurology. 60 (3), 274-279 (2001).
- Hyman, B. T. The natural history of Alzheimer disease dissected through multiphoton imaging of transgenic mice. Alzheimer Disease and Associated Disorders. 20 (4), 206-209 (2006).
- Korzhova, V., et al. Long-term dynamics of aberrant neuronal activity in awake Alzheimer’s disease transgenic mice. Communications Biology. 4 (1), 1368 (2021).
- Chawda, C., McMorrow, R., Gaspar, N., Zambito, G., Mezzanotte, L. Monitoring immune cell function through optical imaging: a review highlighting transgenic mouse models. Molecular Imaging and Biology. 24 (2), 250-263 (2022).
- Courtin, J., et al. A neuronal mechanism for motivational control of behavior. Science. 375 (6576), (2022).
- Mostany, R., Portera-Cailliau, C. A craniotomy surgery procedure for chronic brain imaging. Journal of Visualized Experiments. (12), e680 (2008).
- Cramer, S. W., et al. Through the looking glass: A review of cranial window technology for optical access to the brain. Journal of Neuroscience Methods. 354, 109100 (2021).
- Eles, J. R., Vazquez, A. L., Kozai, T. D. Y., Cui, X. T. Meningeal inflammatory response and fibrous tissue remodeling around intracortical implants: An in vivo two-photon imaging study. Biomaterials. 195, 111-123 (2019).
- Jorfi, M., Skousen, J. L., Weder, C., Capadona, J. R. Progress towards biocompatible intracortical microelectrodes for neural interfacing applications. Journal of Neural Engineering. 12 (1), 011001 (2015).
- Cole, J. T., et al. Craniotomy: true sham for traumatic brain injury, or a sham of a sham. Journal of Neurotrauma. 28 (3), 359-369 (2011).
- Shoffstall, A. J., et al. Potential for thermal damage to the blood-brain barrier during craniotomy: implications for intracortical recording microelectrodes. Journal of Neural Engineering. 15 (3), 034001 (2018).
- Saunders, N. R., Dziegielewska, K. M., Mollgard, K., Habgood, M. D. Markers for blood-brain barrier integrity: how appropriate is Evans blue in the twenty-first century and what are the alternatives. Frontiers in Neuroscience. 9, 385 (2015).
- Wang, H. L., Lai, T. W. Optimization of Evans blue quantitation in limited rat tissue samples. Scientific Reports. 4, 6588 (2014).
- Goss-Varley, M., et al. Microelectrode implantation in motor cortex causes fine motor deficit: Implications on potential considerations to Brain Computer Interfacing and Human Augmentation. Scientific Reports. 7 (1), 15254 (2017).
- Oomoto, I., et al. Protocol for cortical-wide field-of-view two-photon imaging with quick neonatal adeno-associated virus injection. STAR Protocols. 2 (4), 101007 (2021).
- Dougherty, J. D., Zhang, J., Feng, H., Gong, S., Heintz, N. Mouse transgenesis in a single locus with independent regulation for multiple fluorophores. PLoS One. 7 (7), 40511 (2012).
- Jung, S., et al. Analysis of fractalkine receptor CX(3)CR1 function by targeted deletion and green fluorescent protein reporter gene insertion. Molecular and Cellular Biology. 20 (3), 4106-4114 (2000).
- Kiyatkin, E. A., Sharma, H. S. Permeability of the blood-brain barrier depends on brain temperature. Neurociência. 161 (3), 926-939 (2009).
- Eriksson, A. R., Albrektsson, T. Temperature threshold levels for heat-induced bone tissue injury: a vital-microscopic study in the rabbit. The Journal of Prosthetic Dentistry. 50 (1), 101-107 (1983).
- Bonfield, W., Li, C. H. The temperature dependence of the deformation of bone. Journal of Biomechanics. 1 (4), 323-329 (1968).
- Hrapkiewicz, K., Medina, L. . Clinical Laboratory Animal Medicine, second ed. , (2007).
- McLean, R., Moritz, A. R., Roos, A. Studies of thermal Injury. VI. Hyperpotassemia caused by cutaneous exposure to excessive heat. Journal of Clinical Investigations. 26 (3), 497-504 (1947).
- Kyweriga, M., Sun, J., Wang, S., Kline, R., Mohajerani, M. H. A large lateral craniotomy procedure for mesoscale wide-field optical imaging of brain activity. Journal of Visualized Experiments. (123), e52642 (2017).

