4.2:
Reagente limitante
4.2:
Reagente limitante
Le quantità relative di reagenti e prodotti rappresentati in un’equazione chimica bilanciata sono spesso indicate come quantità stechiometriche. Tuttavia, in realtà, i reagenti non sono sempre presenti nelle quantità stechiometriche indicate dall’equazione bilanciata.
In una reazione chimica, il reagente che viene consumato per primo e limita la quantità di prodotto formato, è il reagente limitante, mentre l’altra sostanza diventa il reagente in eccesso. Un eccesso di uno o più reagenti viene spesso utilizzato per garantire la conversione completa dell’altro reagente nel prodotto.
Si consideri la reazione per la formazione di acqua rappresentata dall’equazione:
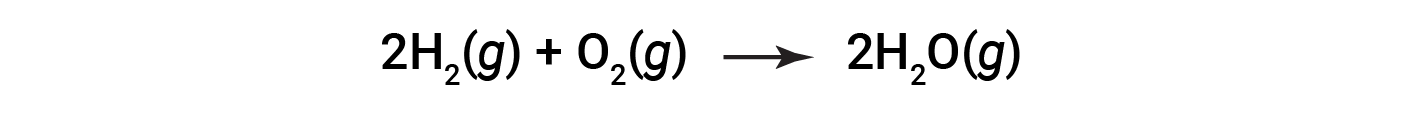
L’equazione bilanciata mostra che idrogeno e ossigeno reagiscono in un rapporto stechiometrico 2:1. Se questi reagenti sono forniti in qualsiasi altra quantità, uno dei reagenti sarà quasi sempre interamente consumato, limitando così la quantità di prodotto che può essere generata. Questa sostanza è il reagente limitante e l’altra sostanza è l’eccesso di reagente. Identificare i reagenti limitanti ed in eccesso per una data situazione richiede il calcolo delle quantità molare di ciascun reagente fornito e il confronto con le quantità stechiometriche rappresentate nell’equazione chimica bilanciata.
La stechiometria indica che due talpe di idrogeno e una talpa di ossigeno reagiscono per produrre due talpe d’acqua; cioè, idrogeno e ossigeno si combinano in un rapporto 2:1. Immaginate se siano presenti 5 talpe di idrogeno e 2 talpe di ossigeno. Il rapporto dei reagenti è ora 5:2 (o 2,5:1), che è maggiore del rapporto stechiometrico di 2:1. L’idrogeno, quindi, è presente in eccesso, e l’ossigeno è il reagente limitante. La reazione di tutto l’ossigeno fornito (2 mol) consumerà 4 mol dei 5 mol di idrogeno forniti, lasciando inattonato 1 mol di idrogeno. Calcolare le quantità molare di ogni reagente fornito e confrontarle con le quantità stechiometriche rappresentate nell’equazione chimica bilanciata è un modo per identificare il reagente limitante ed in eccesso.
Un approccio alternativo consiste nel calcolare la quantità di prodotto formato in talpe da ciascun reagente, secondo la stechiometria della reazione, e quindi confrontare le quantità. Il reagente che produce una minore quantità di talpe di prodotto è il reagente limitante. Ad esempio, la reazione completa di cinque talpe di idrogeno produrrebbe:

Allo stesso modo, la reazione completa di due talpe di ossigeno produrrebbe:

L’ossigeno produce meno talpe d’acqua, e quindi l’ossigeno è il reagente limitante. L’ossigeno sarà completamente consumato una volta prodotte 4talpe diH 2 O. La stechiometria tra idrogeno e ossigeno è 2:1, quattro talpe di idrogeno sono necessarie per reagire con due talpe di ossigeno.

Così, (5 mol H2 − 4 mol H2 = 1 mol H2), una talpa di idrogeno non reagiscito rimarrà una volta completata questa reazione.
Questo testo è adattato da OpenStax, Chemistry 2e, Section 4.4: Reaction Yield.
