11.14:
Strutture dei solidi
11.14:
Strutture dei solidi
I solidi in cui gli atomi, gli ioni o le molecole sono disposti in uno schema ripetuto definito sono noti come solidi cristallini. Metalli e composti ionici in genere formano solidi cristallini ordinati. Un solido cristallino ha una temperatura di fusione precisa perché ogni atomo o molecola dello stesso tipo è tenuto in posizione con le stesse forze o energia. Solidi amorfo o solidi non cristallini (o, a volte, occhiali) che mancano di una struttura interna ordinata e sono disposti casualmente. Le sostanze che consistono di grandi molecole, o una miscela di molecole i cui movimenti sono più limitati, spesso formano solidi amorfo. Il materiale amorfo subisce un graduale ammorbidimento, su una gamma di temperature, a causa della non equivalenza strutturale delle molecole. Quando un materiale amorfo viene riscaldato, le attrazioni intermolecolari più deboli si rompono per prime. Man mano che la temperatura aumenta ulteriormente, le attrazioni più forti sono rotte.
Cella unitaria
La struttura di un solido cristallino è meglio descritta dalla sua unità ripetuta più semplice, indicata come la sua cella unitaria. La cella unitaria è costituita da punti del reticolo che rappresentano le posizioni di atomi o ioni. L’intera struttura è quindi costituita da questa cella unitaria che si ripete in tre dimensioni, come illustrato nella figura 1.
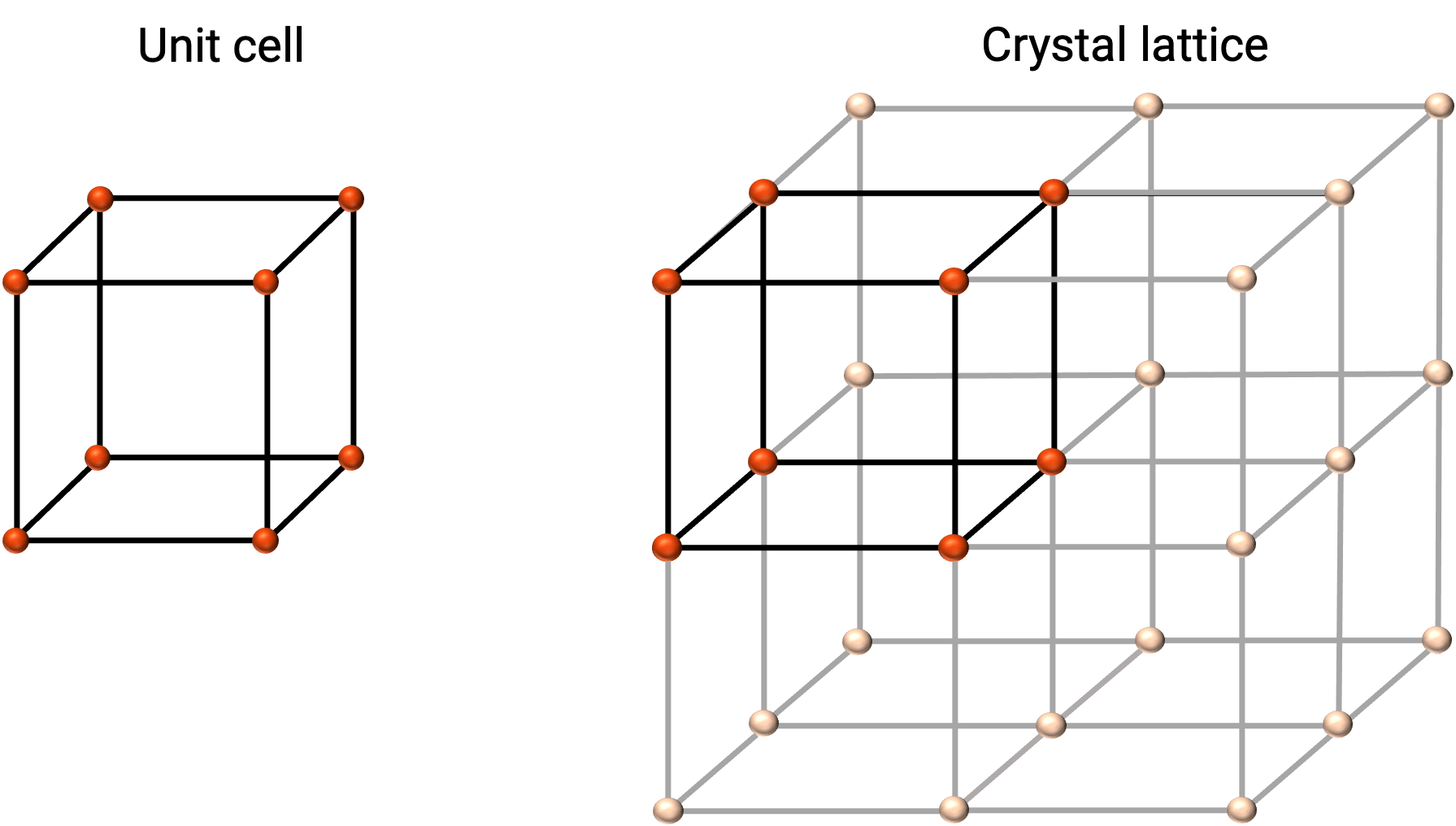
Figura 1. Cella unitaria e reticolo cristallino con punti reticolari indicati in rosso.
In generale, una cella unitaria è definita dalle lunghezze di tre assi (a, be c) e dagli angoli (α, βe γ) tra di essi, come illustrato nella figura 2. Gli assi sono definiti come le lunghezze tra i punti nel reticolo spaziale.
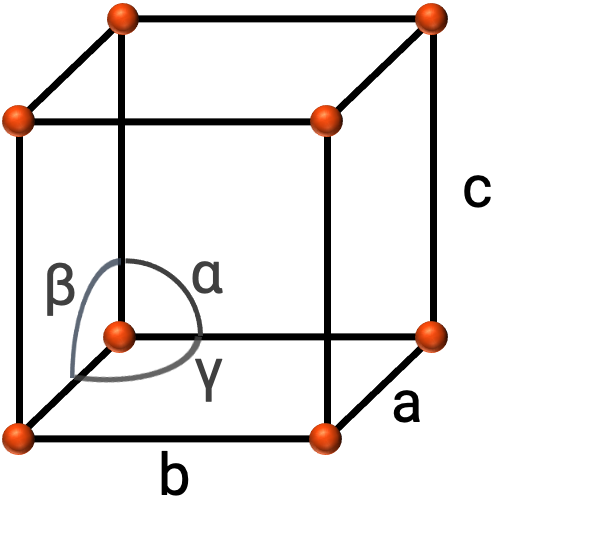
Figura 2. La cella unitaria è definita dai relativi assi (a, be c) e dagli angoli (α, βe γ)
Ci sono sette diversi sistemi reticolari, alcuni dei quali hanno più di un tipo di reticolo, per un totale di quattordici diverse celle unitarie.
| Sistemi | Angoli | Assi |
| Cubi | α = β = γ = 90° | a = b = c |
| Tetragonale | α = β = γ = 90° | a = b ≠ c |
| Ortorombica | α= β = γ = 90° | a ≠ b ≠ c |
| Monoclinico | α = γ = 90°; β ≠ 90° | a ≠ b ≠ c |
| Trilinico | α ≠ β ≠ γ ≠ 90° | a ≠ b ≠ c |
Questo testo è adattato da Openstax, Chemistry 2e, Section 10.6: Lattice Structures in Crystalline Solids.
