11.14:
Estruturas de Sólidos
11.14:
Estruturas de Sólidos
Sólidos nos quais os átomos, iões, ou moléculas estão dispostos em um padrão repetitivo definido são conhecidos como sólidos cristalinos. Metais e compostos iónicos formam normalmente sólidos cristalinos. Um sólido cristalino tem uma temperatura de fusão precisa porque cada átomo ou molécula do mesmo tipo é mantida no lugar com as mesmas forças ou energia. Sólidos amorfos ou sólidos não cristalinos (ou, às vezes, vidros) não possuem uma estrutura interna ordenada e estão dispostos aleatoriamente. Substâncias constituídas por moléculas grandes, ou uma mistura de moléculas cujos movimentos são mais restritos, formam muitas vezes sólidos amorfos. O material amorfo sofre amolecimento gradual, em uma gama de temperaturas, devido à não equivalência estrutural das moléculas. Quando um material amorfo é aquecido, as atrações intermoleculares mais fracas quebram primeiro. À medida que a temperatura aumenta, as atrações mais fortes são quebradas.
Célula Unitária
A estrutura de um sólido cristalino é melhor descrita pela sua unidade repetitiva mais simples, chamada de célula unitária. A célula unitária consiste em pontos reticulares que representam as localizações de átomos ou iões. Toda a estrutura consiste então nesta célula unitária que se repete em três dimensões, como ilustrado na Figura 1.
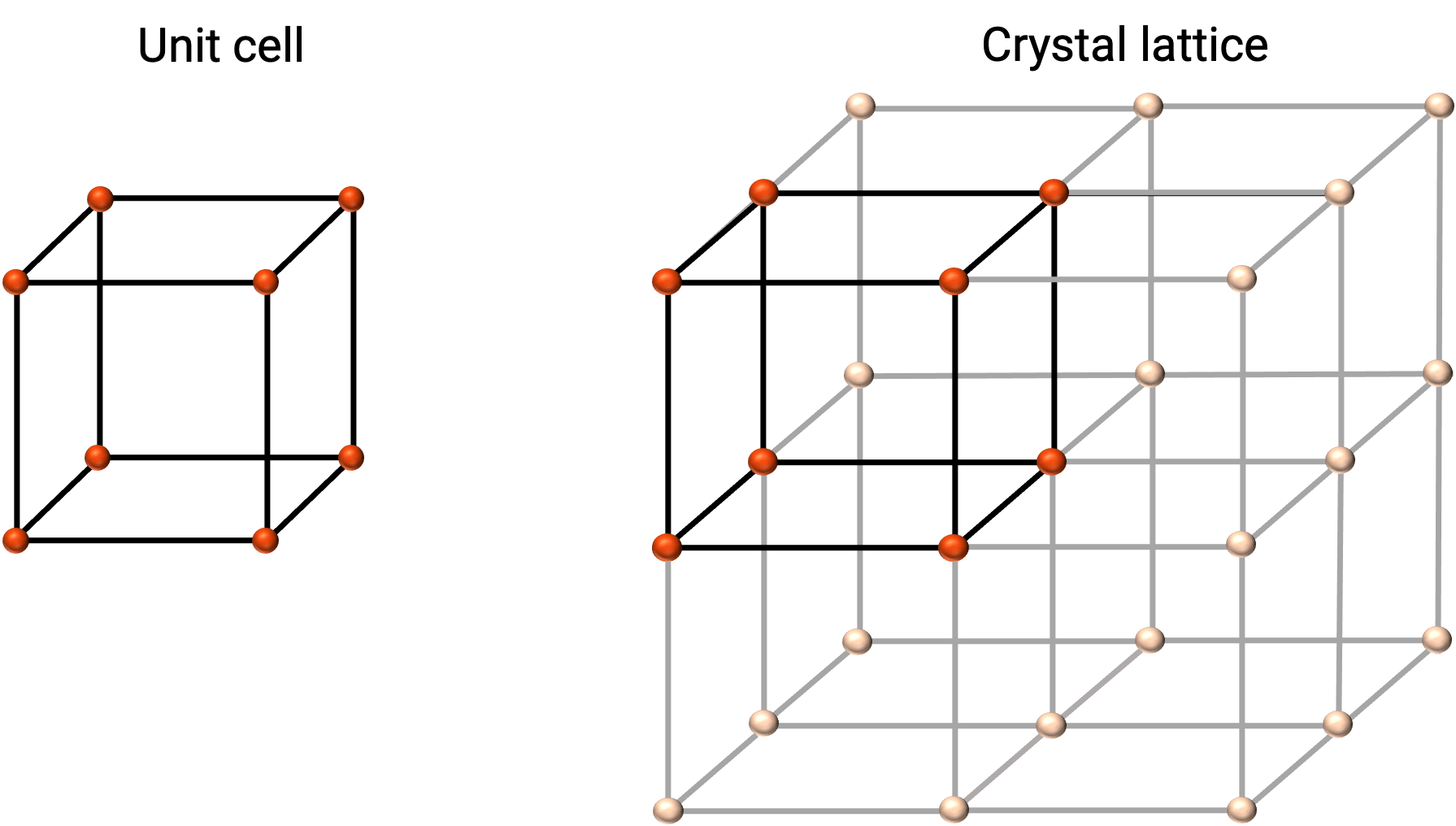
Figura 1. Célula unitária e retículo de cristal com pontos reticulares indicados a vermelho.
No geral, uma célula unitária é definida pelos comprimentos de três eixos (a, b e c) e pelos ângulos (α, β, e γ) entre eles, como mostra a Figura 2. Os eixos são definidos como sendo os comprimentos entre os pontos no espaço reticular.
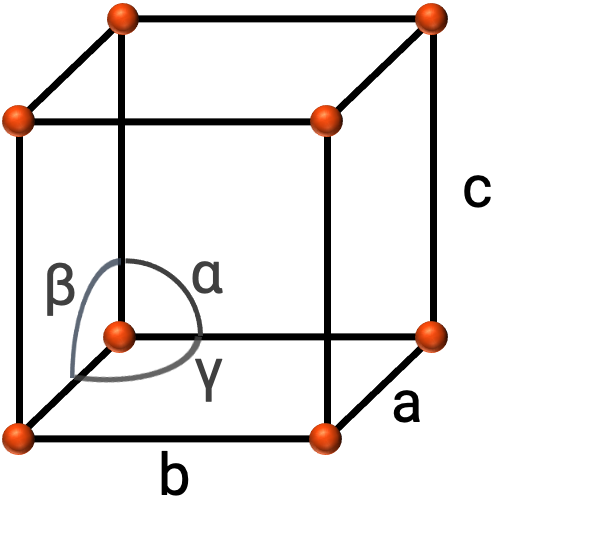
Figura 2. A célula unitária é definida pelos seus eixos (a, b, e c) e ângulos (α, β, e γ)
Existem sete sistemas reticulares diferentes, alguns dos quais têm mais de um tipo de malha, para um total de catorze células unitárias diferentes.
| Sistemas | Ângulos | Eixos |
| Cúbico | α = β = γ = 90° | a = b = c |
| Tetragonal | α = β = γ = 90° | a = b ≠ c |
| Ortorrômbico | α= β = γ = 90° | a ≠ b ≠ c |
| Monoclínico | α = γ = 90°; β ≠ 90° | a ≠ b ≠ c |
| Triclínico | α ≠ β ≠ γ ≠ 90° | a ≠ b ≠ c |
Este texto é adaptado de Openstax, Chemistry 2e, Section 10.6: Lattice Structures in Crystalline Solids.
