13.8:
مخطّطات أرهينيوس
13.8:
مخطّطات أرهينيوس
تتعلق معادلة أرهينيوس بطاقة التنشيط وثابت المعدل، k، للتفاعلات الكيميائية. في معادلة أرهينيوس ، k = Ae−Ea/RT, R هو ثابت الغاز المثالي، الذي تبلغ قيمته8.314 J/mol·K ، T هي درجة الحرارة على مقياس كلفن، Ea هي طاقة التنشيط في جول/مول، e هي الثابت 2.7183، و A هو ثابت يسمى عامل التردد، والذي يرتبط بتكرار التصادمات واتجاه الجزيئات المتفاعلة.
يمكن استخدام معادلة أرهينيوس لحساب طاقة التنشيط لتفاعل من البيانات الحركية التجريبية. تتضمن الطريقة الملائمة لتحديد Ea للتفاعل قياس k عند درجتين أو أكثر من درجات الحرارة المختلفة. يستخدم نسخة معدلة من معادلة أرهينيوس التي تأخذ شكل معادلة خطية:
p style=”text-align: center”>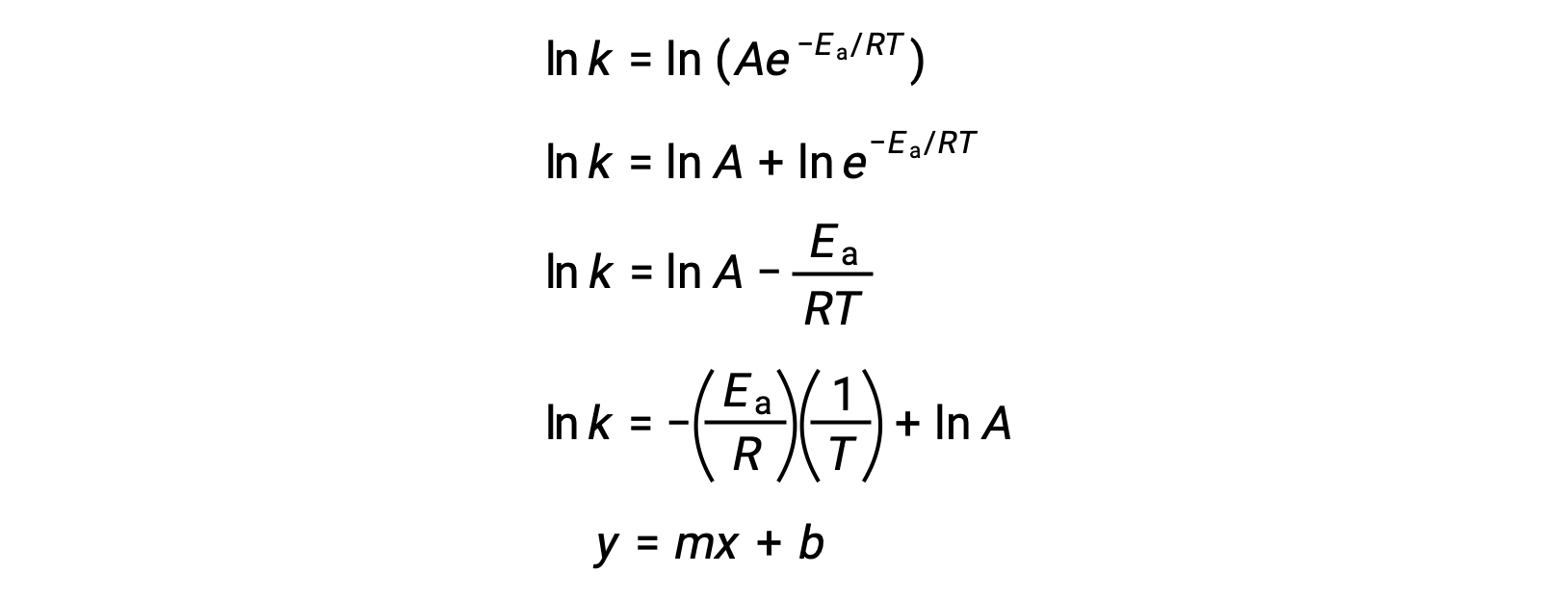
مخطط ln k مقابل 1/T هو خطي بميل يساوي −Ea/R وتقاطع يساوي ln A.
ضع في اعتبارك التفاعل التالي:
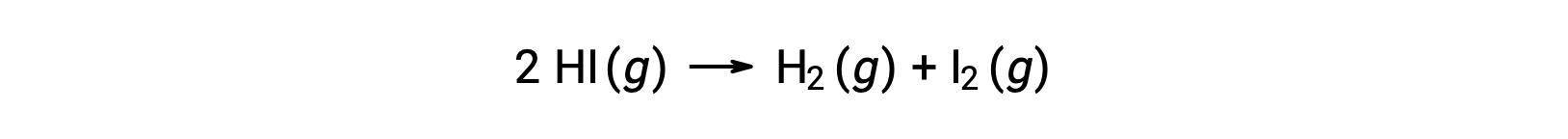
يمكن تحديد طاقة التنشيط لهذا التفاعل إذا كان التباين في معدل ثابت مع درجة الحرارة معروفًا من البيانات الحركية للتفاعل، كما هو موضح.
| درجة الحرارة (K) | Rate constant (L/mol/s) |
| 555 | 3.52 × 10–7 |
| 575 | 1.22 × 10–6 |
| 645 | 8.59 × 10–5 |
| 700 | 1.16 × 10–3 |
| 781 | 3.95 × 10–2 |
يمكن استخدام البيانات المقدمة لاشتقاق قيم معكوس درجة الحرارة (1/T) واللوغاريثم الطبيعي لـ k (ln k).
| 1/T (K–1) | ln k |
| 1.80 × 10–3 | –14.860 |
| 1.74 × 10–3 | –13.617 |
| 1.55 × 10–3 | –9.362 |
| 1.43 × 10–3 | –6.759 |
| 1.28 × 10–3 | –3.231 |
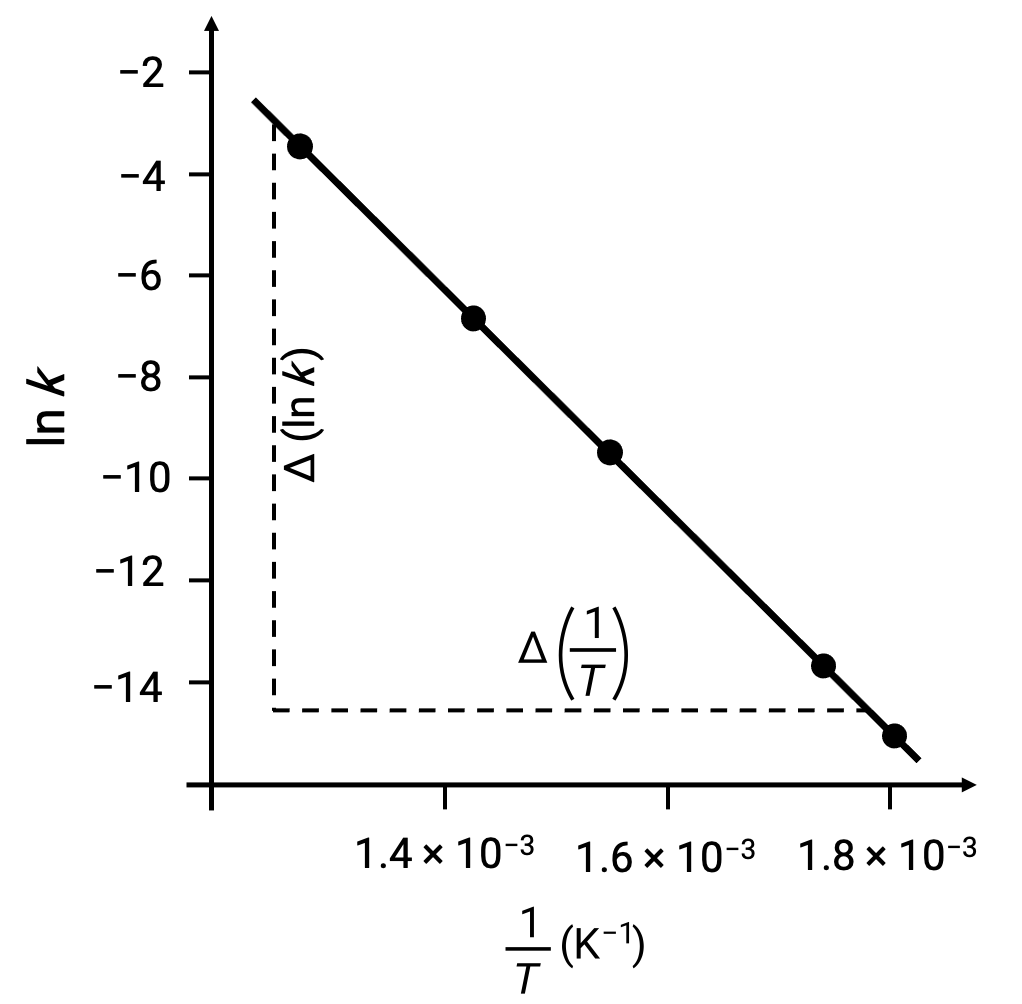
عند رسم نقاط البيانات المشتقة باستخدام ln k مقابل 1/T، يتم إنشاء بيان خطّي يعرض علاقة خطية بينln k و 1/T، كما هو موضح.
يمكن تقدير ميل الخط الذي يتوافق مع طاقة التنشيط باستخدام أي زوج من أزواج البيانات التجريبية.

تتضمن الطريقة البديلة في اشتقاق طاقة التنشيط استخدام معدل ثابت عند درجتي حرارة مختلفتين. في هذا النهج، يتم إعادة ترتيب معادلة أرهينيوس إلى شكل مناسب من نقطتين:
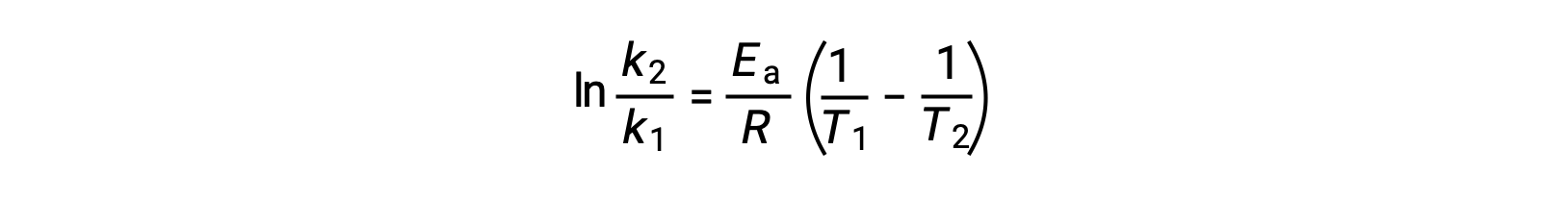
عند إعادة ترتيب المعادلة، يتم إنشاء تعبير عن طاقة التنشيط.
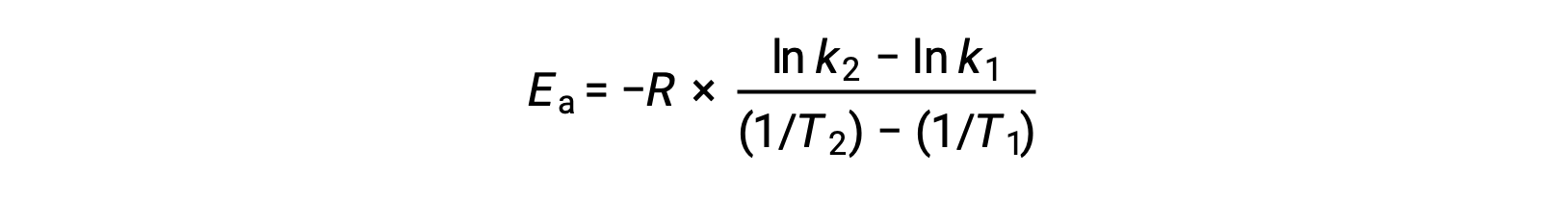
من خلال استبدال أي زوجي بيانات وإجراء المزيد من العمليات الحسابية ، ينتج عن ذلك قيمة طاقة التنشيط بالجول لكل مول أو الكيلوجول لكل مول.
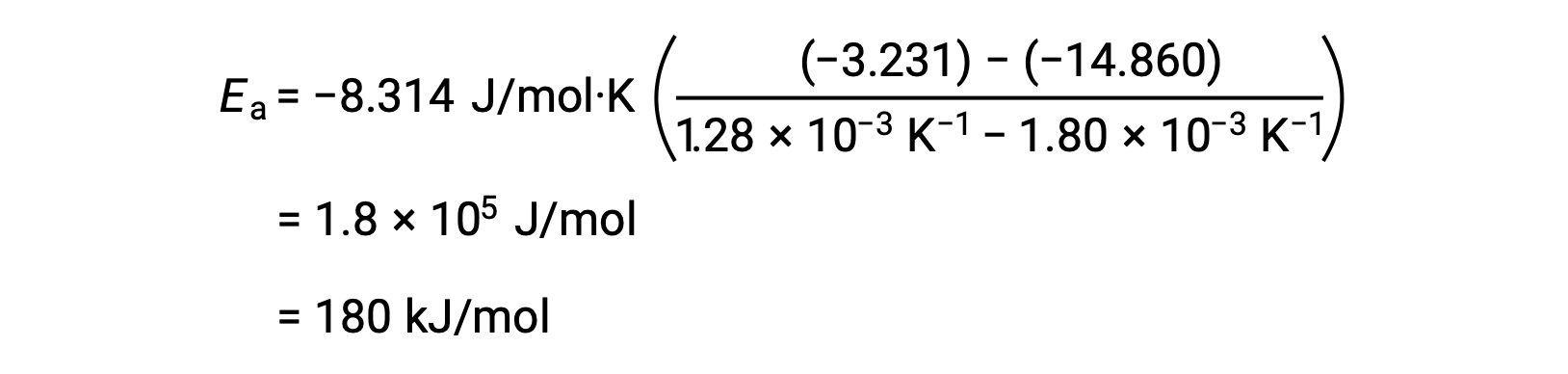
ينتج عن هذا النهج البديل المكون من نقطتين نفس نتيجة النهج الرسومي. ومع ذلك، من الناحية العملية، عادةً ما يوفر النهج الرسمي نتائج أكثر موثوقية أثناء العمل مع البيانات التجريبية الفعلية.
هذا النص مقتبس من Openstax, Chemistry 2e, Section 12.5: Collision Theory.
