13.8:
Diagramma di Arrhenius
13.8:
Diagramma di Arrhenius
L’equazione di Arrhenius mette in relazione l’energia di attivazione e la costante di velocità, k, per le reazioni chimiche. Nell’equazione di Arrhenius, k = Ae−Ea/RT, R è la costante di gas ideale, che ha un valore di 8,314 J/mol· K, T è la temperatura sulla scala kelvin, Ea è l’energia di attivazione in J/mole, e è la costante 2.7183, e A è una costante chiamata fattore di frequenza, che è correlata alla frequenza delle collisioni e all’orientamento delle molecole reagenti.
L’equazione di Arrhenius può essere usata per calcolare l’energia di attivazione di una reazione da dati cinetici sperimentali. Un approccio conveniente per determinare la Ea per una reazione comporta la misurazione di k a due o più temperature diverse. Usa una versione modificata dell’equazione di Arrhenius che assume la forma di un’equazione lineare:
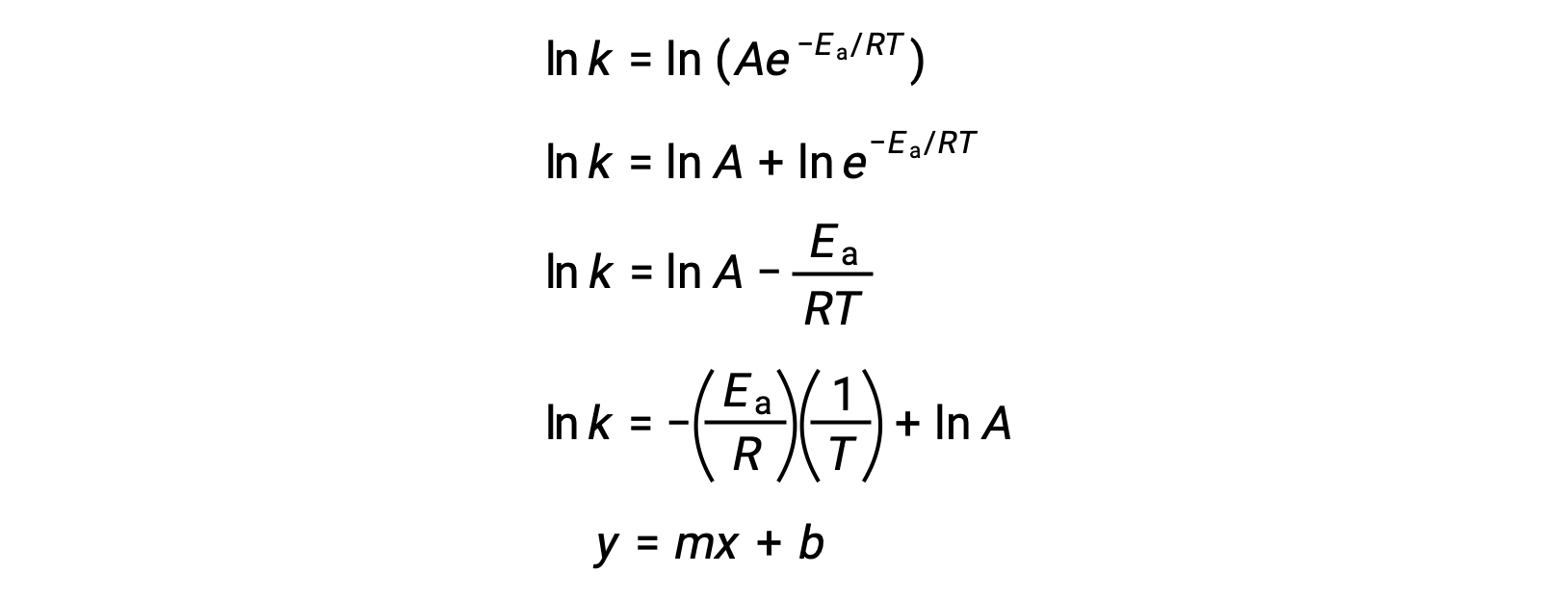
Un grafico di ln k contro 1/T è lineare con una pendenza uguale a −Ea/R e intercetta y uguale a ln A.
Si consideri la seguente reazione:
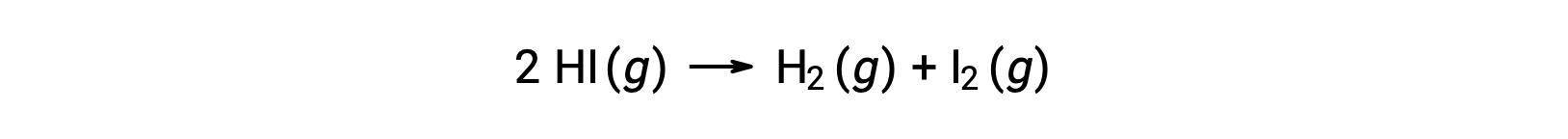
L’energia di attivazione di questa reazione può essere determinata se la variazione della costante di velocità con la temperatura è nota dai dati cinetici di reazione, come mostrato.
| Temperatura (K) | Costante di velocità (L/mol/s) |
| 555 | 3.52 × 10–7 |
| 575 | 1.22 × 10–6 |
| 645 | 8.59 × 10–5 |
| 700 | 1.16 × 10–3 |
| 781 | 3.95 × 10–2 |
I dati forniti possono essere utilizzati per ricavare i valori dell’inverso della temperatura (1/T)e del log naturale di k (ln k).
| 1/T (K–1) | Ln k |
| 1,80 × 10–3 | –14.860 |
| 1.74 × 10–3 | –13.617 |
| 1,55 × 10–3 | –9.362 |
| 1.43 × 10–3 | –6.759 |
| 1.28 × 10–3 | –3.231 |
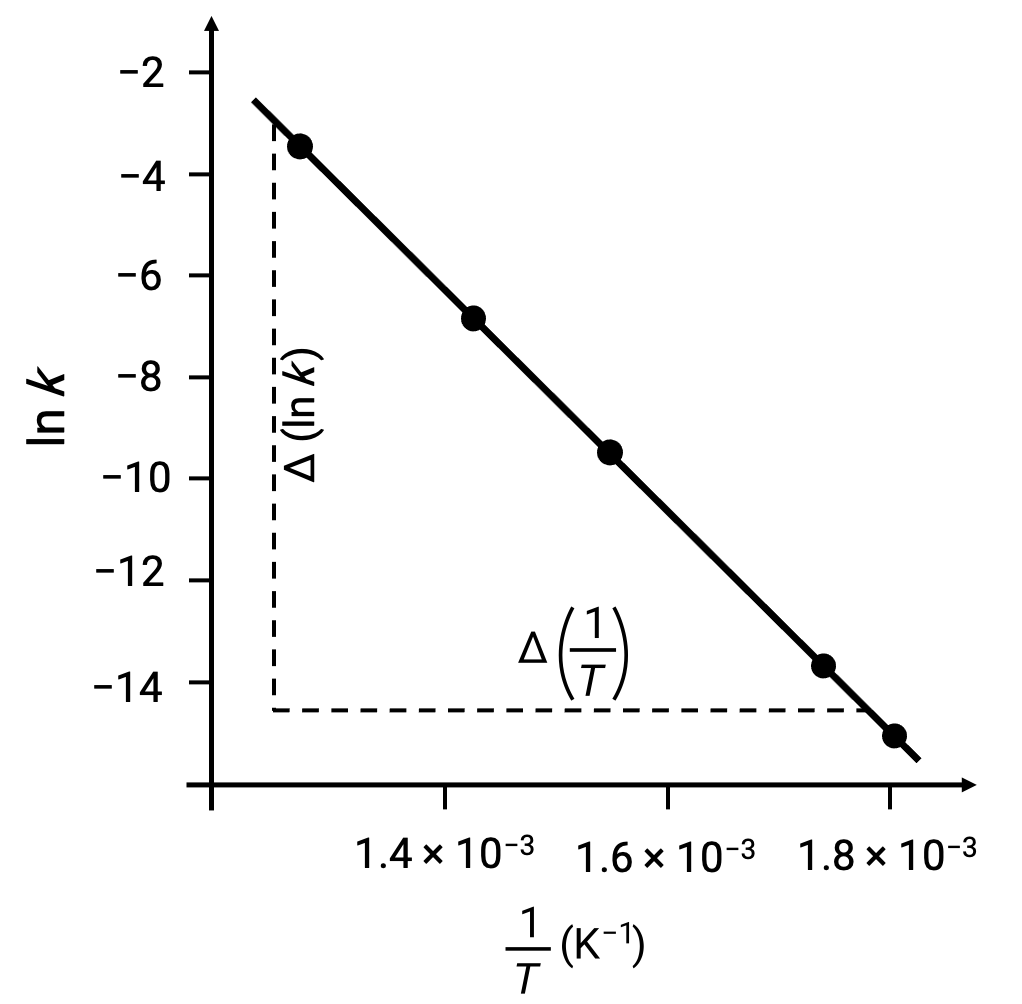
Nel tracciare i punti dati derivati con ln k rispetto a 1/T, viene generato un grafico di linea che mostra una relazione lineare tra ln k e 1/T, come mostrato.
La pendenza della linea, che corrisponde all’energia di attivazione, può essere stimata utilizzando due delle coppie di dati sperimentali.

Un approccio alternativo nella derivazione dell’energia di attivazione comporta l’utilizzo della costante di velocità a due diverse temperature. In questo approccio, l’equazione di Arrhenius è riorganizzata in una comoda forma a due punti:
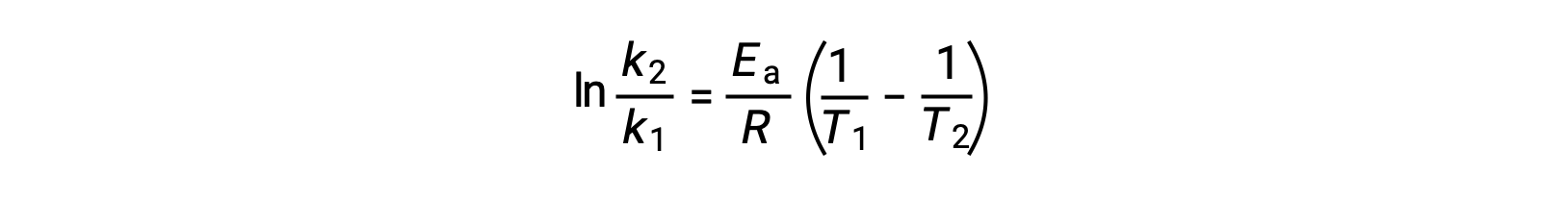
Quando si riorganizza l’equazione, viene generata un’espressione per l’energia di attivazione.
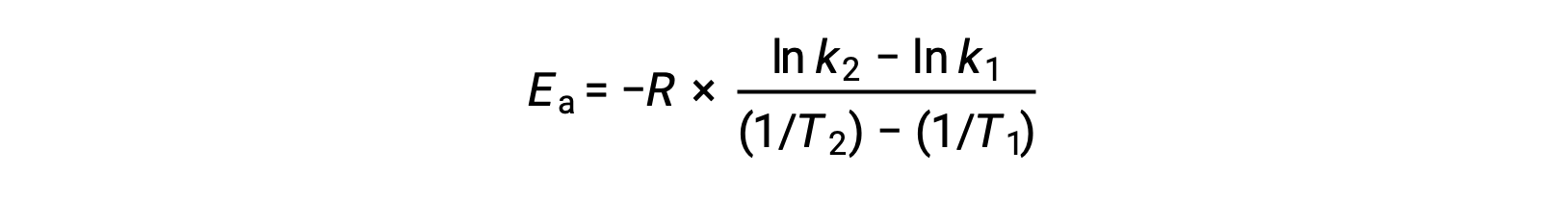
Sostituendo due coppie di dati e ulteriori calcoli si ottiene il valore dell’energia di attivazione in joule per talpa o kilojoule per talpa.
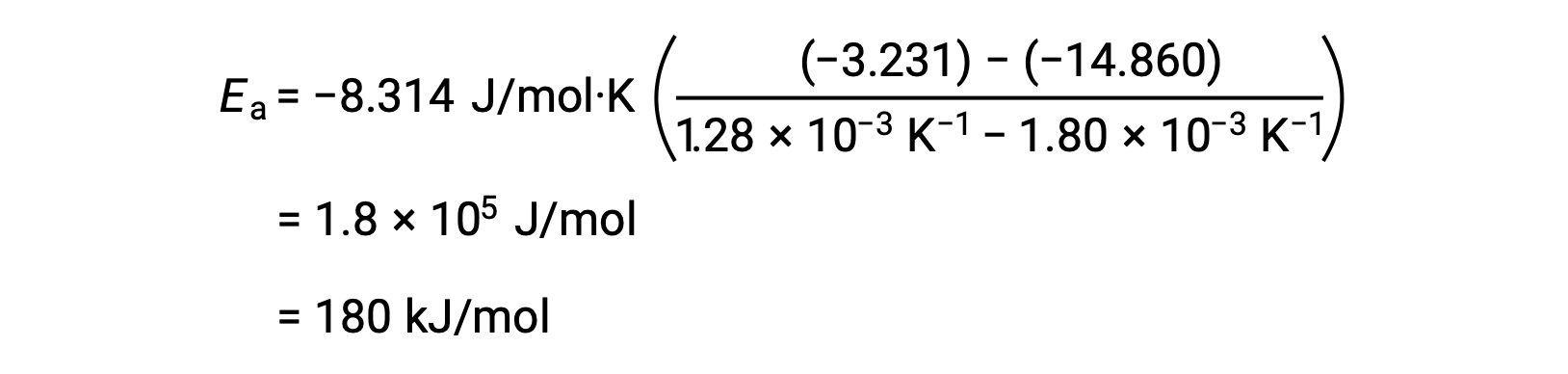
Questo approccio alternativo a due punti produce lo stesso risultato dell’approccio grafico. Tuttavia, in pratica, l’approccio grafico fornisce in genere risultati più affidabili mentre si lavora con i dati sperimentali effettivi.
Questo testo è adattato da Openstax, Chemistry 2e, Section 12.5: Collision Theory.
