13.12:
الانزيمات
13.12:
الانزيمات
تعمل الإنزيمات داخل الكائنات الحية كمحفّزات للعديد من التفاعلات الكيميائية الحيوية التي تدخل في عملية التمثيل الغذائي الخلوي. ويتمثل دور الإنزيمات في تقليل طاقات التنشيط للتفاعلات الكيميائية الحيوية عن طريق تكوين معقّدات مع ركائزها. إن خفض طاقات التنشيط يؤدي تفضيلياً لزيادة في معدلات التفاعلات الكيميائية الحيوية.
غالباً ما يؤدي نقص الإنزيم إلى أمراض تهدد الحياة. على سبيل المثال، خلل جيني ينتج عنه نقص في إنزيم G6PD (نازعة هيدروجين الجلوكوز-6-فوسفات) يؤثر سلباً على المسار الاستقلابي الذي يمدّ الخلايا بـ NADPH.
يمكن أن يؤدي الاضطراب في مسار التمثيل الغذائي هذا إلى تقليل الجلوتاثيون في خلايا الدم الحمراء مما يتسبب في تلف الإنزيمات والبروتينات الأخرى مثل الهيموجلوبين. يؤدي التمثيل الغذائي المفرط للهيموجلوبين إلى زيادة مستوى البيليروبين، مما يؤدي إلى الإصابة باليرقان، وهي حالة يمكن أن تصبح شديدة. وبالتالي، يجب على الأشخاص الذين يعانون من نقص G6PD تجنب بعض الأطعمة والأدوية التي تحتوي على مواد كيميائية يمكن أن تؤدي إلى تلف خلايا الدم الحمراء التي تعاني من نقص الجلوتاثيون.
وظيفة الإنزيم وهيكله
يتم تجميع الإنزيمات في فئات مختلفة بناءً على الوظيفة المحددة التي تؤديها. على سبيل المثال، تشارك إنزيمات أوكسيدوريدكتاز في تفاعلات الأكسدة-الاختزال، بينما تحفّز إنزيمات الترانسفيراز عملية نقل المجموعات الوظيفية. يتطلب تكوين رابطة مع التحلل المائي لـ ATP إنزيم الليجاز، في حين يتم تحفيز تفاعلات التحلل المائي وتكوين الروابط المزدوجة بواسطة إنزيمات هيدرولاز وإنزيمات لياز، على التوالي. تحفز إنزيمات الأيزوميراز عادةً تفاعلات الأزمرة.
تمتلك الإنزيمات عموماً مواقع نشطة. وهي مناطق محددة على الجزيء مع التشكل الذي يفضل أن يرتبط الإنزيم بركيزة معينة (جزيء متفاعل) لتكوين مركب ركيزة إنزيم أو وسيط التفاعل.
إن النموذجَين— نموذج القفل والمفتاح ونموذج الملاءمة المستحثة— قد يقومان بشرح آلية عمل الموقع النشط (الشكل 1). تشير فرضية القفل والمفتاح الأكثر بساطة إلى أن الموقع النشط والشكل الجزيئي للركيزة مكملان— يتناسبان معاً مثل مفتاح في قفل (الشكل 1 أ). من ناحية أخرى، تشير فرضية الملاءمة المستحثة إلى أن جزيء الإنزيم مرن ويغير شكله ليتناسب مع رابطة مع الركيزة (الشكل 1 ب).
ومع ذلك، فإن كلاً من نموذج القفل والمفتاح ونموذج الملاءمة المستحثة يفسران حقيقة أن الإنزيمات لا يمكن أن ترتبط إلا بركائز معينة وتحفز تفاعلاً معيناً فقط.
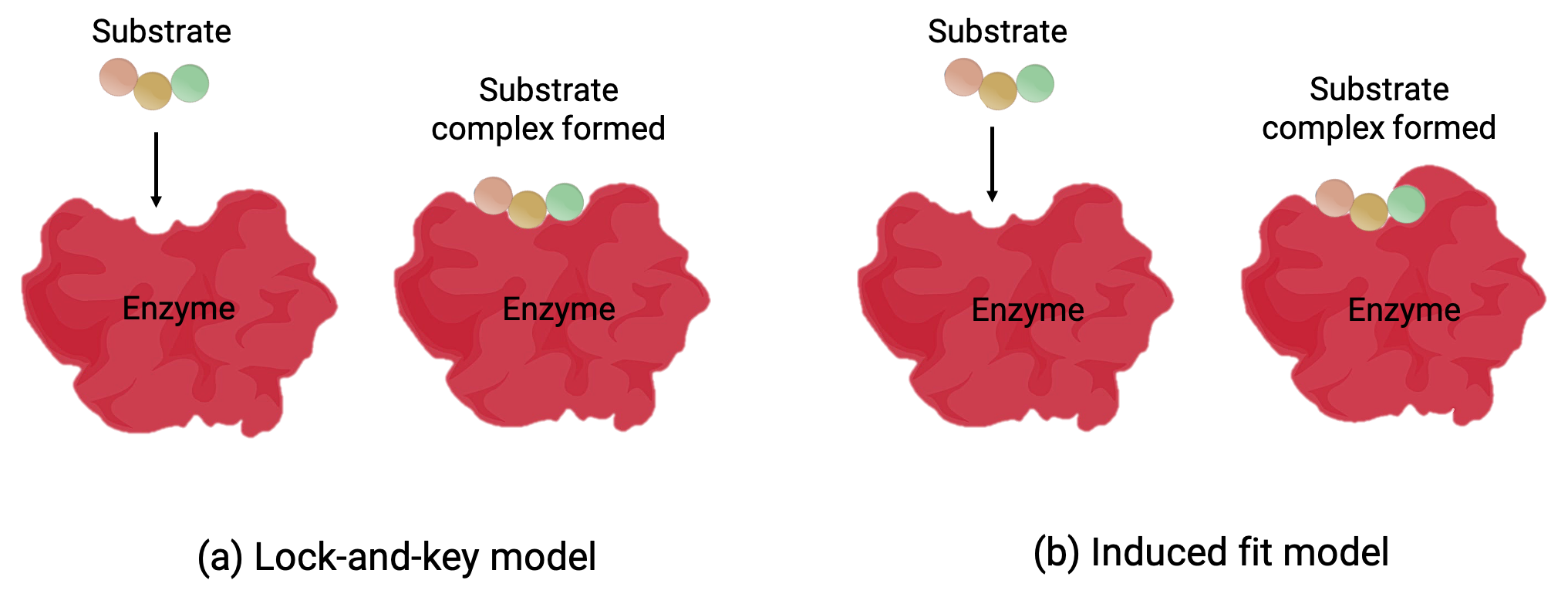
الشكل 1 (أ) وفقاً لنموذج القفل والمفتاح، فإن شكل الموقع النشط للإنزيم مناسب تماماً للركيزة. (ب) وفقاً لنموذج الملاءمة المستحثة، يكون الموقع النشط مرناً إلى حد ما، ويمكن أن يغير شكله من أجل الارتباط مع الركيزة.
مثبطات الإنزيم
يمكن أيضاً أن يتوقف نشاط الإنزيمات عن طريق عملية تثبيط الإنزيم. هناك عدة أنواع شائعة من تثبيط الإنزيم.
أثناء التثبيط التنافسي، يرتبط جزيء (طبيعي أو اصطناعي) بخلاف الركيزة ارتباطاً مباشراً بموقع الإنزيم' النشط. إن التشابه الهيكلي والكيميائي للمثبّط مع الركيزة يسهّل ارتباطه بالموقع النشط. وبالتالي، فإن هذه المثبّطات التنافسية تتنافس مع الركائز، وتمنعها من الارتباط بالإنزيم. في أغلب الأحيان، يمكن أن تؤدي زيادة تركيز الركيزة إلى قمع تأثيرات التثبيط التنافسي.
في التثبيط غير التنافسي، يرتبط الجزيء (طبيعي أو تركيبي) بمنطقة تفارغية (أخرى) من الإنزيم، تختلف عن موقعها النشط. يؤدي ارتباط المثبّط إلى تغيير تكوين موقع الإنزيم النشط، مما يؤدي إلى انخفاض في قدرة الإنزيم على تحفيز التفاعل. على عكس التثبيط التنافسي، فإن الزيادة في تركيز الركيزة لا تخفف من الآثار المثبّطة للتثبيط غير التنافسي.
جزء من هذا النص مقتبس من Openstax, Chemistry 2e, Section 12.7: Catalysis.
