14.6:
حساب تركيزات التوازن
14.6:
حساب تركيزات التوازن
تعد القدرة على حساب تركيزات التوازن أمرًا ضروريًا للعديد من مجالات العلوم والتكنولوجيا— على سبيل المثال ، في صياغة وتحديد جرعات المنتجات الصيدلانية. بعد تناول الدواء أو حقنه ، فإنه يشترك عادة في عدة توازنات كيميائية تؤثر على تركيزه النهائي في نظام الجسم الذي يهمه الأمر. مطلوب معرفة الجوانب الكمية لهذه التوازنات لحساب كمية الجرعة التي ستلتمس التأثير العلاجي المطلوب.
يمكن أن يكون النوع الأكثر صعوبة من حساب التوازن هو النوع الذي تُشتق فيه تركيزات التوازن من التركيزات الأولية وثابت التوازن. بالنسبة إلى هذه الحسابات ، يكون اتباع نهج من أربع خطوات مفيدًا عادةً:
- حدد الاتجاه الذي سيستمر فيه التفاعل للوصول إلى التوازن.
- طور جدول ICE
- احسب تغيرات التركيز ، وبالتالي ، تراكيز التوازن.
- تأكيد تركيزات التوازن المحسوبة.
حساب تركيزات التوازن
في ظل ظروف معينة ، ثابت التوازنKc لتحلل PCl5(غ) إلى PCl3(غ) و Cl2(غ) يساوي 0.0211. يمكن استخدام الإجراء أعلاه لتحديد تركيزات التوازن لكل من Cl5, PCl3, و Cl2 في خليط يحتوي مبدئيًا على PCl فقط 5 بتركيز 1.00 M.
الخطوة الأولى. تحديد اتجاه سير التفاعل.
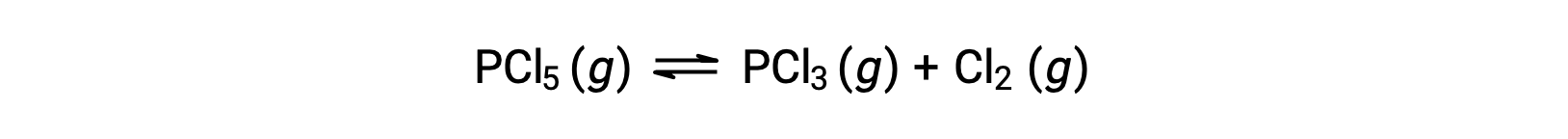
نظرًا لوجود المادة المتفاعلة فقط في البداية ، Qc = 0 وسيبدأ التفاعل إلى اليمين.
الخطوة 3. حل من أجل التغيير وتركيزات التوازن.
ينتج عن استبدال تركيزات التوازن في معادلة ثابت التوازن
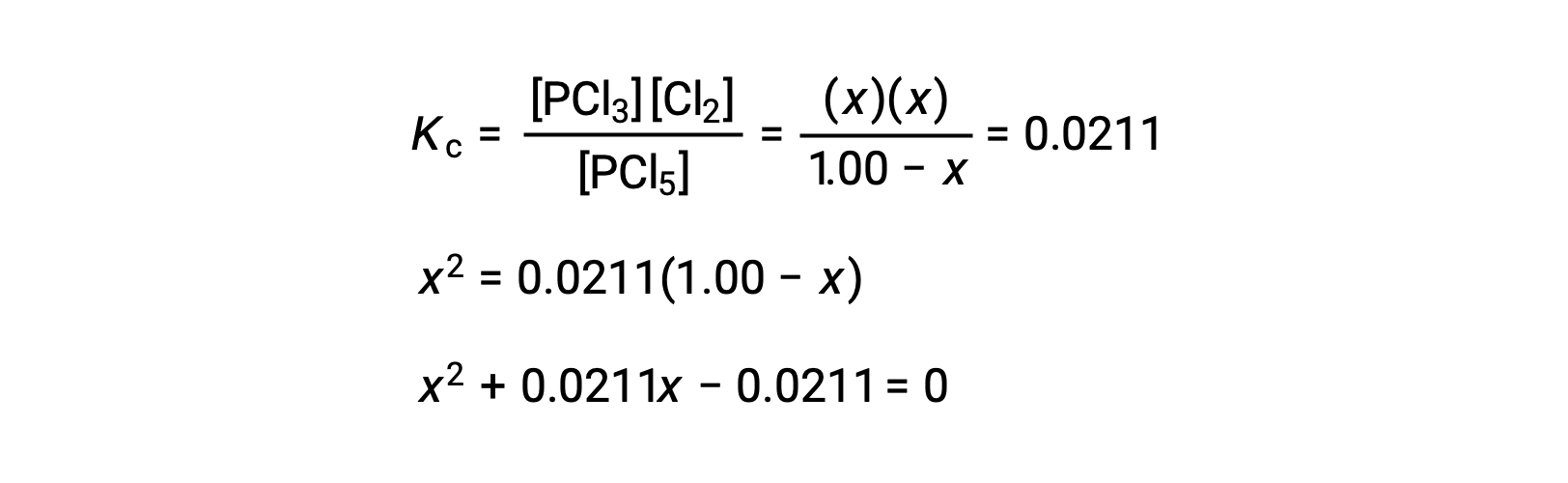
يمكن إعادة ترتيب معادلة ax2 + bx + c = 0 بالصيغة التالية لحلها من أجل x:
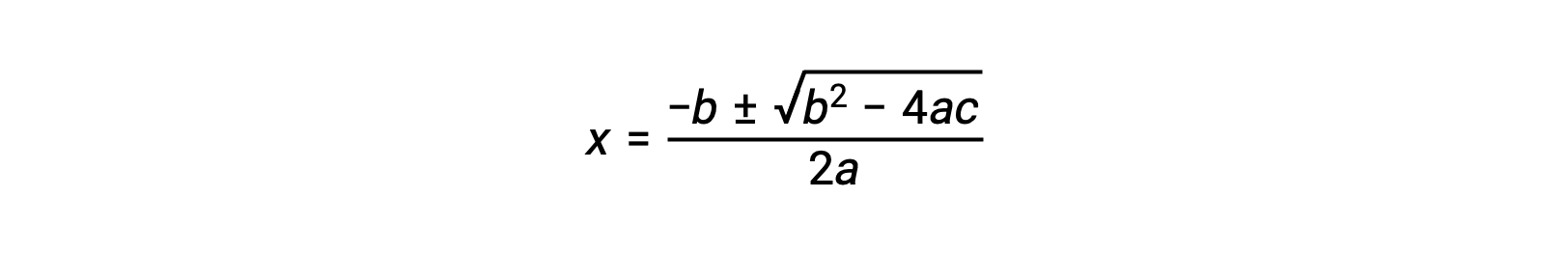
في هذه الحالة، a = 1, b = 0.0211, و c = −0.0211. ينتج عن استبدال القيم المناسبة لـ a, b, و c التالي:
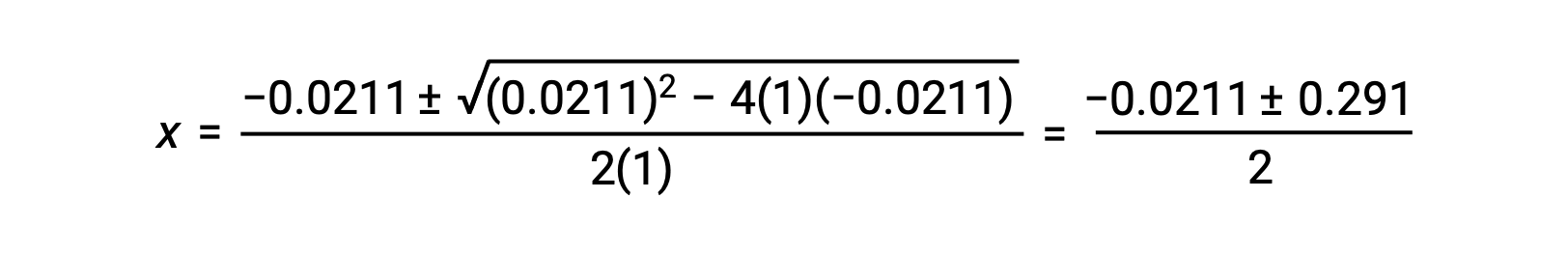
إن جذور المعادلة التربيعية هما، بالتالي،
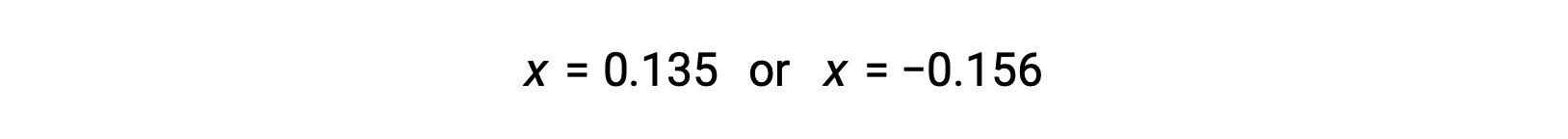
بالنسبة لهذا السيناريو، يكون الجذر الموجب فقط هو الذي له معنى ماديًا (تكون التركيزات إما صفرية أو موجبة) ، وبالتالي فإنx = 0.135 M. تركيزات التوازن هي
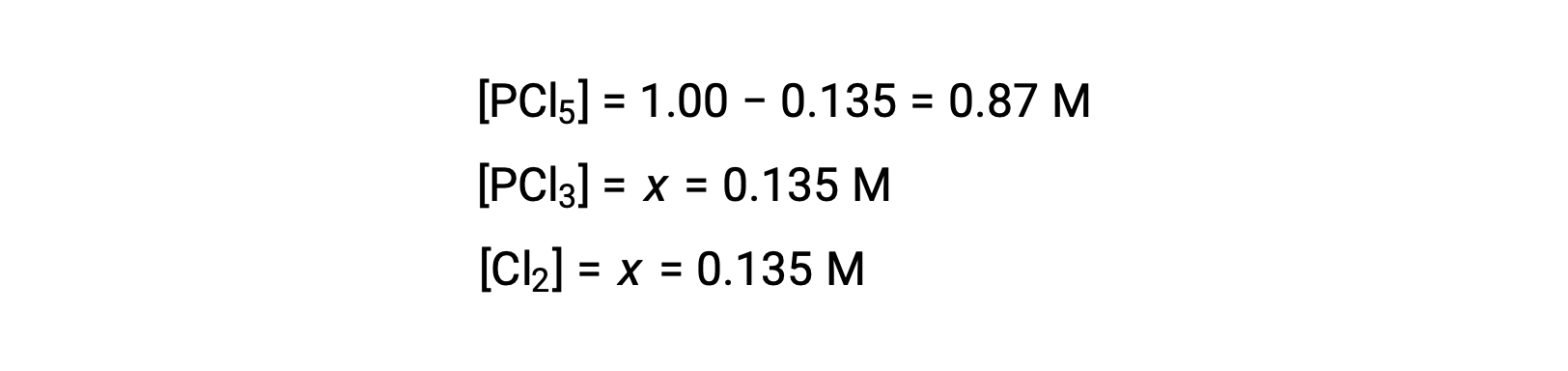
< الخطوة 4. تأكيد تركيزات التوازن المحسوبة.
يؤدي الاستبدال في تعبير Kc (للتحقق من عملية الحساب) إلى
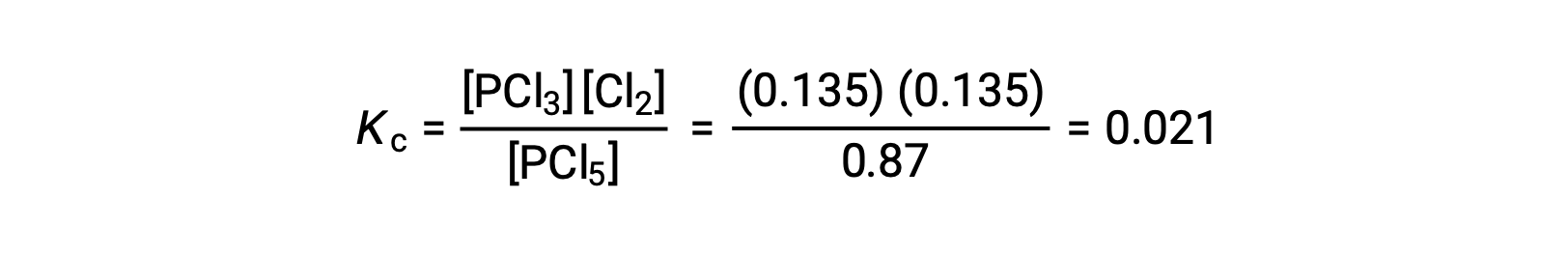
ثابت التوازن المحسوب من تركيزات التوازن يساوي قيمة K c المعطاة في المسألة (عند تقريبه إلى العدد المناسب للأرقام المعنوية).
تم اقتباس هذا النص من Openstax, Chemistry 2e, Section 13.4 Equilibrium Calculations.
Suggested Reading
- Lim, Kieran F. "Using graphics calculators and spreadsheets in chemistry: Solving equilibrium problems." Journal of Chemical Education 85, no. 10 (2008): 1347. https://pubs.acs.org/doi/pdf/10.1021/ed085p1347
