14.6:
Calcolo dell' equilibrio di concentrazione
14.6:
Calcolo dell' equilibrio di concentrazione
Essere in grado di calcolare le concentrazioni di equilibrio è essenziale per molti settori della scienza e della tecnologia, ad esempio nella formulazione e nel dosamento di prodotti farmaceutici. Dopo che un farmaco viene ingerito o iniettato, è tipicamente coinvolto in diversi equilibri chimici che influenzano la sua concentrazione finale nel sistema corporeo di interesse. La conoscenza degli aspetti quantitativi di questi equilibri è necessaria per calcolare una quantità di dosaggio che solleciterà l’effetto terapeutico desiderato.
Un tipo più impegnativo di calcolo dell’equilibrio può essere quello in cui le concentrazioni di equilibrio sono derivate dalle concentrazioni iniziali e da una costante di equilibrio. Per questi calcoli, un approccio in quattro fase è in genere utile:
- Identificare la direzione in cui la reazione procederà per raggiungere l’equilibrio.
- Sviluppare una tabella ICE.
- Calcolare le variazioni di concentrazione e, successivamente, le concentrazioni di equilibrio.
- Confermare le concentrazioni di equilibrio calcolate.
Calcolo delle concentrazioni di equilibrio
In determinate condizioni, la costante di equilibrio Kc per la decomposizione di PCl5(g) in PCl3(g) e Cl2(g) è 0,0211. La procedura di cui sopra può essere utilizzata per determinare le concentrazioni di equilibrio di PCl5, PCl3e Cl2 in una miscela che inizialmente conteneva solo PCl5 ad una concentrazione di 1,00 M.
Passo 1. Determinare la direzione in cui procede la reazione.
L’equazione bilanciata per la decomposizione di PCl5 è

Poiché inizialmente è presente solo il reagente, Qc = 0, e la reazione procederà a destra.
Passo 2. Sviluppare una tabella ICE.
| PCl5 (g) | PCl3 (g) | Cl2 (g) | |
| Concentrazione iniziale (M) | 1.00 | 0 | 0 |
| Variazione (M) | −x | +x | +x |
| Concentrazione di equilibrio (M) | 1,00 − x | X | X |
Passo 3. Risolvi il cambiamento e le concentrazioni di equilibrio.
Sostituendo le concentrazioni di equilibrio nell’equazione costante di equilibrio si ottiene

Un’equazione della forma ax2 + bx + c = 0 può essere riorganizzata per risolvere x:
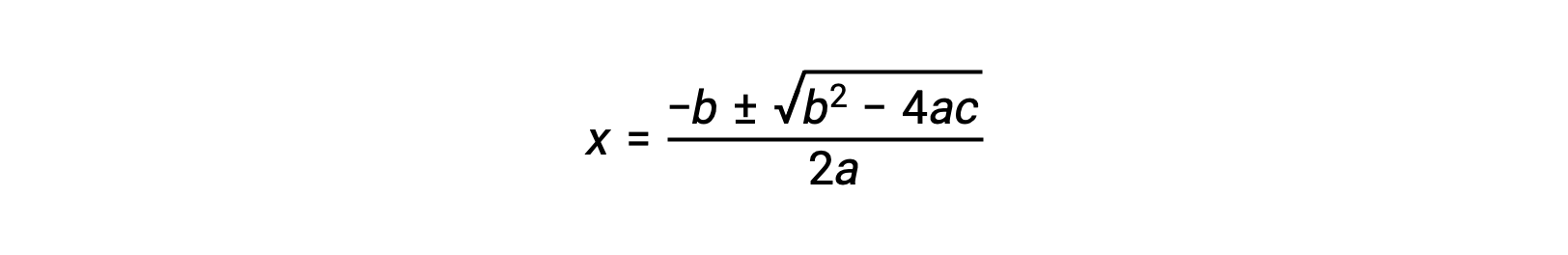
In questo caso, a = 1, b = 0,0211 e c = −0,0211. Sostituendo i valori appropriati con a, be c vengono restituiti:
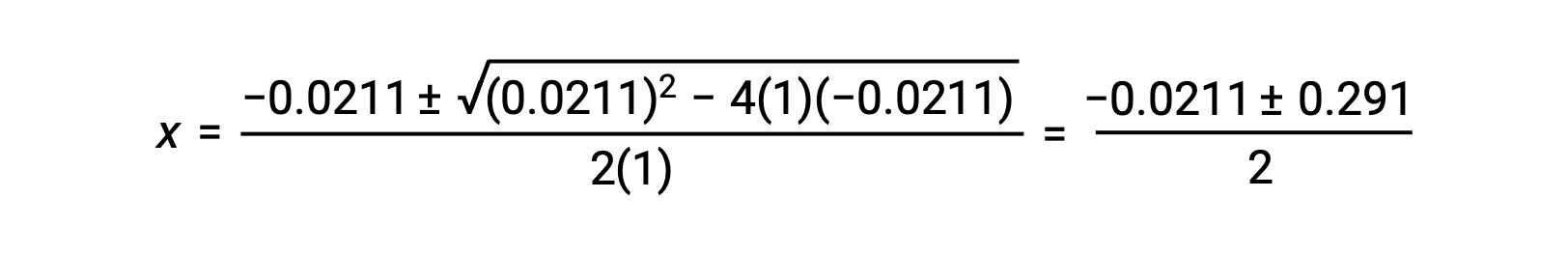
Le due radici del quadratico sono, quindi,
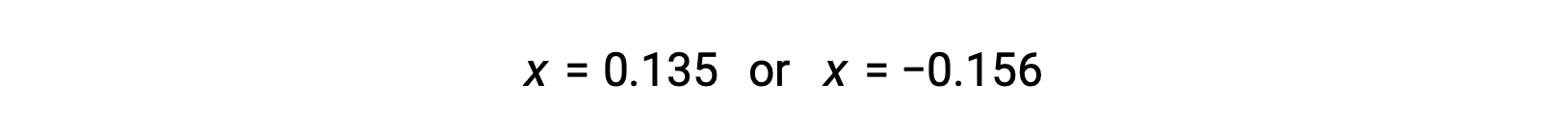
Per questo scenario, solo la radice positiva è fisicamente significativa (le concentrazioni sono pari a zero o positive), e quindi x = 0,135 M. Le concentrazioni di equilibrio sono
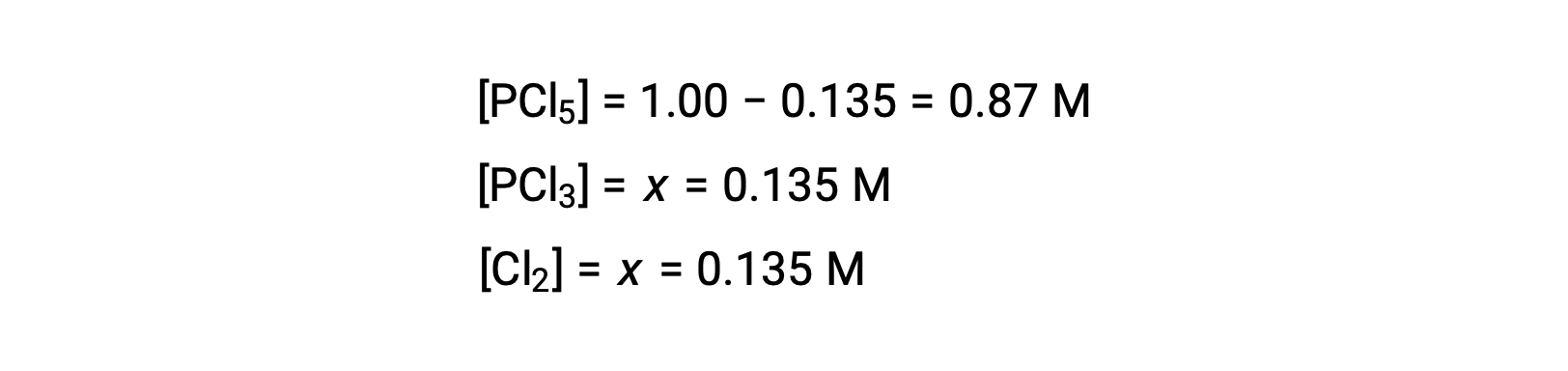
Passo 4. Confermare le concentrazioni di equilibrio calcolate.
La sostituzione nell’espressione per Kc(per controllare il calcolo) dà
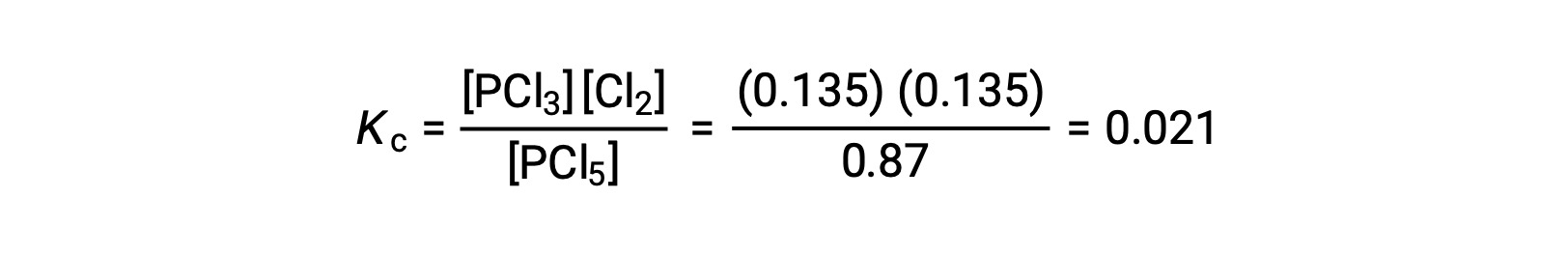
La costante di equilibrio calcolata dalle concentrazioni di equilibrio è uguale al valore di Kc dato nel problema (se arrotondato al numero proprio di cifre significative).
Questo testo è stato adattato da Openstax, Chimica 2e, Sezione 13.4 Calcoli di equilibrio.
Suggested Reading
- Lim, Kieran F. "Using graphics calculators and spreadsheets in chemistry: Solving equilibrium problems." Journal of Chemical Education 85, no. 10 (2008): 1347. https://pubs.acs.org/doi/pdf/10.1021/ed085p1347
