15.7:
Soluções de Ácidos Fracos
15.7:
Soluções de Ácidos Fracos
Poucos compostos agem como ácidos fortes. Um número muito maior de compostos comporta-se como ácidos fracos e reage apenas parcialmente com a água, deixando uma grande maioria de moléculas dissolvidas na sua forma original e gerando uma quantidade relativamente pequena de iões hidrónio. Os ácidos fracos são comumente encontrados na natureza, sendo as substâncias parcialmente responsáveis pelo sabor acídico de frutas cítricas, a sensação de ardor de picadas de insetos, e os cheiros desagradáveis associados ao odor corporal. Um exemplo familiar de um ácido fraco é o ácido acético, o ingrediente principal no vinagre:
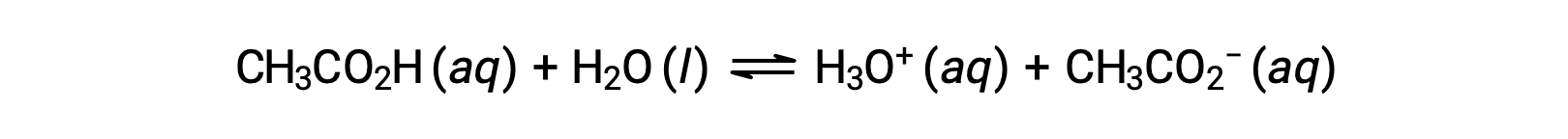
O uso de uma seta dupla na equação acima denota o aspecto de reação parcial deste processo. Quando dissolvido em água em condições típicas, apenas cerca de 1% das moléculas de ácido acético estão presentes na forma ionizada, CH3COO−.
Cálculo das Concentrações de Iões Hidrónio e do pH de uma Solução de Ácido Fraco
O ácido fórmico, HCO2H, é um irritante que causa a reação do corpo a algumas picadas e mordidas de formigas. Qual é a concentração de iões hidrónio e o pH de uma solução de ácido fórmico a 0,534-M?
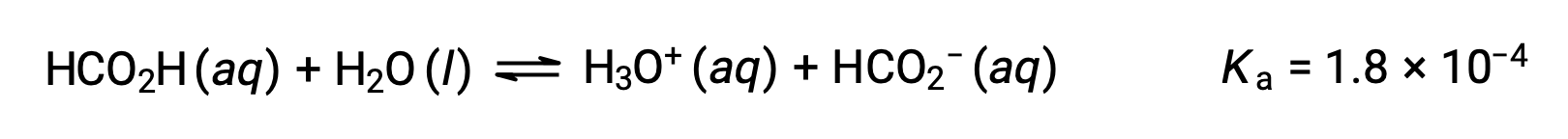
A tabela ICE para este sistema é
| HCO2H (aq) | H3O+ (aq) | HCO2− (aq) | |
| Concentração Inicial (M) | 0,534 | ~0 | 0 |
| Alteração (M) | −x | +x | +x |
| Concentração em Equilíbrio (M) | 0,534 − x | x | x |
Substituindo os termos de concentração de equilíbrio na expressão de Ka obtemos
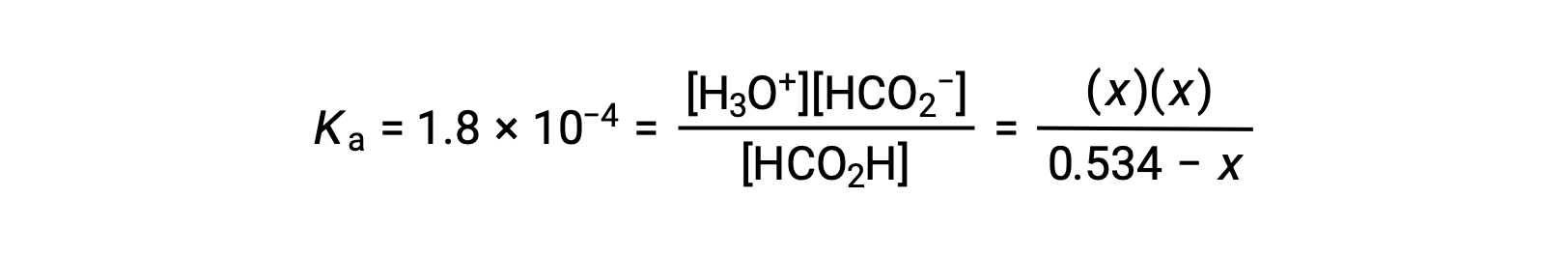
A concentração inicial relativamente grande e a constante de equilíbrio pequena permitem a suposição de simplificação de que x será muito menor que 0,534, e assim a equação torna-se
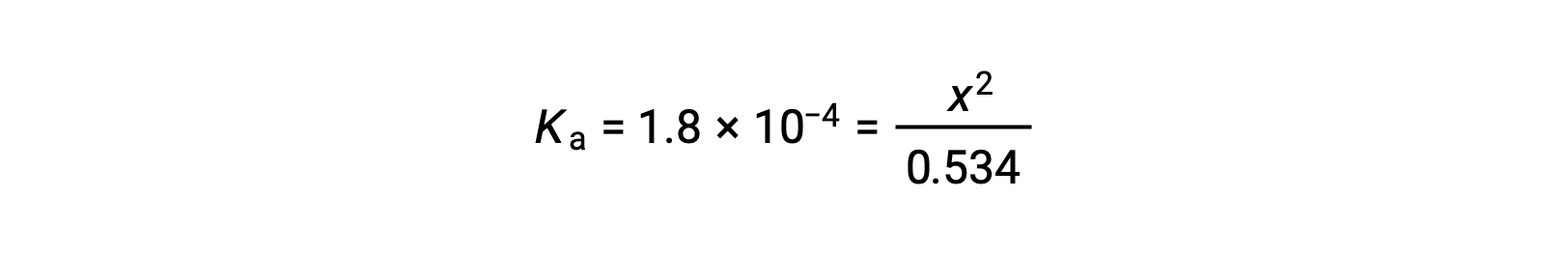
Resolvendo a equação para x obtemos
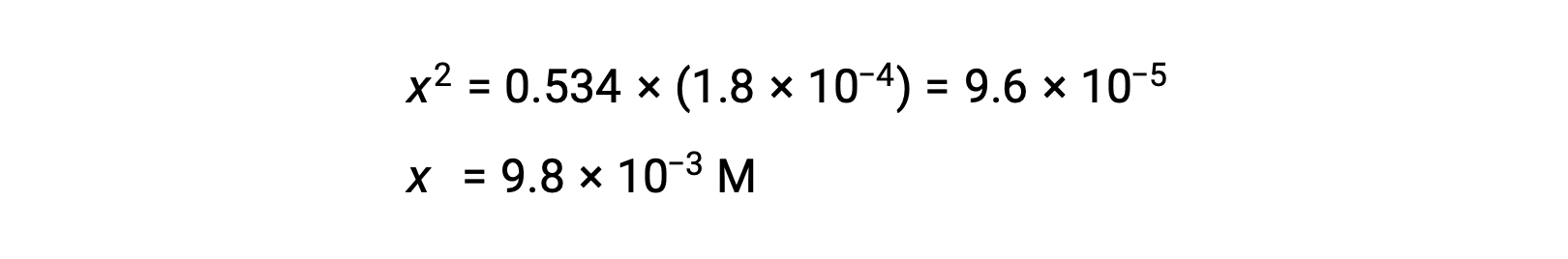
Para verificar a suposição de que x é pequeno em comparação com 0,534, a sua magnitude relativa pode ser estimada:
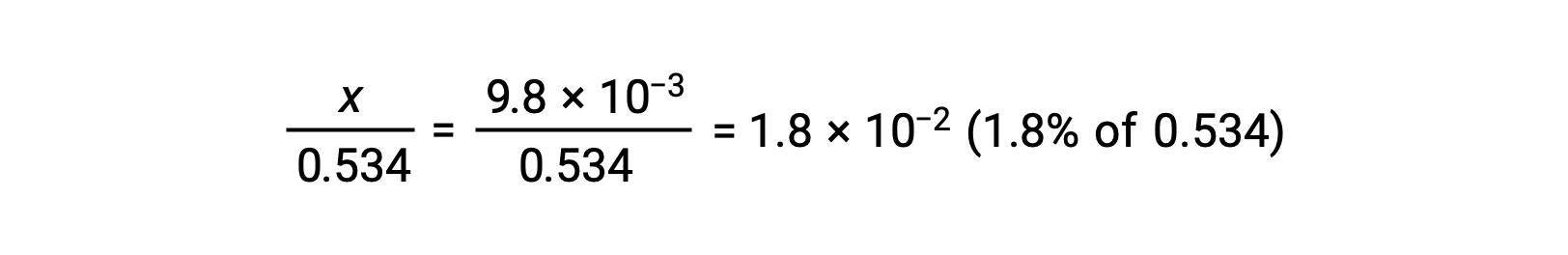
Uma vez que x é inferior a 5% da concentração inicial, o pressuposto é válido. Conforme definido na tabela ICE, x é igual à concentração de equilíbrio de iões hidrónio:

Por fim, o pH é calculado para ser
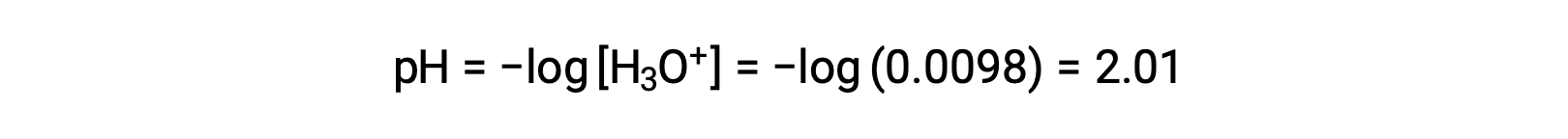
Determinação de Ka a partir do pH
O pH de uma solução de ácido nitroso, HNO2, a 0,0516 M é de 2,34. Qual é a sua Ka?
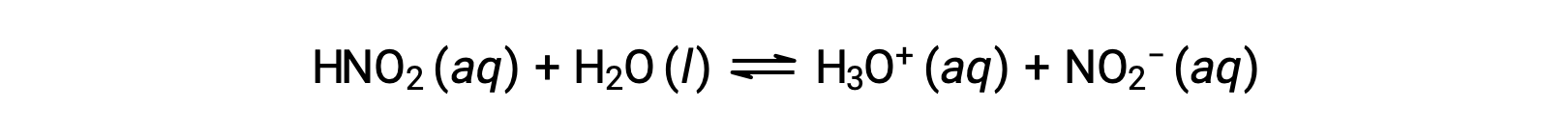
A concentração de ácido nitroso fornecida é uma concentração formal, que não tem em conta quaisquer equilíbrios químicos que possam ser estabelecidos em solução. Essas concentrações são tratadas como valores “iniciais” para os cálculos de equilíbrio utilizando a abordagem da tabela ICE. Observe que o valor inicial de iões hidrónio está listado como aproximadamente zero, pois uma pequena concentração de H3O+ está presente (1 × 10−7 M) devido à autoionização da água. Em muitos casos, esta concentração é muito menor do que aquela gerada pela ionização do ácido (ou base) em questão e pode ser negligenciada.
O pH fornecido é uma medida logarítmica da concentração de iões hidrónio resultante da ionização ácida do ácido nitroso, representando assim um valor de “equilíbrio” para a tabela ICE:
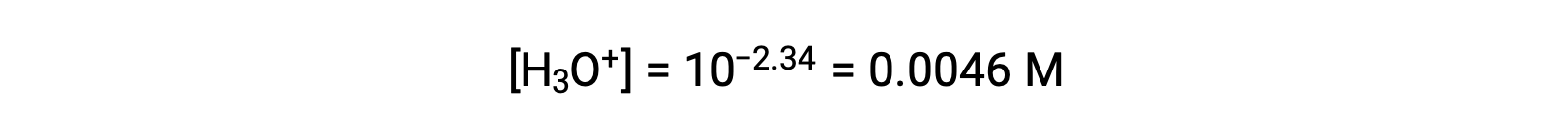
A tabela ICE para este sistema é então
| HNO2 (aq) | H3O+ (aq) | NO2− (aq) | |
| Concentração Inicial (M) | 0,0516 | ~0 | 0 |
| Alteração (M) | −0,0046 | +0,0046 | +0,0046 |
| Concentração em Equilíbrio (M) | 0,0470 | 0,0046 | 0,0046 |
Por fim, calcula-se o valor da constante de equilíbrio utilizando os dados da tabela:
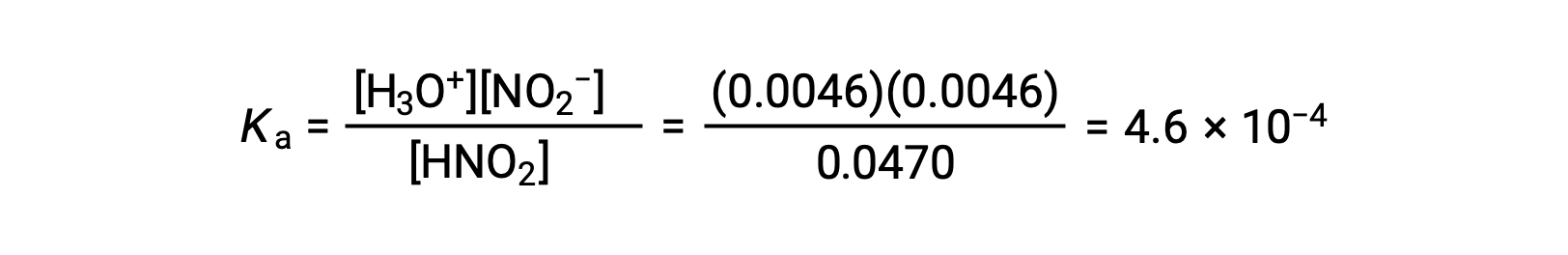
Este texto é adaptado de Openstax, Chemistry 2e, Section 4.2: Classifying Chemical Reactions e Openstax, Chemistry 2e,14.3 Relative Strengths of Acids and Bases.
