15.7:
Soluciones de Ácidos Débiles
15.7:
Soluciones de Ácidos Débiles
Pocos compuestos actúan como ácidos fuertes. Un número mucho mayor de compuestos se comporta como ácidos débiles y sólo reaccionan parcialmente con el agua, dejando una gran mayoría de moléculas disueltas en su forma original y generando una cantidad relativamente pequeña de iones hidronio. Los ácidos débiles se encuentran comúnmente en la naturaleza, siendo las sustancias en parte responsables del sabor picante de los cítricos, la sensación de picadura de las picaduras de los insectos, y los olores desagradables asociados con el olor corporal. Un ejemplo familiar de un ácido débil es el ácido acético, el principal ingrediente del vinagre:
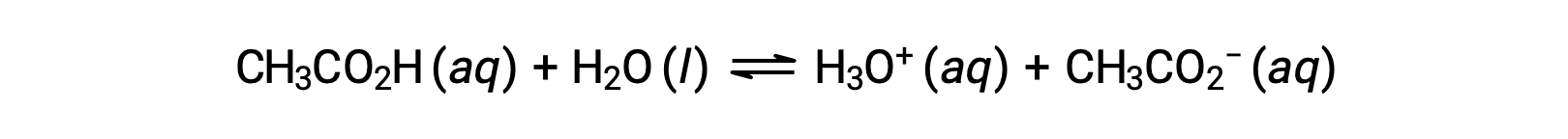
El uso de una flecha doble en la ecuación anterior indica el carácter de reacción parcial de este proceso. Cuando se disuelven en agua en condiciones típicas, sólo alrededor del 1% de las moléculas de ácido acético están presentes en forma ionizada, CH3COO−.
Cálculo de las concentraciones de iones hidronio y el pH de una solución ácida débil
El ácido fórmico, HCO2H, es un irritante que causa la reacción del cuerpo a algunas mordeduras y picaduras de hormigas. ¿Cuál es la concentración de iones hidronio y el pH de una solución 0,534-M de ácido fórmico?
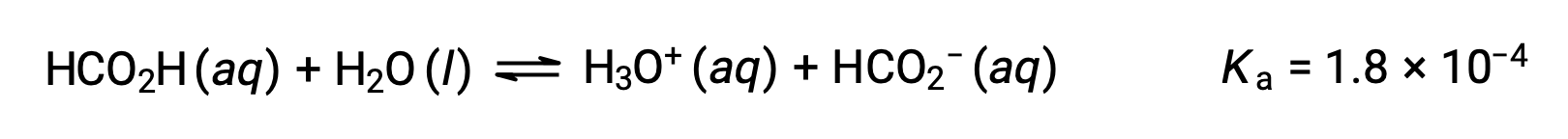
La tabla ICE para este sistema es
| HCO2H(ac) | H3O+(ac) | HCO2−(aq) | |
| Concentración inicial (M) | 0,534 | ~0 | 0 |
| Cambio (M) | −x | +x | +x |
| Concentración de equilibrio (M) | 0,534 − x | x | x |
Al sustituir los términos de concentración en equilibrio en la expresión Ka queda
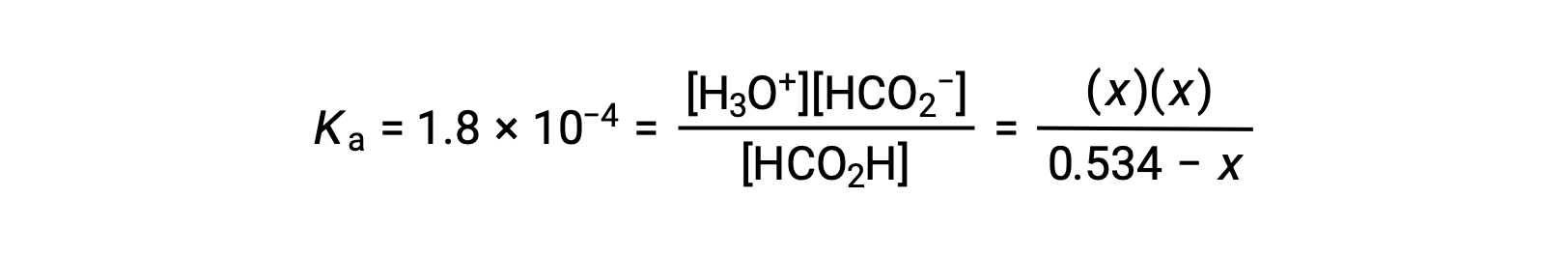
La concentración inicial relativamente grande y la constante de equilibrio pequeña permiten la suposición de simplificación de que x será mucho menor que 0,534, y así la ecuación se convierte en
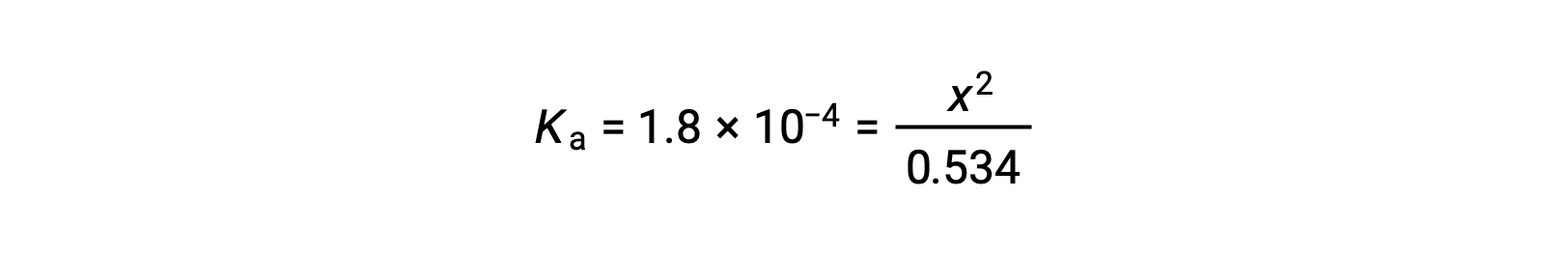
Al resolver la ecuación para x se obtiene
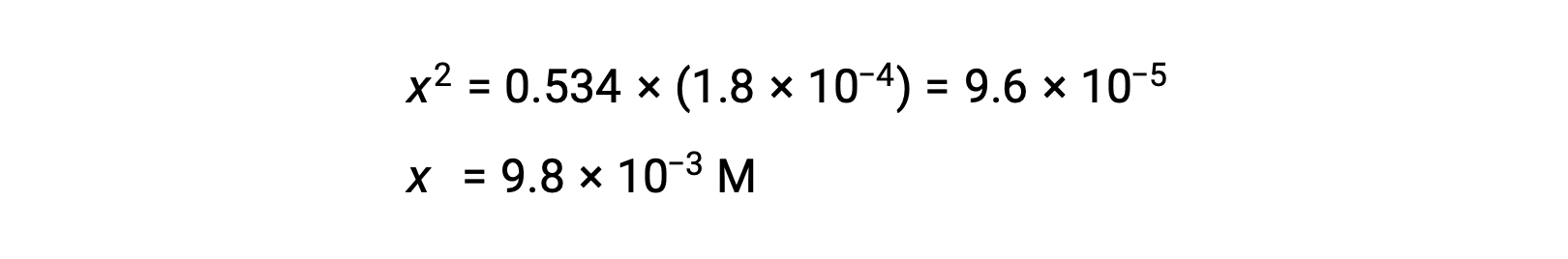
Para comprobar la suposición de que x es pequeña en comparación con 0,534, se puede estimar su magnitud relativa:
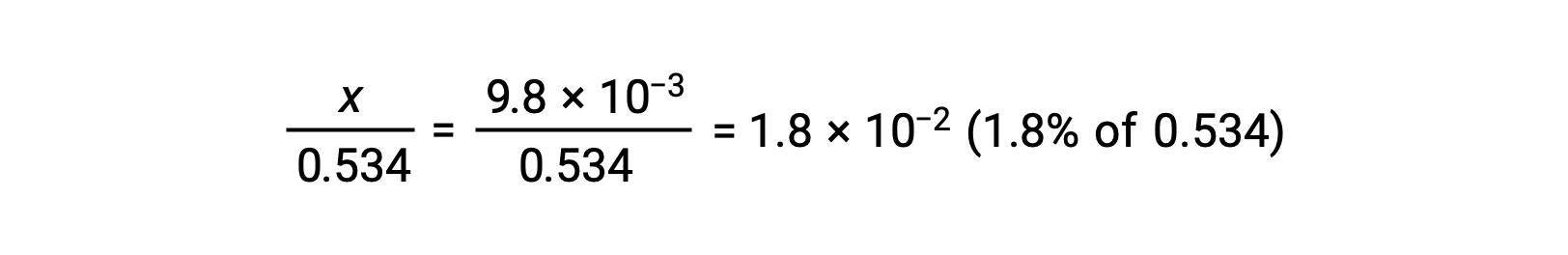
Debido a que x es menos del 5% de la concentración inicial, la suposición es válida. Como se define en la tabla ICE, x es igual a la concentración del ion hidronio en equilibrio:

Finalmente, el pH se calcula que es
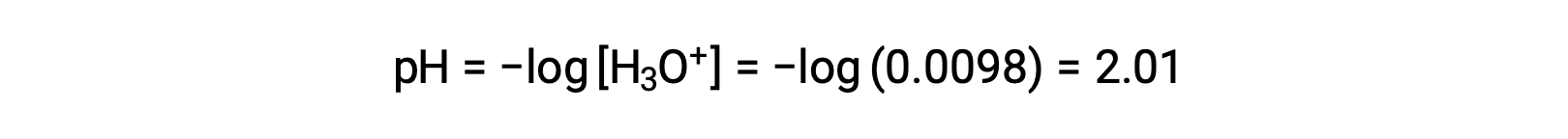
Determinación de Ka a partir del pH
El pH de una solución de ácido nitroso de 0,0516 M, HNO2, es 2,34. ¿Cuál es su Ka?
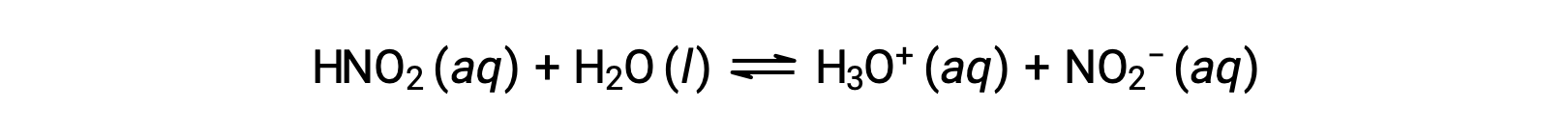
La concentración de ácido nitroso proporcionada es una concentración formal, que no tiene en cuenta ningún equilibrio químico que pueda establecerse en solución. Dichas concentraciones se tratan como valores “iniciales” para los cálculos de equilibrio utilizando el método de la tabla ICE. Observe que el valor inicial del ion hidronio se indica como aproximadamente cero porque hay una pequeña concentración de H3O+ (1 × 10−7 M) debido a la autoionización del agua. En muchos casos, esta concentración es mucho menor que la generada por la ionización del ácido (o base) en cuestión y puede ser desestimada.
El pH proporcionado es una medida logarítmica de la concentración de iones hidronio resultante de la ionización ácida del ácido nitroso, por lo que representa un valor de “equilibrio” para la tabla ICE:
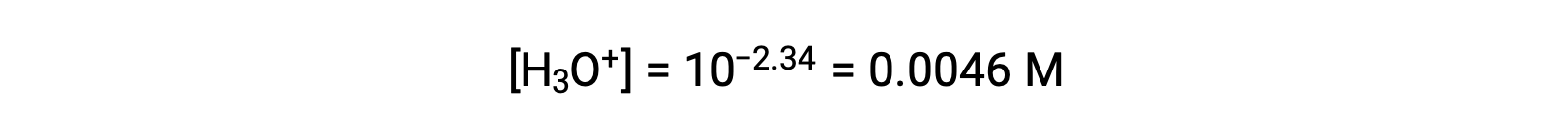
La tabla ICE para este sistema es entonces
| HNO2 (ac) | H3O+(ac) | NO2−(ac) | |
| Concentración inicial (M) | 0,0516 | ~0 | 0 |
| Cambio (M) | −0,0046 | +0.0046 | +0.0046 |
| Concentración de equilibrio (M) | 0,0470 | 0,0046 | 0,0046 |
Finalmente, calcule el valor de la constante de equilibrio utilizando los datos de la tabla:
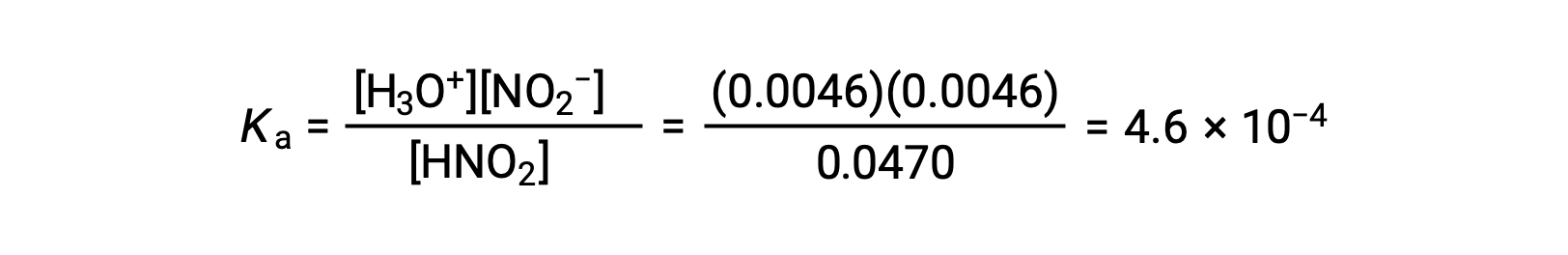
Este texto es adaptado de Openstax, Química 2e, Sección 4.2: Clasificación de las Reacciones Químicas y Openstax, Química 2e,14.3 Fuerzas Relativas de Ácidos y Bases.
