15.12:
多质子酸
15.12:
多质子酸
酸按照每一分子在反应中可以放弃的质子数量进行分类。 HCL , HNO3 和 HPN 等酸在每个分子中含有一个可电离氢原子,称为单原子酸。 他们对水的反应如下:
| 单质子酸:与水的反应 |
| HCl (aq) + H2O (l) ⟶ H3O+ (aq) + Cl− (aq) |
| HNO3 (aq) + H2O (l) ⟶ H3O+ (aq) + NO3− (aq) |
| HCN (aq) + H2O (l) ⇌ H3O+ (aq) + CN− (aq) |
尽管它含有四个氢原子,但乙酸 CH3CO2H 也是单质子,因为只有羧基组的氢原子会与碱发生反应:
同样,单质子碱是接受单个质子的碱。
双质子酸每分子含有两个可电离氢原子;此类酸的电离发生在两个步骤中。 第一次电离的发生范围总是大于第二次电离。 例如,硫酸 (强酸) 的电离如下:
| 双质子酸:硫酸 (H2SO4) | ||
| 1st 首次电离 | H2SO4 (aq) + H2O (l) ⇌ H3O+ (aq) + HSO4− (aq) | Ka1 = 102 以上; 完全解离 |
| 2nd 二次电离 | HSO4− (aq) + H2O (l) ⇌ H3O+ (aq) + SO42− (aq) | Ka2 = 1.2 × 10−2 |
所有多质子酸都将执行此分步电离过程。 粘性酸H2CO3是弱双质子酸的一个示例。 碳酸的首次电离会产生少量的水合氢离子和碳酸二酯离子。
首次电离: H2CO3 (aq) + H2O (l) ⇌ H3O+ (aq) + HCO3− (aq)
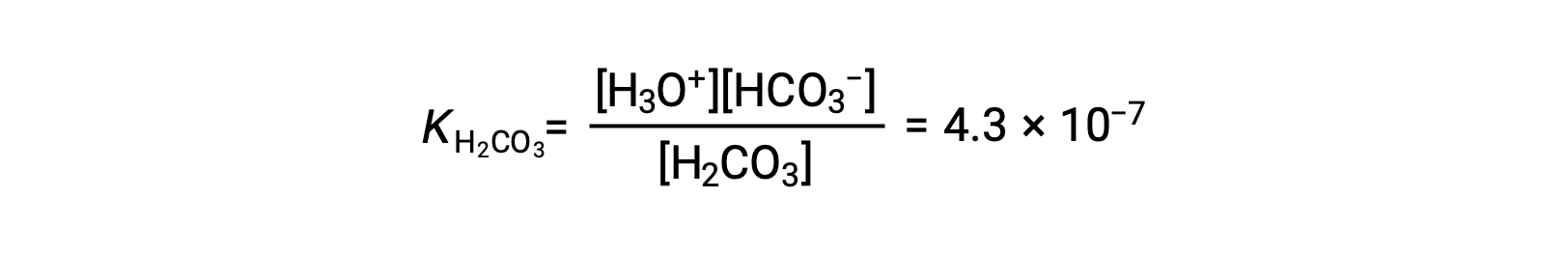
二碳酸盐离子也可用作酸。 它可以使水合氢离子和碳酸盐离子的电离和形成更小的数量。
二次电离: HCO3− (aq) + H2O (l) ⇌ H3O+ (aq) + CO32− (aq)
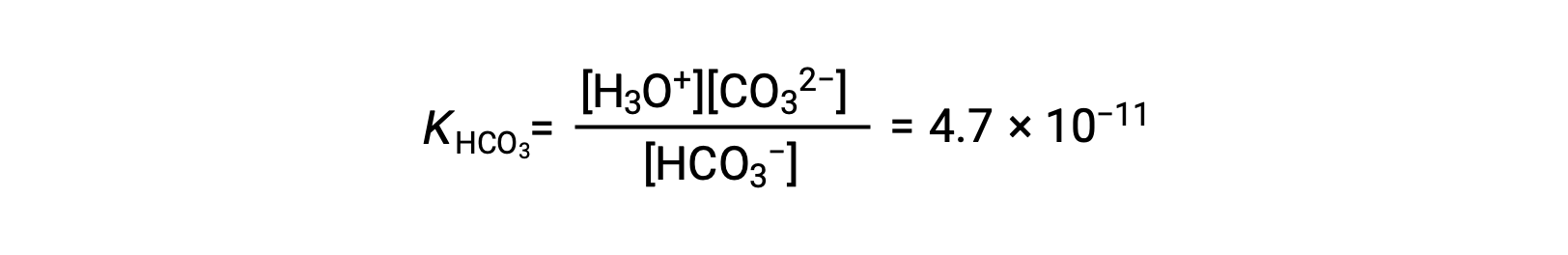
KH2CO3 比 KHCO3− 大 104 倍,因此 H2CO3 是溶液中水合氢离子的主要生产者. 这意味着会形成很少的 HCO3− 由电离 H2CO3 离子产生水合氢离子 (和碳酸盐离子),H3O+ 和 HCO3− 的浓度基本上等同于纯水溶液中的 H2CO3。
如果弱双质子酸的第一个电离常数大于第二个,系数至少为 20 ,则应分别处理第一个电离并计算其产生的浓度,然后再计算随后电离产生的物种的计算浓度。 这种方法在以下示例练习中得到了证明。
双质子酸电离
“碳化水”含有一个可调的数量二氧化碳溶解。 由于CO2与水发生反应形成碳酸 H2CO3,因此溶液酸酸性强。 在初始值为[H2CO3] = 0.033的CO2 饱和溶液中,[H3O+], [HCO3−], 和 [CO32−] 的值是什么?
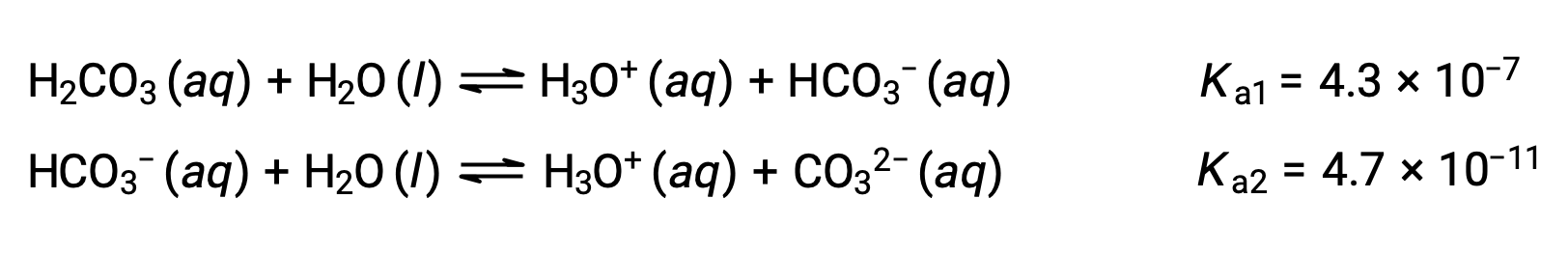
如电离常数所示,H2CO3的酸比HCO3−强得多,因此可以单独处理逐步电离反应。 使用提供的信息,为这一第一个电离步骤准备了一个 ICE表格 :
| H2CO3 (aq) | H3O+ (aq) | HCO3− (aq) | |
| 初始浓度 (M) | 0.033 | ~0 | 0 |
| 变化 (M) | −x | +x | +x |
| 平衡浓度 (M) | 0.033 − x | x | x |
将平衡浓度替换为方程提供的平衡浓度
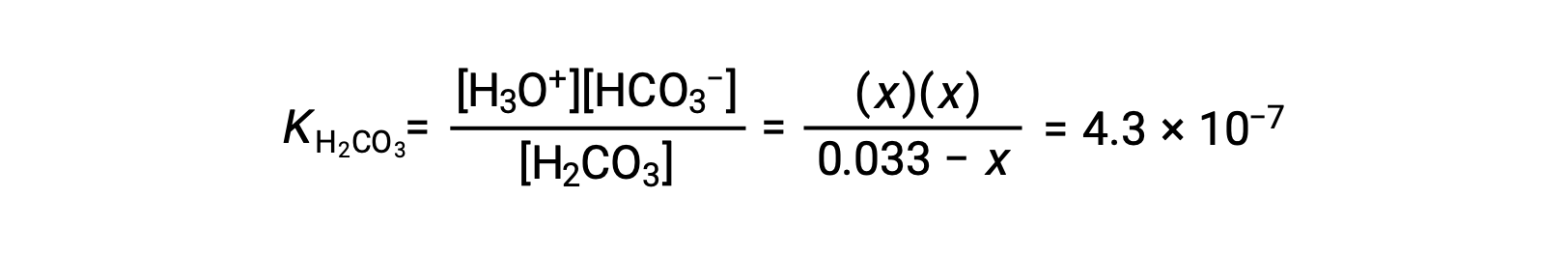
假设x << 0.033并解简化的方程得出
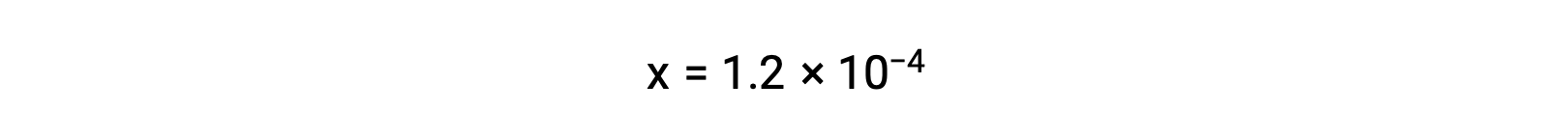
ICE表格 将 x 定义为等于碳酸氢离子体积摩尔浓度和水合氢离子体积摩尔浓度:
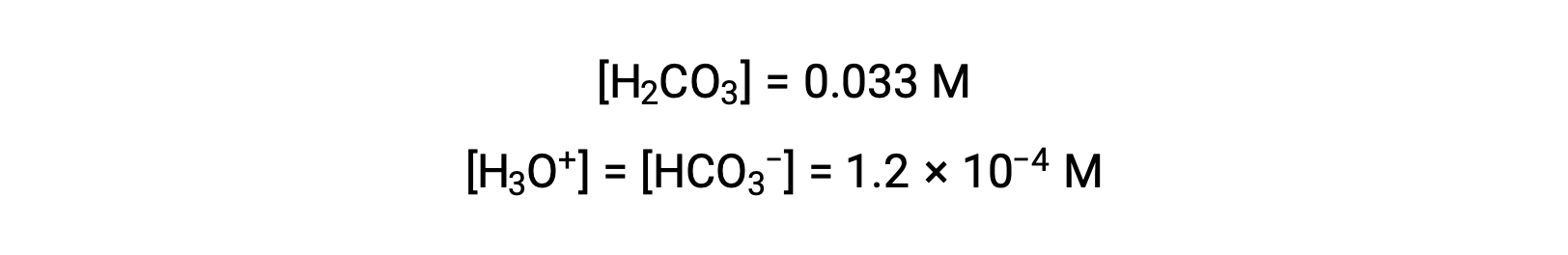
使用上述计算的碳酸氢离子浓度,第二次电离会受到类似的平衡计算: HCO3− (aq) + H2O (l) ⇌ H3O+ (aq) + CO32− (aq)
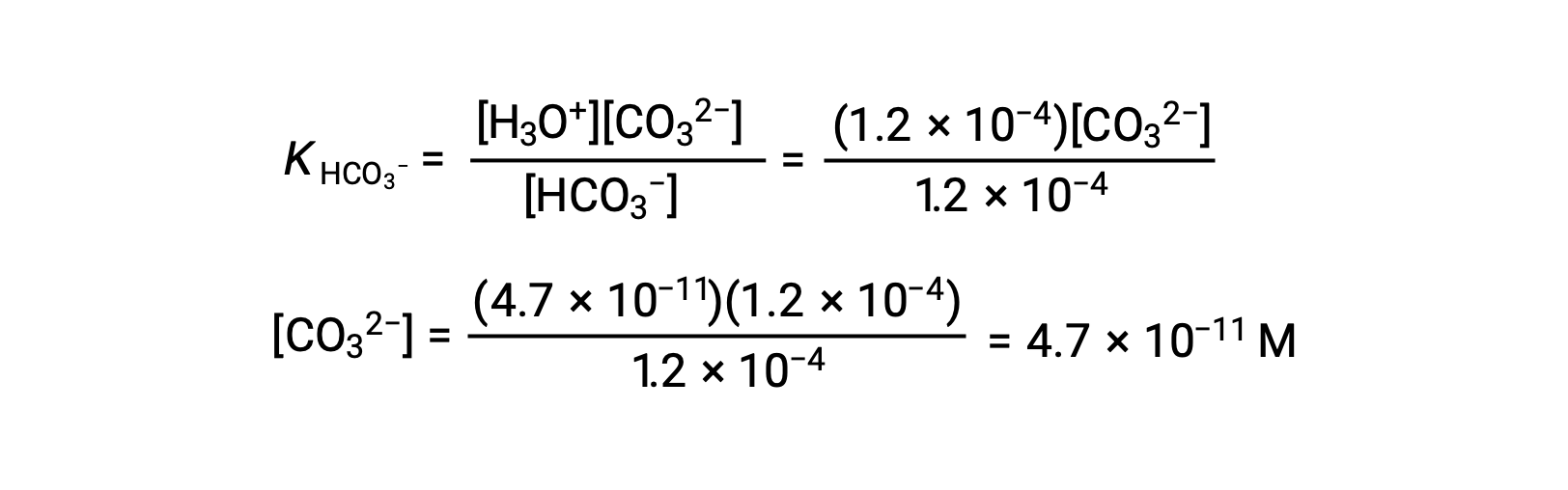
总结:处于平衡时 [H2CO3] = 0.033 M; [H3O+] = 1.2 × 10−4; [HCO3−] = 1.2 × 10−4 M; 且 [CO32−] = 4.7 × 10−11 M.
三质子酸是一种具有三个可电离 H 原子的酸。 磷酸就是一个例子:
| 三质子酸:磷酸 (H3PO4) | ||
| 1st 首次电离 | H3PO4 (aq) + H2O (l) ⇌ H3O+ (aq) + H2PO4− (aq) | Ka1 = 7.5 × 10−3 |
| 2nd 二次电离 | H2PO4− (aq) + H2O (l) ⇌ H3O+ (aq) + HPO42− (aq) | Ka2 = 6.2 × 10−8 |
| 3rd 三次电离 | HPO42− (aq) + H2O (l) ⇌ H3O+ (aq) + PO43− (aq) | Ka3 = 4.2 × 10−13 |
至于双质子酸示例,每一个连续电离反应都比前者的外延的小,反映在逐步酸电离常数的数值下降中。 这是多质子酸的一个一般特性,连续电离常数通常相差约 105 到 106。
这组三种离解反应似乎使 H3PO4 溶液中的平衡浓度计算变得复杂。 但是,由于连续电离常数相差 105 到 106,因此伴随电离反应的浓度小变化中存在很大差异。 这允许使用数学简化的假设和流程,如以上示例所示。 多质子碱能够接受多个氢离子。 碳酸盐离子是双质子碱的一个示例,因为它可以接受两个质子,如下所示。 与多质子酸的情况类似,请注意电离常数随着电离步骤的增加而减少。 同样,涉及多质子碱的平衡计算遵循与多质子酸相同的方法。

本文改编自 Openstax, 化学 2e, 第14.5节:多质子酸。
