16.5:
فعالية المحلول المنظِّم
16.5:
فعالية المحلول المنظِّم
لا تتمتع المحاليل المنظّمة بقدرة غير محدودة للحفاظ على درجة الحموضة ثابتة نسبيًا. بدلاً من ذلك، تعتمد قدرة المحلول المنظّم على مقاومة التغيرات في الأس الهيدروجيني على وجود كميات ملحوظة من الزوج المقترن لحمض ضعيف-قاعدة. عندما تضاف كميات من حمض قوي أو قاعدة للتقليل بشكل كبير من تركيز أي من طرف من زوج المحلول المنظّم، فإن قدرة عمل المحلول المنظّم داخل المحلول تصبح ضعيفة.
استطاعة المحلول المنظّم هي كمية الحمض أو القاعدة التي يمكن إضافتها إلى حجم معين من المحلول المنظّم قبل أن يتغير الرقم الهيدروجيني بشكل كبير، عادةً بواسطة وحدة واحدة. تعتمد استطاعة المحلول المنظّم على كميات الحمض الضعيف وقاعدته المقترنة الموجودة في مزيج منظم. على سبيل المثال، 1 لتر من محلول يساوي 1.0 مول في حمض الأسيتيك و 1.0 مول في أسيتات الصوديوم له سعة تخزين أكبر من 1 لتر من محلول يساوي 0.10 مول في حمض الأسيتيك و 0.10 مول في أسيتات الصوديوم على الرغم من أن كلا المحلين يحتويان على نفس الرقم الهيدروجيني. يحتوي المحلول الأول على استطاعة تنظيم أكبر لأنه يحتوي على المزيد من حمض الأسيتيك وأيون الأسيتات.
اختيار المزيج المنظّم المناسب
هناك قاعدتان مفيدتان لاختيار المزيج المنظّم:
- يجب أن يحتوي المزيج المنظّم الجيد على تركيزات متساوية لكل من مكوناته. يفقد المحلول المنظّم فائدته بشكل عام عندما يكون أحد مكونات زوج المحلول المنظّم أقل من حوالي 10٪ من الآخر.
- الأحماض الضعيفة وأملاحها أفضل كمواد منظّمة للأس الهيدروجيني الأقل من 7؛ القواعد الضعيفة وأملاحها أفضل كمواد منظّمة للأس الهيدروجيني أكبر من 7.
الدم هو مثال مهم للمحلول المنظّم، حيث يكون الحمض الأساسي والأيون المسؤولان عن عمل المحلول المنظّم هما حمض الكربونيك H2CO3 وأيون البيكربونات، HCO3−. عندما يتم إدخال أيون الهيدرونيوم إلى مجرى الدم، تتم إزالته بشكل أساسي عن طريق التفاعل:
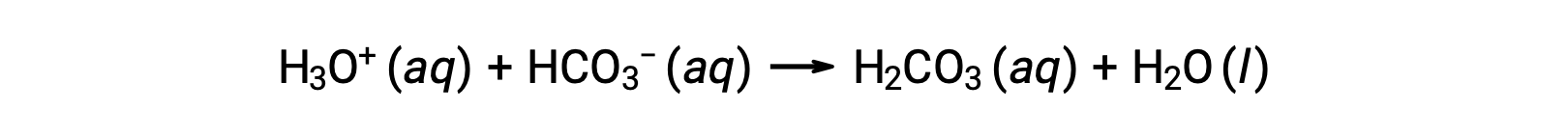
تتم إزالة أيون هيدروكسيد مضاف عن طريق التفاعل:
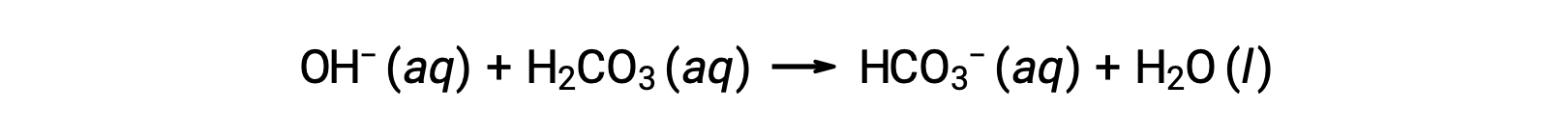
وهكذا يتم تحويل الحمض القوي أو القاعدة المضافين بشكل فعال إلى حمض أضعف أو قاعدة بالمقارنة مع زوج المحلول المنظّم (H3O+ يتم تحويلها إلى to H2CO3 و OH− يتم تحويلها إلى HCO3−). وهكذا يظل الرقم الهيدروجيني لدم الإنسان قريبًا جدًا من القيمة التي تحددها أزواج المحلول المنظّم pKa، في هذه الحالة، 7.35. عادة ما تكون الاختلافات الطبيعية في درجة الحموضة في الدم أقل من 0.1، ومن المرجح أن تكون التغيرات في درجة الحموضة بمقدار 0.4 أو أعلى قاتلة.
هذا النص مقتبس من Openstax, Chemistry 2e, Section 14.6: Buffers.
