16.5:
완충용액 효과성
16.5:
완충용액 효과성
버퍼 솔루션에는 pH를 비교적 일정하게 유지할 수 있는 무제한 용량이 없습니다. 대신, pH의 변화에 저항하는 버퍼 솔루션의 능력은 공주 약한 산염 염기 쌍의 상당한 양의 존재에 의존한다. 완충 쌍의 어느 부재의 농도를 실질적으로 낮추기 위해 충분한 강한 산 또는 염기가 첨가되면 용액 내의 버퍼링 작용이 손상됩니다.
버퍼 용량은 pH가 크게 변화하기 전에 버퍼 용액의 지정된 부피에 추가될 수 있는 산 또는 염기의 양입니다. 완충 용량은 완충 혼합물에 있는 약한 산 및 그 컨쥬게이트 베이스의 양에 따라 달라집니다. 예를 들어, 아세트산1.0M, 아세테이트 나트륨 1.0M인 용액 1L은 아세트산에서 0.10M, 아세테이트 나트륨0.10M인 용액의 1L보다 더 큰 완충 용량을 가지며, 두 솔루션 모두 동일한 pH를 가지고 있음에도 불구하고 아세테이트 나트륨에서 0.10M이다. 첫 번째 솔루션은 더 많은 아세트산과 아세테이트 이온을 포함하기 때문에 더 많은 완충 용량을 가지고 있습니다.
적합한 버퍼 혼합물 선택
버퍼 혼합물을 선택하는 데 두 가지 유용한 규칙이 있습니다.
- 좋은 버퍼 혼합물은 두 구성 요소의 동일한 농도를 가져야합니다. 버퍼 솔루션은 버퍼 쌍의 한 구성 요소가 다른 구성 요소의 약 10% 미만일 때 일반적으로 유용성을 잃었습니다.
- 약한 산과 소금은 7 미만의 pHs에 대한 완충제로 더 좋습니다. 약한 기지와 소금은 7보다 큰 pHs의 버퍼로 더 좋습니다.
혈액은 카보산,H2CO3,및 중탄산염 이온, HCO3–완충 작용에 대한 책임이있는 주산 및 이온과 함께 완충 된 용액의 중요한 예입니다. 하이드로늄 이온이 혈류에 도입되면 주로 반응에 의해 제거됩니다.
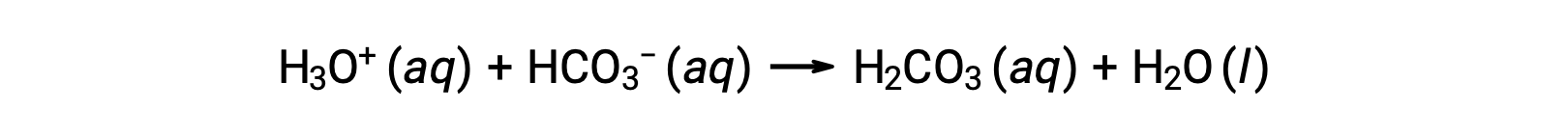
추가 된 수산화 이온은 반응에 의해 제거됩니다.
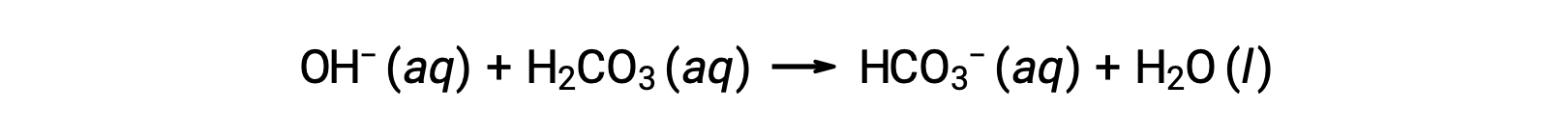
첨가된 강한 산 또는 염기는 따라서 효과적으로 완충 쌍의 훨씬 약한 산 또는 염기로 변환됩니다 (H3O+ H2CO3및 OH로 변환됩니다 – HCO3-로 변환됩니다.). 따라서 인간의 혈액의 pH는 완충쌍 pKa에의해 결정된 값 에 매우 가깝게 남아 있으며, 이 경우 7.35. 혈액 pH의 정상적인 변이는 일반적으로 0.1 미만이며, 0.4 이상의 pH 변화는 치명적일 가능성이 높습니다.
