16.7:
滴定计算:弱酸 - 弱碱
A subscription to JoVE is required to view this content. Sign in or start your free trial.
JoVE Core
Chemistry
Titration Calculations: Weak Acid – Strong Base
弱酸或弱碱滴定不同阶段的 pH 值,可以使用不同的方法在不同的滴定点 进行计算。如果弱酸或弱碱是 pH 值的主要决定因素,则使用 Ka 或 Kb 和 ICE 表,或亨德森-哈塞尔巴尔赫 方程。如果中和反应后存在 强酸或强碱,则使用 剩余的水合氢离子或氢氧化物离子 的浓度来计算 pH 值。50 毫升 0.10M 醋酸溶液的初始 pH 值 为 2.87,是使用 Ka 和 ICE 表 计算出来的,因为醋酸是主要的贡献者。如果用 0.10M 氢氧化钠滴定 含有 0.0050 摩尔醋酸盐的此溶液,氢氧化物离子与醋酸反应生成醋酸盐,形成缓冲液。因此,当添加 10 毫升含有 0.0010 摩尔 氢氧化物离子的氢氧化钠时,形成 0.0010 摩尔的醋酸盐,并且剩余 0.0040 摩尔的醋酸。缓冲液的 pH 值可以通过 将这些值代入亨德森-哈塞尔巴尔赫方程来计算,等于 4.14。当加入 25 毫升氢氧化钠时,醋酸的初始摩尔数的一半 被转化为醋酸盐。此时,pH 值等于 pKa 值,因为醋酸和醋酸盐离子的量相等。进一步添加氢氧化钠至 50 毫升 会把所有的醋酸分子转化成醋酸盐,同时达到等值点。由于醋酸盐离子是碱性的,所以其 等值点在碱性区。醋酸盐离子的浓度 是用摩尔数除以 溶液的总体积来计算的。pH 值是使用醋酸根离子的 Kb 和 ICE 表来确定的,因为醋酸根离子是等值点处 pH 值的 主要贡献者。醋酸盐的 Kb 是使用 公式 Kw 等于 Ka 乘以 Kb 来计算的,等于 5.6×10⁻¹⁰。将平衡浓度代入 Kb 的表达式,给出氢氧化物浓度,5.3 10⁻⁶ M。溶液的 pOH 和 pH 值分别为 5.28 和 8.72。在溶液中进一步添加氢氧化钠,会产生醋酸盐离子和氢氧化钠 的混合物。然而,氢氧化钠的最终浓度 决定了溶液的pH值,因为它是一种比醋酸盐更强的碱。因此,如果向溶液中加入 70 毫升 氢氧化钠,氢氧化物离子的最终浓度 可通过从添加的氢氧化物离子的 总摩尔数,0.0070摩尔,中减去 乙酸的总摩尔数,0.0050摩尔,再除以溶液的总体积,120 毫升或 0.12 升,来计算。由于氢氧化物离子的浓度为 0.017M,溶液的 pOH 和 pH 值 分别计算为 1.78 和 12.22。
16.7:
滴定计算:弱酸 - 弱碱
计算滴定溶液的 pH 值:弱酸 / 强碱
对于带有 0.100 M NaOH 的 25.00 mL 0.100 M CH3CO2H 滴定,反应可以表示为:
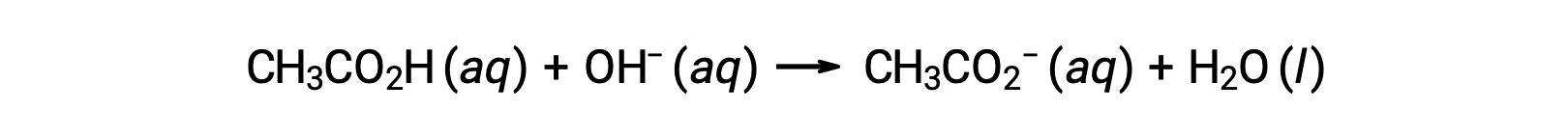
添加不同数量的 NaOH 滴定剂后滴定溶液的 pH 值可按以下公式计算:
(a) 在通常的冰法中为乙酸溶液计算初始 pH 值:
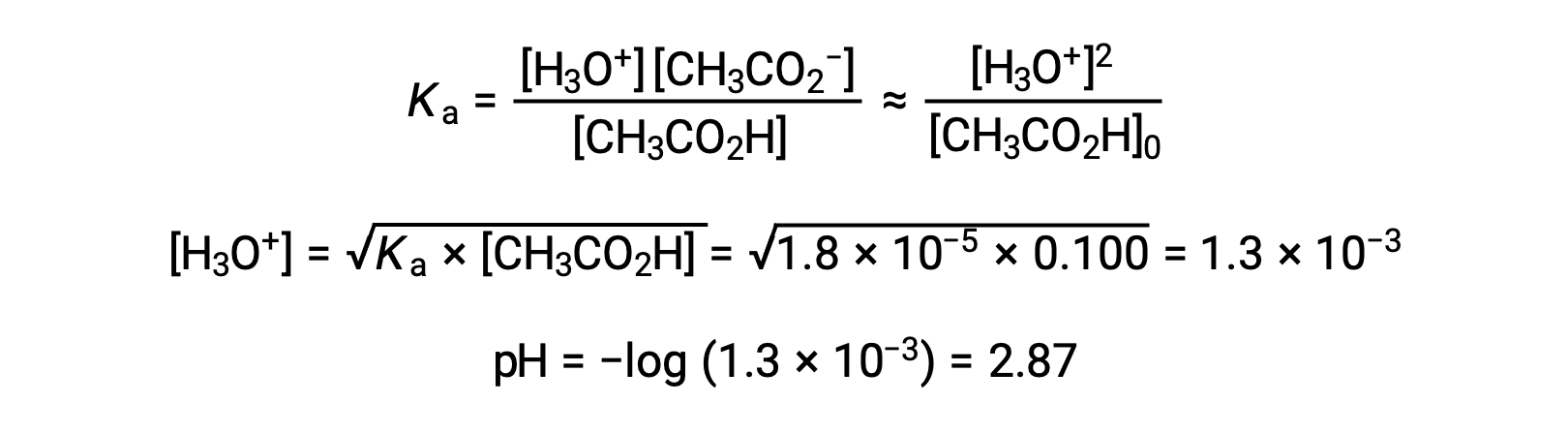
(b) 酸和滴定剂都是单原子体,样本和滴定剂溶液也同样浓度;因此,滴定剂的这一体积代表等效点。 与强酸示例不同,本例中的反应混合物含有弱共轭碱 (醋酸盐离子)。 溶液 pH 值是根据乙酸盐的碱电离计算得出的,该电离存在于的浓度中
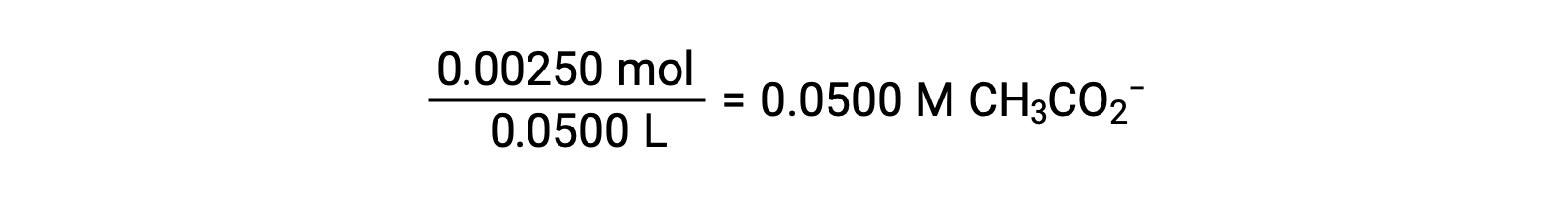
乙酸乙酸的碱电离由方程表示
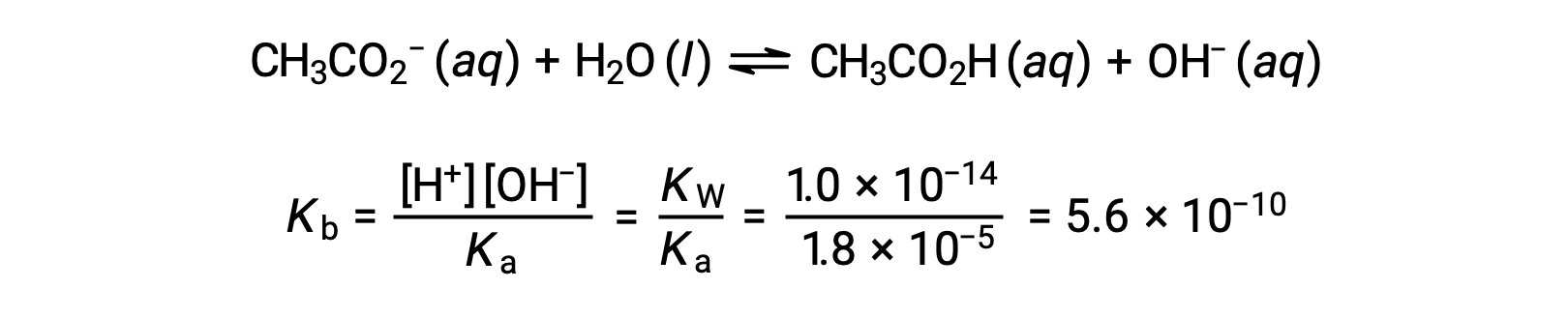
假设 x <<0.0500 , pH 值可以通过通常的冰法计算:
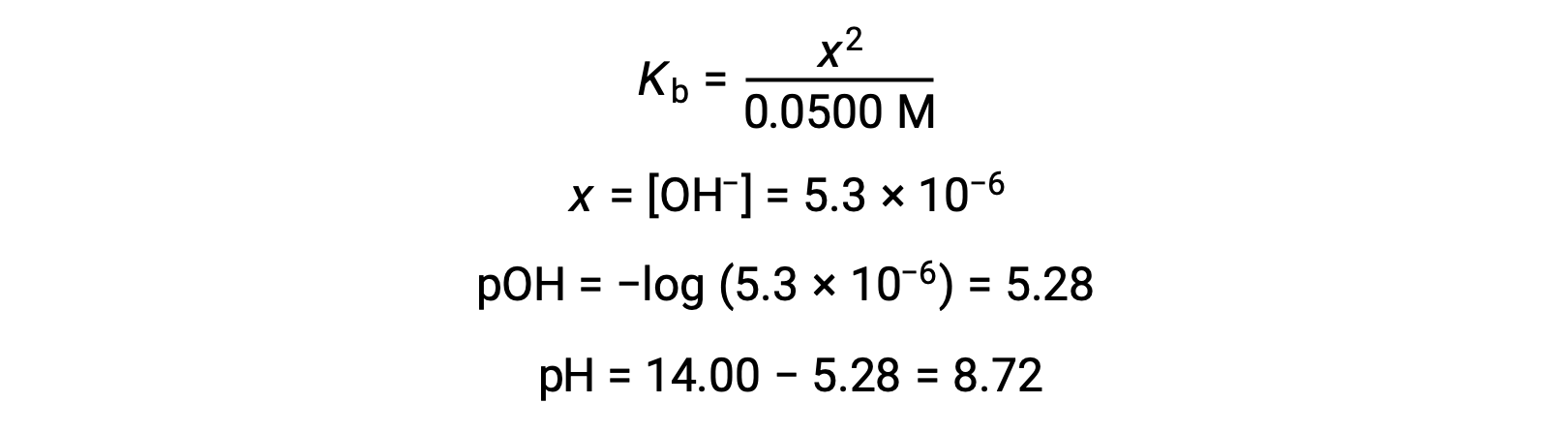
请注意,当对具有强碱的弱酸进行滴定时,该滴定的等效点的 pH 值明显为大于 7。
(C) 滴液体积 = 12.50 mL。 这种体积代表滴定物质的化学化学比数量的一半,因此,半数乙酸被中和到产率等效的醋酸离子数量。 因此,这些共轭 酸-碱 合作伙伴的浓度相等。 计算 pH 值的一个方便方法是使用 亨德森-哈塞尔巴尔赫方程(Henderson-Hasselbalch Equation) :
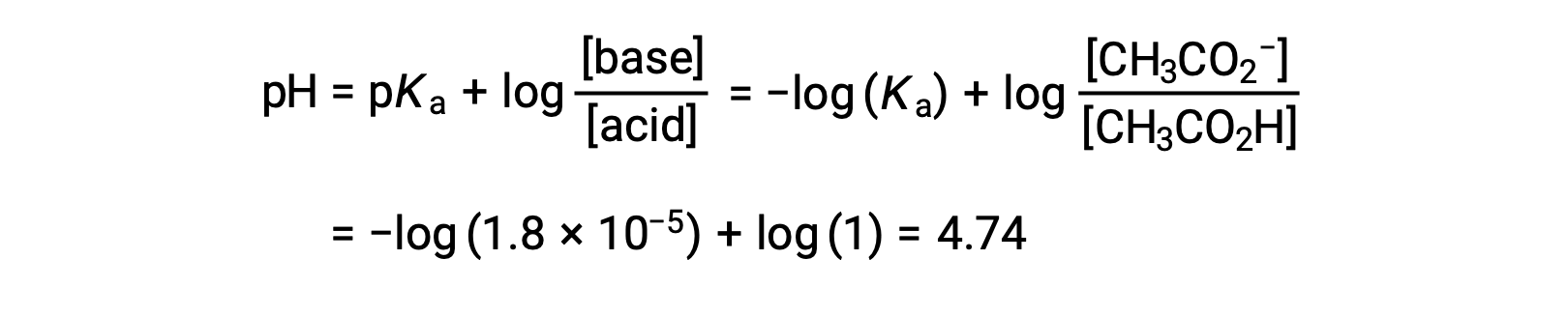
(pH = 滴定中半等效点的 pka 弱酸)
(d) 滴液体积 = 37.50 mL。 该体积表示滴定物质的化学比浊度过量,以及含有滴定生成物,醋酸盐离子和强滴定物质的反应溶液。 在这种溶液中,溶液 pH 主要由超强碱的数量测定:

