16.12:
Formação de Íons Complexos
16.12:
Formação de Íons Complexos
Um tipo de química ácido-base de Lewis envolve a formação de um ião complexo (ou um complexo de coordenação) que compreende um átomo central, tipicamente um catião de metal de transição, rodeado por iões ou moléculas chamadas ligandos. Estes ligandos podem ser moléculas neutras como H2O ou NH3, ou iões como CN− ou OH−. Muitas vezes, os ligandos agem como bases de Lewis, doando um par de eletrões ao átomo central. Esses tipos de reações ácido-base de Lewis são exemplos de uma ampla subdisciplina chamada química de coordenação—o tópico de outro capítulo neste texto.
A constante de equilíbrio para a reação de um ião metálico com um ou mais ligandos para formar um complexo de coordenação é chamada de constante de formação (Kf) (às vezes chamada de constante de estabilidade). Por exemplo, o ião complexo [Cu(CN)2]− é produzido pela reação
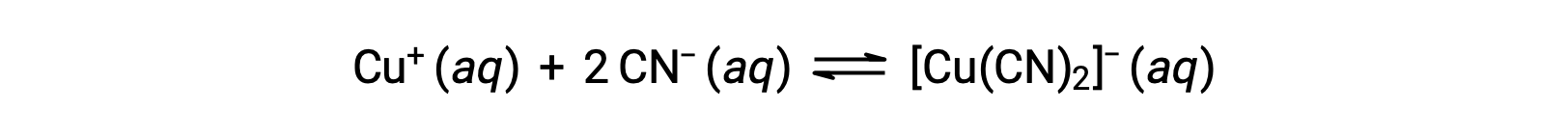
A constante de formação para esta reação é
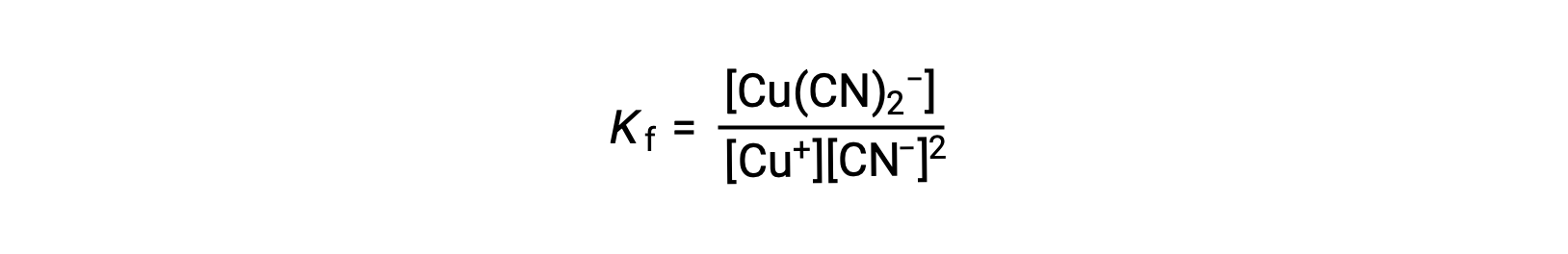
Alternativamente, a reação inversa (decomposição do ião complexo) pode ser considerada, sendo neste caso a constante de equilíbrio uma constante de dissociação (Kd). De acordo com a relação entre constantes de equilíbrio para reações recíprocas descritas, a constante de dissociação é o inverso matemático da constante de formação, Kd = Kf−1.
Como um exemplo de dissolução por formação de iões complexos, considere o que acontece quando se adiciona amoníaco aquoso a uma mistura de cloreto de prata e água. O cloreto de prata dissolve-se ligeiramente em água, dando uma pequena concentração de Ag+ ([Ag+] = 1,3 × 10−5 M):
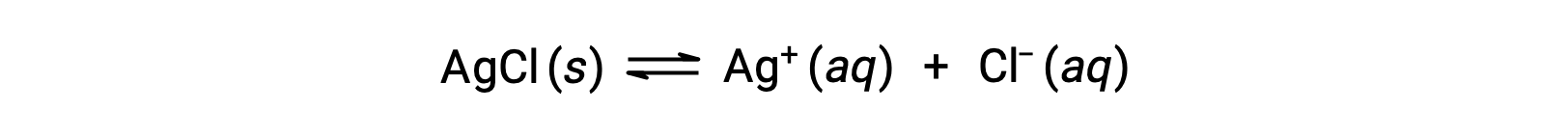
No entanto, se existir NH3 na água, o ião complexo, [Ag(NH3)2]+, pode formar-se de acordo com a equação:
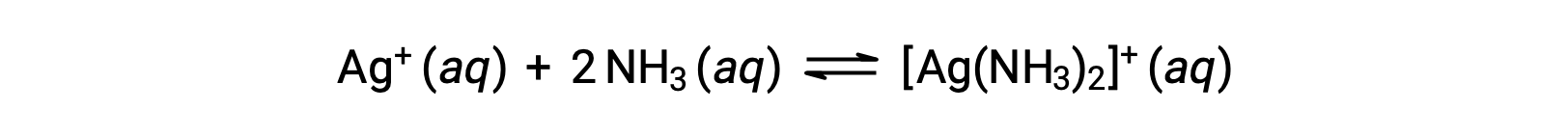
Este texto é adaptado de Openstax, Chemistry 2e, Section 15.2: Lewis Acids and Bases.
Suggested Reading
- Xie, Feng, and David B. Dreisinger. "Leaching of silver sulfide with ferricyanide–cyanide solution." Hydrometallurgy 88, no. 1-4 (2007): 98-108.
- Glueck, A. R. "Desalination by an ion exchange-precipitation-complex process." Desalination 4, no. 1 (1968): 32-37.
- Shakhashiri, Bassam Z., Glen E. Dirreen, and Fred Juergens. "Solubility and complex ion equilibria of silver (I) species in aqueous solution." Journal of Chemical Education 57, no. 11 (1980): 813.
