17.4:
القانون الثالث للديناميكا الحرارية
17.4:
القانون الثالث للديناميكا الحرارية
يمكن وصف مادة صلبة نقية متبلورة تمامًا لا تمتلك طاقة حركية (أي عند درجة حرارة الصفر المطلق ، 0 كلفن) بواسطة دولة دقيقة واحدة ، باعتبارها نقاوتها ، وبلورتها الكاملة ، وكاملها. نقص الحركة يعني أنه لا يوجد سوى موقع واحد محتمل لكل ذرة أو جزيء متطابق يتألف من البلورة (W = 1). وفقًا لمعادلة بولتزمان، فإن إنتروبيا هذا النظام تساوي صفرًا.
p style=”text-align: center”>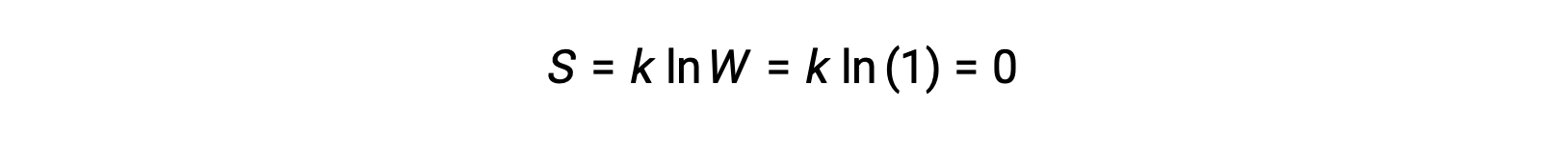
تمثل هذه الحالة المحدِّدة لانتروبيا النظام’ القانون الثالث للديناميكا الحرارية: إنتروبيا مادة بلورية نقية ومثالية عند 0 كلفن هي صفر.
يمكن إجراء قياسات حرارية دقيقة لتحديد الاعتماد على درجة حرارة إنتروبيا مادة’ ما ولاشتقاق قيم الانتروبيا المطلقة في ظل ظروف محددة. الانتروبيا القياسية (S°) هي لمول واحد من مادة في ظل الظروف القياسية. المواد المختلفة لها قيم مختلفة للإنتروبيا المولية وفقًا للحالة الفيزيائية للمادة'، والكتلة المولية، والأشكال المتآصلة، والتعقيد الجزيئي، ومدى الذوبان.
نظرًا لزيادة تشتت الطاقة بين الجسيمات المتناثرة في الطور الغازي، تميل الأشكال الغازية للمواد إلى أن يكون لها محتوى مولاري قياسي أكبر بكثير من أشكالها السائلة. لأسباب مماثلة ، تميل الأشكال السائلة من المواد إلى أن يكون لها قيم أكبر من أشكالها الصلبة. على سبيل المثال، S°H2O (l) = 70 J/mol·K and S°H2O (g) = 188.8 J/mol·K.
من بين العناصر الموجودة في نفس الحالة، يكون للعنصر الأثقل (الكتلة المولية الأكبر) قيمة إنتروبيا قياسية أعلى من العنصر الأخف. على سبيل المثال، S°Ar (g) = 154.8 J/mol·K and S°Xe (g) = 159.4 J/mol·K.
وبالمثل ، من بين المواد الموجودة في نفس الحالة ، تحتوي الجزيئات الأكثر تعقيدًا على قيم محتوى حراري مولاري أعلى من القيم البسيطة. هناك المزيد من الترتيبات الممكنة للذرات في جزيئات أكبر وأكثر تعقيدًا، مما يزيد من عدد الدول المجهرية الممكنة. على سبيل المثال، S°Ar (g) = 154.8 جول/مول·كلفن and S°NO (g) = 210.8 جول/مول·كلفن على الرغم من ارتفاع الكتلة المولية للأرجون. هذا لأنه في الأرجون الغازي ، تأخذ الطاقة شكل حركة انتقالية للذرات، بينما في أكسيد النيتريك الغازي (NO) ، تأخذ الطاقة شكل حركة انتقالية ، وحركة دورانية ، و (عند درجات حرارة عالية بما يكفي) حركات اهتزازية للجزيئات .
تزداد الإنتروبيا المولية القياسية لأي مادة مع زيادة درجة الحرارة. في انتقالات الطور ، مثل الانتقال من الحالة الصلبة إلى السائلة والسائلة إلى الغاز ، تحدث قفزات كبيرة في الانتروبيا ، ويرجع ذلك إلى زيادة الحركة الجزيئية المفاجئة وزيادة الأحجام المتاحة المرتبطة بتغيرات الطور.
هذا النص مقتبس من Openstax, Chemistry 2e, Chapter 16.2: The Second and Third Law of Thermodynamics.
