15.2:
Forze acido / base e costanti di dissociazione
15.2:
Forze acido / base e costanti di dissociazione
La forza relativa di un acido o di una base è la misura in cui ionizza quando viene sciolto in acqua. Se la reazione di ionizzazione è essenzialmente completa, l’acido o la base è definita forte; se si verifica una ionizzazione relativamente piccola, l’acido o la base è debole. Ci sono molti più acidi e basi deboli di quelli forti. Gli acidi e le basi forti più comuni sono elencati di seguito:
| Acidi forti | Basi forti |
| HClO4 | Lioh |
| Hcl | Naoh |
| Hbr | Koh |
| Ciao | Ca(OH)2 |
| HNO3 | Sr(OH)2 |
| H2SO4 | Ba(OH)2 |
I punti di forza relativi degli acidi possono essere quantificati misurando le loro costanti di equilibrio in soluzioni acquose. In soluzioni della stessa concentrazione, gli acidi più forti ionizzano in misura maggiore e quindi producono concentrazioni più elevate di ioni di idronio rispetto agli acidi più deboli. La costante di equilibrio per un acido è chiamata costante di ionizzazione acida, Ka. Per la reazione di un acido HA:
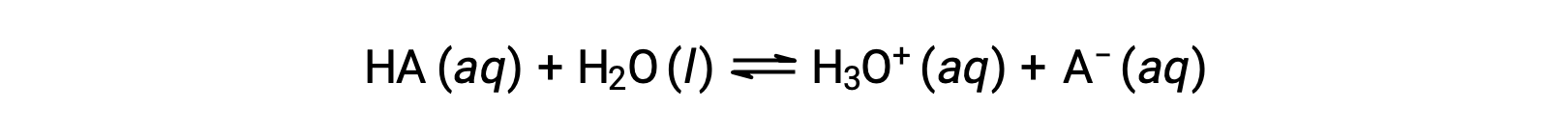
la costante di ionizzazione acida è scritta come
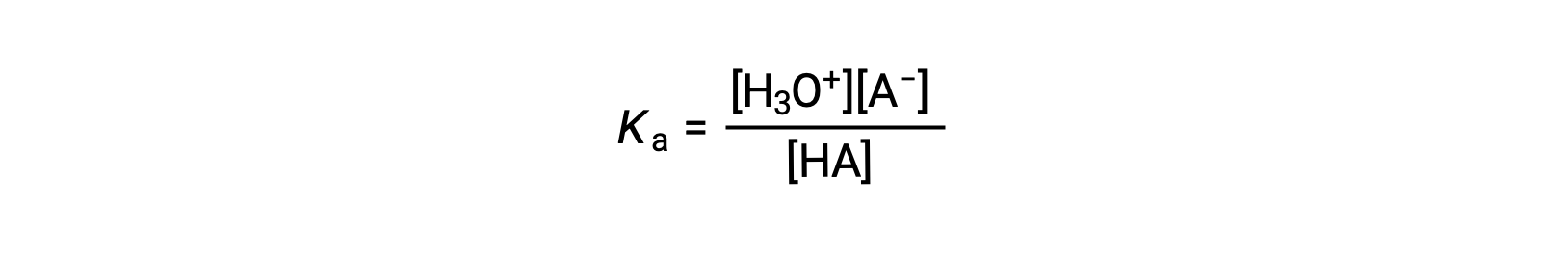
dove le concentrazioni sono quelle in equilibrio. Sebbene l’acqua sia un reagente nella reazione, è anche il solvente, quindi non includiamo [H2O] nell’equazione. Più grande è la Ka di un acido, maggiore è la concentrazione di H3O+ e A− rispetto alla concentrazione dell’acido non ionizzato, HA, in una miscela di equilibrio, e più forte è l’acido. Un acido è classificato come “forte” quando subisce una ionizzazione completa, nel qual caso la concentrazione di HA è zero e la costante di ionizzazione acida è incommensurabilmente grande(Ka ≈ ∞). Gli acidi parzialmente ionizzati sono chiamati “deboli”, e le loro costanti di ionizzazione acida possono essere misurate sperimentalmente.
Per illustrare questa idea, di seguito sono mostrate tre equazioni di ionizzazione acidae valori Ka. Le costanti di ionizzazione aumentano dalla prima all’ultima delle equazioni elencate, indicando che la forza relativa dell’acido aumenta nell’ordine CH3CO2H < HNO2 < HSO4−.
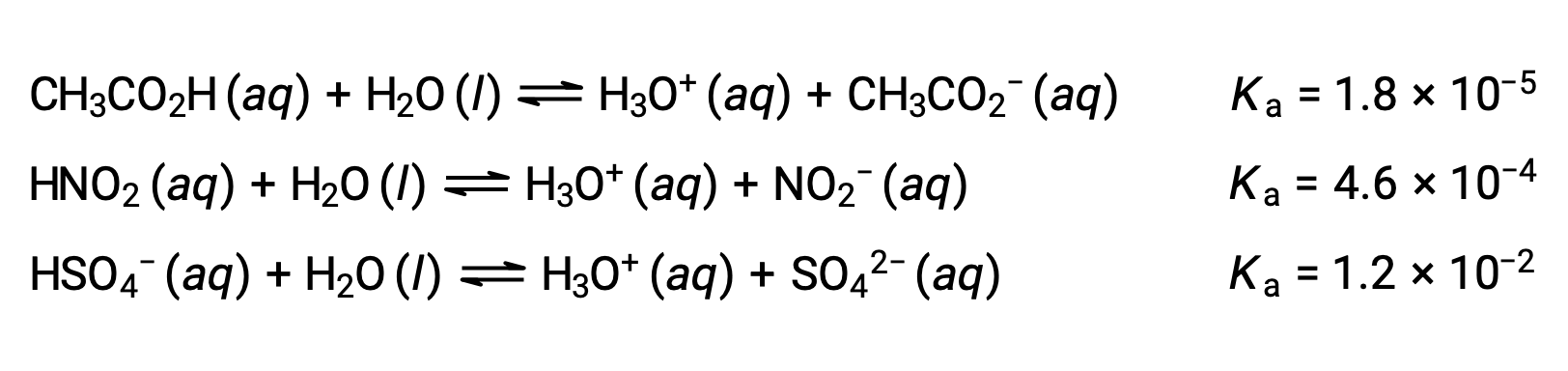
Un’altra misura della forza di un acido è la sua ionizzazione percentuale. La ionizzazione percentuale di un acido debole è definita in termini di composizione di una miscela di equilibrio:
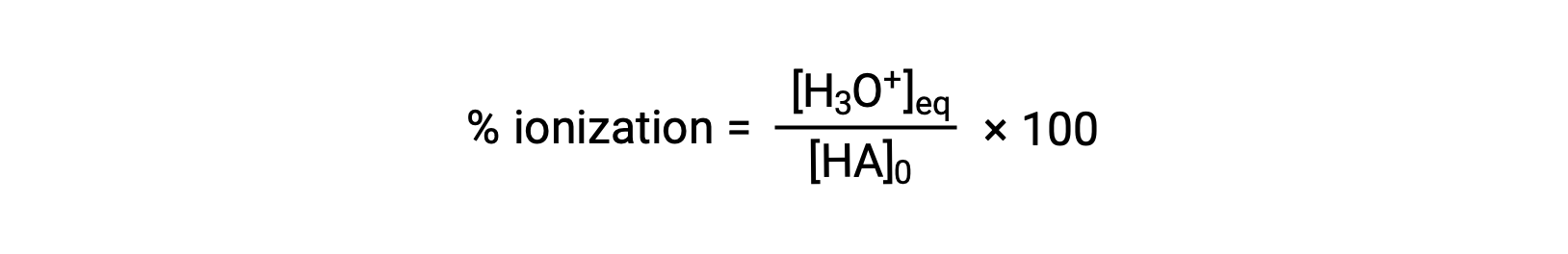
dove il numeratore è equivalente alla concentrazione della base coniugata dell’acido (per stechiometria, [A−] = [H3O+]). A differenza del valore Ka, la ionizzazione percentuale di un acido debole varia con la concentrazione iniziale di acido, tipicamente diminuendo all’aumentare della concentrazione.
Proprio come per gli acidi, la forza relativa di una base si riflette nella grandezza della sua costante di ionizzazione di base (Kb) in soluzioni acquose. In soluzioni della stessa concentrazione, basi più forti ionizzano in misura maggiore, producendo così concentrazioni di ioni idrossido più elevate rispetto alle basi più deboli. Una base più forte ha una costante di ionizzazione più grande di una base più debole. Per la reazione di una base, B:
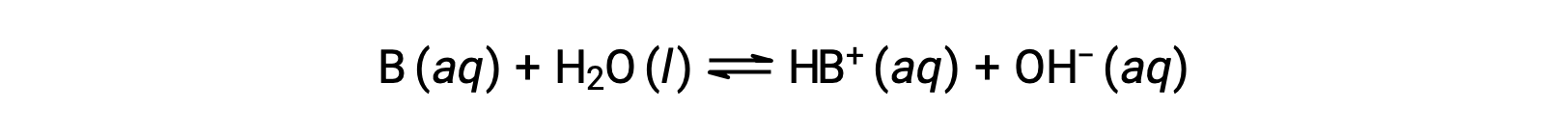
la costante di ionizzazione è scritta come
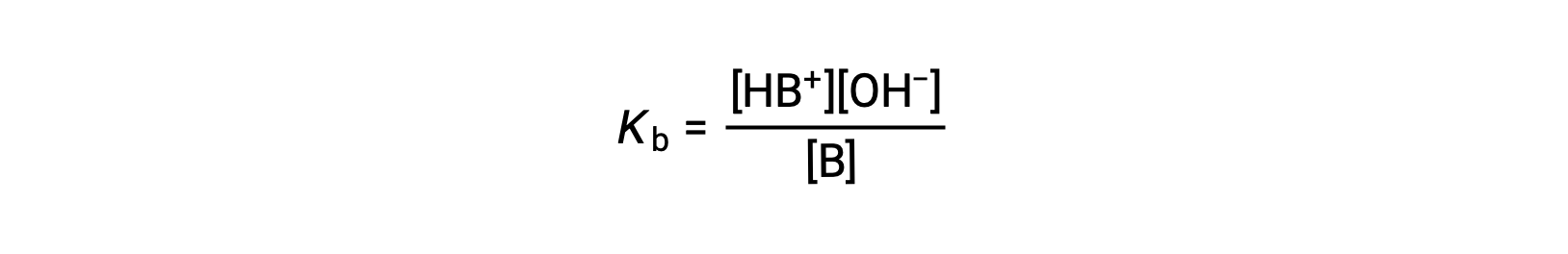
L’ispezione dei dati per tre basi deboli presentate di seguito mostra l’aumento della forza di base nell’ordine NO2− < CH2 CO2− < NH3.
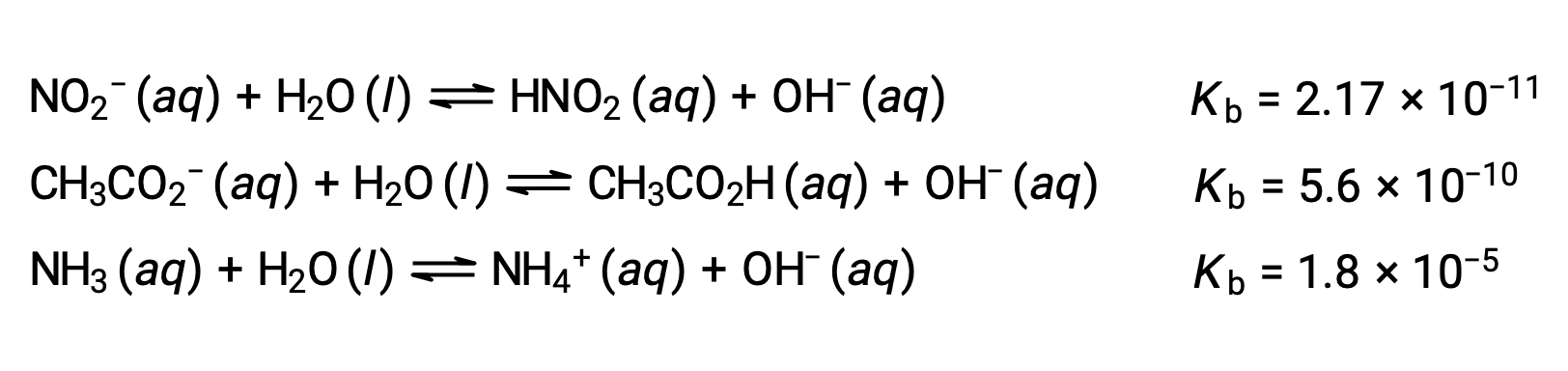
Per quanto riguarda gli acidi, la forza relativa di una base si riflette anche nella sua ionizzazione percentuale, calcolata come
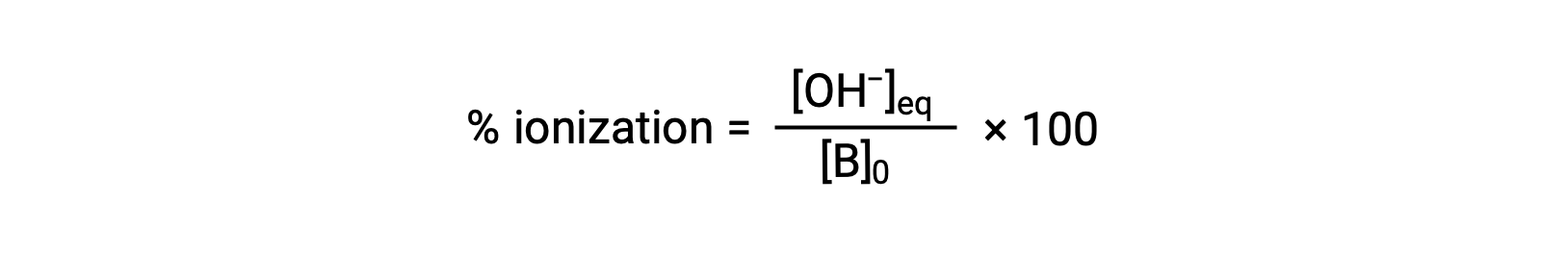
ma varierà a seconda della costante di ionizzazione di base e della concentrazione iniziale della soluzione.
Questo testo è adattato da Openstax, Chimica 2e, Sezione 14.3: Punti di forza relativi di acidi e basi.
