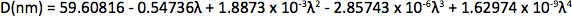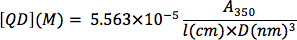נקודות קוונטיות קומפקטיות להדמית מולקולה בודדה
Summary
אנו מתארים את ההכנה של נקודתי קוונטיות colloidal עם גודל הידרודינמית ממוזער עבור דימות פלואורסצנטי מולקולה בודדה. בהשוואה לנקודות קוונטיות קונבנציונליות, חלקיקים אלה הם בגודל דומים לחלבונים כדוריים ומותאמים לבהירות מולקולה בודדה, יציבות נגד photodegradation, והתנגדות לקשירה לא ספציפית לחלבונים ותאים.
Abstract
הדמיה יחידה מולקולה היא כלי חשוב להבנת המנגנונים של תפקוד biomolecular ולהמחשת הטרוגניות מרחב ובזמן של התנהגויות מולקולריות שבבסיס ביולוגיה תאית 1-4. לתמונת מולקולה בודדה של עניין, זה בדרך כלל מוצמד לניאון תג (צבע, חלבון, חרוז, או נקודה קוונטית) ונצפה עם השתקפות מיקרוסקופ הפנימי epifluorescence או מלא פלואורסצנטי (TIRF). אמנם צבעים וחלבוני ניאון היו עמוד התווך של דימות פלואורסצנטי במשך עשרות שנים, הקרינה שלהם אינה יציבה תחת נתיבים גבוהים פוטון דרושים כדי להתבונן מולקולות בודדות, מניב רק כמה שניות של התבוננות לפני האובדן מוחלט של אות. חרוזים וחרוזי לטקס צבע כותרת-לספק יציבות אות השתפרה אבל על חשבון גודל הידרודינמית דרסטי גדול יותר, שיכול לשנות deleteriously דיפוזיה וההתנהגות של המולקולה נחקרת.
ntent "> נקודות קוונטיות (QDs) מציע איזון בין שני משטרים הבעייתיים אלה. חלקיקים אלה מורכבים מחומרים מוליכים למחצה ויכולים להיות מהונדס בגודל hydrodynamically קומפקטי עם עמידות יוצאת דופן לphotodegradation 5. כך בשנים האחרונות QDs היה גורם חשוב במאפשר תצפית ארוכת טווח של התנהגות macromolecular המורכבת ברמת המולקולה הבודדה. עם זאת חלקיקים אלה עדיין נמצאו להפגין דיפוזיה מולקולריות לקויה בסביבות צפופות כגון ציטופלסמה התאית ועצבית סינפטית שסועה, בו הגדלים שלהם עדיין גדולים מדי 4,6 , 7.לאחרונה יש לנו מהונדסים הליבות וציפויי פני שטח של QDs לגודל הידרודינמית ממוזער, תוך איזון קיזוז ליציבות colloidal, photostability, בהירות, ומחייב לא ספציפי שהפריע את התועלת של QDs הקומפקטי ב8,9 העבר. מטרת מאמר זה היא להראותהסינתזה, שינוי, והאפיון של nanocrystals אופטימיזציה אלה, מורכבים ממ"כ x Cd ליבת 1-x Se alloyed מצופה בבידוד Cd y 1-y Zn S קליפה, נוסף מצופה בפולימר יגנד multidentate שונה עם פוליאתילן גליקול הקצרה ( PEG) שרשרות (איור 1). לעומת nanocrystals CdSe הקונבנציונלי, כספית x Cd סגסוגות 1-x Se מציעות תשואות גבוהות יותר של קוונטי פלואורסצנטי, פלואורסצנציה באורכי גל אדומים וקרובים אינפרא אדום לאות לרעש משופר בתאים, ועירור בתחום האור הנראה אינם ציטוטוקסיות. ציפויים פולימריים Multidentate להיקשר אל פני שטח ננו בקונפורמציה סגורה והשטוחה כדי למזער את הגודל הידרודינמית, וPEG מנטרל את מטען המשטח כדי למזער מחייבים לא ספציפית לתאים וביומולקולות. התוצאה הסופית היא ננו מאור ניאון עם פליטה בין 550-800 ננומטר וגודל הידרודינמית כמעט מוחלט 12 ננומטר. זה ביםטווח גודל ame כמו חלבונים רבים מסיסים בתאים כדוריים וקטנים באופן משמעותי מQDs PEGylated הקונבנציונלי (25-35 ננומטר).
Protocol
Representative Results
Discussion
בהשוואה לנקודות קונבנציונליות CdSe קוונטים, nanocrystals סגסוגת המשולשת הכספי x Cd 1-x Se יכול להיות מכוון בגודל ובאורך גל פלואורסצנטי באופן עצמאי. הגודל נבחר לראשונה במהלך הסינתזה של ננו CdSe ליבות, ואורך גל פלואורסצנטי נבחר בצעד משני כספית קטיון חליפין, שאינו משמעות…
Disclosures
The authors have nothing to disclose.
Acknowledgements
המחברים מבקשים להודות לד"ר הונג יי בליבה המיקרוסקופית המשולבת אוניברסיטת האמורי להדמיה מיקרוסקופית אלקטרונים. עבודה זו מומנה על ידי מענקי NIH (PN2EY018244, R01 CA108468, U54CA119338, ו1K99CA154006-01).
Materials
| Name of the reagent | Company | Catalogue number | Comments (optional) |
| Selenium | Sigma-Aldrich | 229865 | |
| Tri-n-octylphosphine | Strem | 15-6655 | 97% pure, unstable in air |
| Cadmium oxide | Sigma-Aldrich | 202894 | Highly toxic: use caution |
| Tetradecylphosphonic acid | PCI Synthesis | 4671-75-4 | |
| Octadecene | Alfa Aesar | L11004 | Technical grade |
| Hexadecylamine | Sigma-Aldrich | H7408 | |
| Diphenylphosphine | Sigma-Aldrich | 252964 | Pyrophoric |
| Mercury acetate | Sigma-Aldrich | 456012 | Highly toxic: use caution |
| 1-Octanethiol | Sigma-Aldrich | 471836 | Strong odor |
| Oleic acid | Sigma-Aldrich | W281506 | |
| Zinc acetate | Alfa Aesar | 35792 | |
| Cadmium acetate hydrate | Sigma-Aldrich | 229490 | Highly toxic: use caution |
| Oleylamine | Fisher Scientific | AC12954 | Unstable in air |
| Sulfur | Sigma-Aldrich | 344621 | |
| Trioctylphosphine oxide | Strem | 15-6661 | 99% |
| Pyridine | VWR | EM-PX2012-6 | Anhydrous |
| Thioglycerol | Sigma-Aldrich | M1753 | Strong odor |
| Triethylamine | Sigma-Aldrich | 471283 | Anhydrous |
| Dialysis tubing | Spectrum Labs | 131342 | 20 kDa cutoff |
| Centrifugal filter | Millipore | UFC801024 | 10 kDa cutoff |
| Monoamino-PEG | Rapp Polymere | 12 750-2 | 750 Da |
| DMTMM, 4-(4,6-Dimethoxy-1,3,5-triazin-2-yl)-4-methylmorpholinium chloride hydrate | Alfa Aesar | H26333 | |
| AKTAprime Plus Chromatography System | GE HealthCare | ||
| Superose 6 10/300 GL chromatography column | GE HealthCare | 17-5172-01 | |
| Agarose, OmniPur | VWR | EM-2120 | |
Appendix Synthesis of mercury octanethiolate: Slowly add a methanol solution of mercury acetate (1 eq.) to a stirring solution of 1-octanethiol (3 eq.) and potassium hydroxide (3 eq.) in methanol at room temperature. Isolate the mercury(II) octanethiolate precipitate via filtration, wash two times with methanol and once with ether, and then dry under vacuum. Synthesis of multidentate polymer: Dissolve polyacrylic acid (1 g, 1,773 Da) in 25 ml dimethylformamide (DMF) in a 150 ml three-necked flask and bubble with argon for 30 min. Add an anhydrous solution of cysteamine (374 mg, 4.87 mmol) in 10 ml DMF. At room temperature with vigorous stirring, slowly add anhydrous diisopropylcarbodiimide (DIC, 736 mg, 5.83 mmol) over 30 min, followed by triethylamine (170 μl, 1.22 mmol), and allow the reaction to proceed for 72 hr at 60 °C. Add mercaptoethanol (501 mg, 6.41 mmol) to quench the reaction, and stir for 2 hr at room temperature. Remove DMF via rotary evaporation and isolate the polymer with the addition of a 2:1 mixture of ice-cold acetone:chloroform, followed by centrifugation. Dissolve the polymer in ~5 ml anhydrous DMF, filter, precipitate again with diethyl ether, and repeat. Dry the product under vacuum and store under argon. Determination of CdSe core diameter: From the UV-Vis absorption spectrum determine the wavelength of the first exciton peak (λ, in nm), which is the longest-wavelength peak (e.g. roughly 498 nm for CdSe in Figure 2a), and use the sizing curve of Mulvaney and coworkers 12:
Determination of CdSe nanocrystal concentration: From a background-subtracted UV-Vis spectrum of an optically clear solution of CdSe nanocrystals, determine the absorption at 350 nm wavelength. Serial dilutions can be used to determine if the optical absorption is within the linear range of Beer’s Law. The nanocrystal concentration (QD, in M) can be determined by plugging in the nanocrystal diameter (D, in nm), the optical absorption value (A3sa), and the cuvette path length (l, in cm) into the following equation from the empirical correlation of Bawendi and coworkers 13:
|
References
- Toprak, E., Selvin, P. R. New fluorescent tools for watching nanometer-scale conformational changes of single molecules. Annu. Rev. Biophys. Biomol. Struct. 36, 349-369 (2007).
- Joo, C., Balci, H., Ishitsuka, Y., Buranachai, C., Ha, T. J. Advances in single molecule fluorescence methods for molecular biology. Annu. Rev. Biochem. 77, 51-76 (2008).
- Pinaud, F., Clarke, S., Sittner, A., Dahan, M. Probing cellular events, one quantum dot at a time. Nat. Method. 7, 275-285 (2010).
- Smith, A. M., Wen, M. M., Nie, S. M. Imaging dynamic cellular events with quantum dots. Biochemist. 32, 12-17 (2010).
- Smith, A. M., Duan, H. W., Mohs, A. M., Nie, S. M. Bioconjugated quantum dots for in vivo molecular and cellular imaging. Adv. Drug Deliv. Rev. 60, 1226-1240 (2008).
- Smith, A. M., Nie, S. M. Next-generation quantum dots. Nature Biotech. 27, 732-733 (2009).
- Groc, L., Lafourcade, M., Heine, M., Renner, M., Racine, V., Sibarita, J. -. B., Lounis, B., Choquet, D., Cognet, L. Single trafficking of neurotransmitter receptor: comparison between single-molecule/quantum dot strategies. J. Neurosci. 27, 12433-12437 (2007).
- Smith, A. M., Nie, S. M. Minimizing the hydrodynamic size of quantum dots with multifunctional multidentate polymer ligands. J. Am. Chem. Soc. 130, 11278-11279 (2008).
- Smith, A. M., Nie, S. M. Bright and compact alloyed quantum dots with broadly tunable near-infrared absorption and fluorescence spectra through mercury cation exchange. J. Am. Chem. Soc. 133, 24-26 (2011).
- Shriver, D. F., Drezdzon, M. A. . The Manipulation of Air-Sensitive Compounds. , (1986).
- Errington, R. J. . Advanced Practical Inorganic and Metalorganic Chemistry. , (1997).
- Jasieniak, J., Smith, L., van Embden, J., Mulvaney, P., Califano, M. Re-examination of the size-dependent absorption properties of CdSe quantum dots. J. Phys. Chem. C. 113, 19468-19474 (2009).
- Leatherdale, C. A., Woo, W. K., Mikulec, F. V., Bawendi, M. G. On the absorption cross section of CdSe nanocrystal quantum dots. J. Phys. Chem. B. 106, 7619-7622 (2002).
- Smith, A. M., Mohs, A. M., Nie, S. M. Tuning the optical and electronic properties of colloidal nanocrystals by lattice strain. Nature Nanotech. 4, 56-63 (2009).
- Demas, J. N., Crosby, G. A. The measurement of photoluminescence quantum yields. A review. J. Phys. Chem. 75, 991-1024 (1971).
- Van Embden, J., Jasieniak, J., Mulvaney, P. Mapping the optical properties of CdSe/CdS heterostructure nanocrystals: the effects of core size and shell thickness. J. Am. Chem. Soc. 131, 14299-14309 (2009).
- Smith, A. M., Duan, H. W., Rhyner, M. N., Ruan, G., Nie, S. M. A systematic examination of surface coatings on the optical and chemical properties of semiconductor quantum dots. Phys. Chem. Chem. Phys. 8, 3895-3903 (2006).
- Zhang, X., Mohandessi, S., Miller, L. W., Snee, P. T. Efficient functionalization of aqueous CdSe/ZnS nanocrystals using small-molecule chemical activators. Chem. Comm. 47, 3532-3534 (2011).
- Bucio, L., Souza, V., Albores, A., Sierra, A., Chavez, E., Carabez, A., Guiterrez-Ruiz, M. C. Cadmium and mercury toxicity in a human fetal hepatic cell line (WRL-68 cells). Toxicol. 102, 285-299 (1995).
- Han, S. G., Castranova, V., Vallyathan, V. J. Comparative cytotoxicity of cadmium and mercury in a human bronchial epithelial cell line (BEAS-2B) and its role in oxidative stress and induction of heat shock protein 70. J. Toxicol. Environ. Health Part A. 70, 852-860 (2007).
- Strubelt, O., Kremer, J., Tilse, A., Keogh, J., Pentz, R. J. Comparative studies on the toxicity of mercury, cadmium, and copper toward the isolated perfused rat liver. J. Toxicol. Environ. Health Part A. 47, 267-283 (1996).