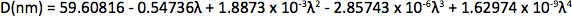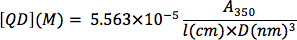1分子蛍光イメージングのためのコンパクトな量子ドット
Summary
我々は、単一分子蛍光イメージングのための最小限に流体力学的サイズを有するコロイド量子ドットの調製を記載している。従来の量子ドットに比べ、これらのナノ粒子はサイズが球状タンパク質と類似しており、単一分子の明るさ、光分解に対する安定性、タンパク質や細胞への非特異的な結合への抵抗のために最適化されています。
Abstract
1分子イメージングは、生体分子機能のメカニズムを理解するための細胞生物学1-4根底にある分子の挙動の空間的および時間的異質性を可視化するための重要なツールです。画像興味のある個々の分子には、それは一般的に蛍光タグ(染料、タンパク質、ビーズ、または量子ドット)にコンジュゲートと落射蛍光または全内部反射蛍光(TIRF)顕微鏡で観察しています。色素や蛍光タンパク質は何十年も蛍光イメージングの主力となっているが、それらの蛍光は、信号が完全に失われる前に、観測の数秒しかもたらして、個々の分子を観察するために必要な高い光子フラックス下では不安定である。ラテックスビーズと色素標識ビーズが改善された信号安定性を提供しますが、有害な研究対象の分子の拡散挙動を変更することができます大幅に大きい流体力学的サイズを犠牲にして。
ntent "は>量子ドット(QD)は、これら二つの問題が政権の間のバランスを提供します。これらのナノ粒子は半導体材料で構成され、光分解5〜並外れた耐性を有する流体力学的にコンパクトなサイズで設計することができるため、近年、量子ドットは有効に尽力されました単一分子レベルでの複雑な高分子の挙動の長期観測。しかし、これらの粒子はまだそのような彼らのサイズがまだ大きすぎる4,6細胞質および神経シナプス間隙などの混雑した環境での分子拡散障害を示すことが見出された、7。コロイド安定性、光安、明るさ、過去8,9にコンパクトQDの効用を妨げてきた非特異的結合に対するオフセットバランスを取りながら、最近我々は、コアおよび流体力学的サイズを最小化するための量子ドットの表面コーティングを設計した。この記事の目的は、実証することである絶縁カドミウム亜鉛Y 1-Y Sシェル、短いポリエチレングリコールで修飾された多座配位高分子でさらに被覆(でコーティングされた合金化水銀X CD 1-X SEのコアで構成され、これらの最適化されたナノ結晶の合成、修正、および特性PEG)鎖( 図1)。従来のCdSeナノ結晶と比較して、水銀X CD 1-X SE合金は強化された細胞内の信号対雑音、非細胞毒性可視波長での励起のために赤と近赤外波長の蛍光、蛍光の大きい量子収率を提供します。多座ポリマーコーティングは、流体力学的サイズを最小にするために閉鎖とフラットなコンフォメーションでナノ結晶表面に結合し、PEGは細胞や生体分子に非特異的な結合を最小限に抑えるために表面電荷を中和する。最終的な結果は、550から800 nmおよび12 nm付近合計流体力学的サイズとの間の発光と明るい蛍光ナノ結晶である。これは、sにありますAMEサイズの細胞には多くの水溶性球状タンパク質などの範囲、および従来のPEG化された量子ドット(25-35 nm)に比べてかなり小さい。
Protocol
Representative Results
Discussion
従来のCdSe量子ドットに比べて、三元合金のHg X CD 1-X SEナノ結晶は、独立して大きさと蛍光波長に同調させることができる。サイズは、第1 CdSeナノ結晶コアの合成時に選択され、蛍光波長は、実質的にナノサイズ9を変えない二水銀カチオン交換工程で選択されます。精製された水銀X CD 1-X Seのナノ結晶がキャッピング前に、少なくとも24時間室温でインキュベートする?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
著者らは、電子顕微鏡イメージングのためのエモリー大学の統合顕微鏡コアで博士香港李に感謝したいと思います。この作品は、NIHの助成金(PN2EY018244、R01 CA108468、U54CA119338、そして1K99CA154006-01)が主催した。
Materials
| Name of the reagent | Company | Catalogue number | Comments (optional) |
| Selenium | Sigma-Aldrich | 229865 | |
| Tri-n-octylphosphine | Strem | 15-6655 | 97% pure, unstable in air |
| Cadmium oxide | Sigma-Aldrich | 202894 | Highly toxic: use caution |
| Tetradecylphosphonic acid | PCI Synthesis | 4671-75-4 | |
| Octadecene | Alfa Aesar | L11004 | Technical grade |
| Hexadecylamine | Sigma-Aldrich | H7408 | |
| Diphenylphosphine | Sigma-Aldrich | 252964 | Pyrophoric |
| Mercury acetate | Sigma-Aldrich | 456012 | Highly toxic: use caution |
| 1-Octanethiol | Sigma-Aldrich | 471836 | Strong odor |
| Oleic acid | Sigma-Aldrich | W281506 | |
| Zinc acetate | Alfa Aesar | 35792 | |
| Cadmium acetate hydrate | Sigma-Aldrich | 229490 | Highly toxic: use caution |
| Oleylamine | Fisher Scientific | AC12954 | Unstable in air |
| Sulfur | Sigma-Aldrich | 344621 | |
| Trioctylphosphine oxide | Strem | 15-6661 | 99% |
| Pyridine | VWR | EM-PX2012-6 | Anhydrous |
| Thioglycerol | Sigma-Aldrich | M1753 | Strong odor |
| Triethylamine | Sigma-Aldrich | 471283 | Anhydrous |
| Dialysis tubing | Spectrum Labs | 131342 | 20 kDa cutoff |
| Centrifugal filter | Millipore | UFC801024 | 10 kDa cutoff |
| Monoamino-PEG | Rapp Polymere | 12 750-2 | 750 Da |
| DMTMM, 4-(4,6-Dimethoxy-1,3,5-triazin-2-yl)-4-methylmorpholinium chloride hydrate | Alfa Aesar | H26333 | |
| AKTAprime Plus Chromatography System | GE HealthCare | ||
| Superose 6 10/300 GL chromatography column | GE HealthCare | 17-5172-01 | |
| Agarose, OmniPur | VWR | EM-2120 | |
Appendix Synthesis of mercury octanethiolate: Slowly add a methanol solution of mercury acetate (1 eq.) to a stirring solution of 1-octanethiol (3 eq.) and potassium hydroxide (3 eq.) in methanol at room temperature. Isolate the mercury(II) octanethiolate precipitate via filtration, wash two times with methanol and once with ether, and then dry under vacuum. Synthesis of multidentate polymer: Dissolve polyacrylic acid (1 g, 1,773 Da) in 25 ml dimethylformamide (DMF) in a 150 ml three-necked flask and bubble with argon for 30 min. Add an anhydrous solution of cysteamine (374 mg, 4.87 mmol) in 10 ml DMF. At room temperature with vigorous stirring, slowly add anhydrous diisopropylcarbodiimide (DIC, 736 mg, 5.83 mmol) over 30 min, followed by triethylamine (170 μl, 1.22 mmol), and allow the reaction to proceed for 72 hr at 60 °C. Add mercaptoethanol (501 mg, 6.41 mmol) to quench the reaction, and stir for 2 hr at room temperature. Remove DMF via rotary evaporation and isolate the polymer with the addition of a 2:1 mixture of ice-cold acetone:chloroform, followed by centrifugation. Dissolve the polymer in ~5 ml anhydrous DMF, filter, precipitate again with diethyl ether, and repeat. Dry the product under vacuum and store under argon. Determination of CdSe core diameter: From the UV-Vis absorption spectrum determine the wavelength of the first exciton peak (λ, in nm), which is the longest-wavelength peak (e.g. roughly 498 nm for CdSe in Figure 2a), and use the sizing curve of Mulvaney and coworkers 12:
Determination of CdSe nanocrystal concentration: From a background-subtracted UV-Vis spectrum of an optically clear solution of CdSe nanocrystals, determine the absorption at 350 nm wavelength. Serial dilutions can be used to determine if the optical absorption is within the linear range of Beer’s Law. The nanocrystal concentration (QD, in M) can be determined by plugging in the nanocrystal diameter (D, in nm), the optical absorption value (A3sa), and the cuvette path length (l, in cm) into the following equation from the empirical correlation of Bawendi and coworkers 13:
|
References
- Toprak, E., Selvin, P. R. New fluorescent tools for watching nanometer-scale conformational changes of single molecules. Annu. Rev. Biophys. Biomol. Struct. 36, 349-369 (2007).
- Joo, C., Balci, H., Ishitsuka, Y., Buranachai, C., Ha, T. J. Advances in single molecule fluorescence methods for molecular biology. Annu. Rev. Biochem. 77, 51-76 (2008).
- Pinaud, F., Clarke, S., Sittner, A., Dahan, M. Probing cellular events, one quantum dot at a time. Nat. Method. 7, 275-285 (2010).
- Smith, A. M., Wen, M. M., Nie, S. M. Imaging dynamic cellular events with quantum dots. Biochemist. 32, 12-17 (2010).
- Smith, A. M., Duan, H. W., Mohs, A. M., Nie, S. M. Bioconjugated quantum dots for in vivo molecular and cellular imaging. Adv. Drug Deliv. Rev. 60, 1226-1240 (2008).
- Smith, A. M., Nie, S. M. Next-generation quantum dots. Nature Biotech. 27, 732-733 (2009).
- Groc, L., Lafourcade, M., Heine, M., Renner, M., Racine, V., Sibarita, J. -. B., Lounis, B., Choquet, D., Cognet, L. Single trafficking of neurotransmitter receptor: comparison between single-molecule/quantum dot strategies. J. Neurosci. 27, 12433-12437 (2007).
- Smith, A. M., Nie, S. M. Minimizing the hydrodynamic size of quantum dots with multifunctional multidentate polymer ligands. J. Am. Chem. Soc. 130, 11278-11279 (2008).
- Smith, A. M., Nie, S. M. Bright and compact alloyed quantum dots with broadly tunable near-infrared absorption and fluorescence spectra through mercury cation exchange. J. Am. Chem. Soc. 133, 24-26 (2011).
- Shriver, D. F., Drezdzon, M. A. . The Manipulation of Air-Sensitive Compounds. , (1986).
- Errington, R. J. . Advanced Practical Inorganic and Metalorganic Chemistry. , (1997).
- Jasieniak, J., Smith, L., van Embden, J., Mulvaney, P., Califano, M. Re-examination of the size-dependent absorption properties of CdSe quantum dots. J. Phys. Chem. C. 113, 19468-19474 (2009).
- Leatherdale, C. A., Woo, W. K., Mikulec, F. V., Bawendi, M. G. On the absorption cross section of CdSe nanocrystal quantum dots. J. Phys. Chem. B. 106, 7619-7622 (2002).
- Smith, A. M., Mohs, A. M., Nie, S. M. Tuning the optical and electronic properties of colloidal nanocrystals by lattice strain. Nature Nanotech. 4, 56-63 (2009).
- Demas, J. N., Crosby, G. A. The measurement of photoluminescence quantum yields. A review. J. Phys. Chem. 75, 991-1024 (1971).
- Van Embden, J., Jasieniak, J., Mulvaney, P. Mapping the optical properties of CdSe/CdS heterostructure nanocrystals: the effects of core size and shell thickness. J. Am. Chem. Soc. 131, 14299-14309 (2009).
- Smith, A. M., Duan, H. W., Rhyner, M. N., Ruan, G., Nie, S. M. A systematic examination of surface coatings on the optical and chemical properties of semiconductor quantum dots. Phys. Chem. Chem. Phys. 8, 3895-3903 (2006).
- Zhang, X., Mohandessi, S., Miller, L. W., Snee, P. T. Efficient functionalization of aqueous CdSe/ZnS nanocrystals using small-molecule chemical activators. Chem. Comm. 47, 3532-3534 (2011).
- Bucio, L., Souza, V., Albores, A., Sierra, A., Chavez, E., Carabez, A., Guiterrez-Ruiz, M. C. Cadmium and mercury toxicity in a human fetal hepatic cell line (WRL-68 cells). Toxicol. 102, 285-299 (1995).
- Han, S. G., Castranova, V., Vallyathan, V. J. Comparative cytotoxicity of cadmium and mercury in a human bronchial epithelial cell line (BEAS-2B) and its role in oxidative stress and induction of heat shock protein 70. J. Toxicol. Environ. Health Part A. 70, 852-860 (2007).
- Strubelt, O., Kremer, J., Tilse, A., Keogh, J., Pentz, R. J. Comparative studies on the toxicity of mercury, cadmium, and copper toward the isolated perfused rat liver. J. Toxicol. Environ. Health Part A. 47, 267-283 (1996).