Mizoroki-Heck-Kreuzkupplungsreaktionen von Dichloro {bis [1,1 ', 1'' - (phosphinetriyl) tripiperidine]} katalysierte Palladium unter milden Reaktionsbedingungen
Summary
Dichloro {bis [1,1 ', 1'' – (phosphinetriyl) tripiperidine]} Palladium [(P (NC 5 H 10) 3) 2 Pd (Cl) 2] (1) ist ein leicht zugänglich, billig und Luft stabil, aber sehr aktiven Katalysator Heck mit einer ausgezeichneten Verträglichkeit mit funktionellen Gruppen, die effizient arbeitet unter milden Reaktionsbedingungen, um die Kupplungsprodukte in sehr hohen Ausbeuten.
Abstract
Dichloro-bis (Aminophosphan)-Komplexe von Palladium der allgemeinen Formel [({P (NC 5 H 10) 3 – N (C &sub6; H 11) n}) 2 Pd (Cl) 2] (wobei n = 0-2 ), gehören zu einer neuen Familie von leicht zugänglich, sehr billig, und Luft stabil, aber sehr aktiven und universell einsetzbar CC Kreuzkupplungskatalysatoren mit einer ausgezeichneten Verträglichkeit mit funktionellen Gruppen. Dichlor {Bis-[1,1 ', 1'' – (phosphinetriyl) tripiperidine]} palladium [(P (NC 5 H 10) 3) 2 Pd (Cl) 2] (1), die mindestens stabilen Komplex in dieser Reihe zu Protonen, z. B. in Form von Wasser, ermöglicht eine entspannte Nanopartikelbildung und damit erwies sich als der aktivste Katalysator Heck in dieser Serie bei 100 ° C und ist ein sehr seltenes Beispiel für eine effektive und vielseitige Katalysatorsystem, das effizient arbeitet unter milden Reaktionsbedingungen. Schnelle und vollständige catalyst Abbau unter Aufarbeitungsbedingungen in Phosphonate, Piperidinium-Salze und andere, palladiumhaltigen Zersetzungsprodukte gewährleisten eine leichte Trennung der Kupplungsprodukte aus Katalysator und Liganden. Die einfache, billige und schnelle Synthese von 1,1 ', 1 "- (phosphinetriyl) tripiperidine bzw. 1, die einfache und bequeme Nutzung sowie seine ausgezeichnete katalytische Leistung in der Heck-Reaktion bei 100 ° C 1 bis zu einer die schönsten und grünsten Heck-Katalysatoren zur Verfügung.
Wir stellen hier die visualisierten Protokolle für den Liganden-und Katalysatorsynthesen sowie die Reaktionsprotokoll für Heck-Reaktionen bei 10 mmol-Maßstab durchgeführt bei 100 ° C und zeigen, dass dieser Katalysator eignet sich für den Einsatz in organischen Synthesen.
Introduction
Palladium-katalysierte CC-Kreuzkupplungsreaktionen, die durch die Vergabe des Nobelpreises für Chemie im Dezember 2010 bestätigt wurden, gehören heute zu einem unverzichtbaren Werkzeug für die zielgerichtete Synthese komplexer organischer Moleküle in allen Forschungsbereichen und Industriesegmente. Die Mizoroki-Heck-Reaktion ermöglicht beispielsweise die Kopplung von Olefinen mit Arylhalogeniden in Gegenwart einer Base und ist heute die am meisten verbreitete Methode zur Herstellung von Vinylbenzole (Abbildung 1). Die Heck-Reaktion wurde gezeigt, dass eine breite Anwendung in beiden finden, Totalsynthese von Naturstoffen in der Wissenschaft und Synthese in der pharmazeutischen und agrochemischen Industrie 10.1.
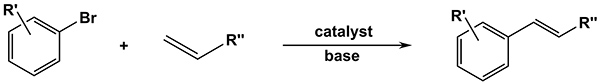
Fig. 1 ist. Allgemeine Heck-Kreuzkupplungsreaktion zwischen einem Arylbromids und einem Olefin. Klicken Sie hier für eine größere Ansicht.
Taxol, ein Mitoseinhibitor in der Krebs-Chemotherapie verwendet, Singulair, ein Asthma-Medikament und das Herbizid Prosulfuron sowie Cyclotene ein Monomer für die elektronischen Hochleistungsharze sind Beispiele, die erfolgreich vorbereitet haben, mit einem Heck-Mizoroki Kreuzkupplungs Schritt in ihrer Synthesen (2) 11-14.
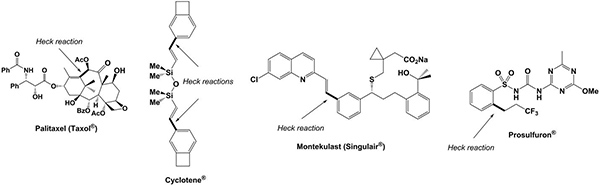
2. Beispiele für industriell relevante organische Verbindungen mit einem Palladium-katalysierte Heck-Kreuzkupplungsreaktion als Schlüsselschritt in der Synthese.ghres.jpg "TARGET =" _blank "> Klicken Sie hier für eine größere Ansicht.
Auch wenn die jüngsten Entwicklungen haben deutlich die Aktivität der Katalysatoren 15-29 Heck erhöht, eine typische Reaktion Protokoll mit Arylbromiden als Substrate hohe Reaktionstemperaturen (140 ° C), Katalysator im Bereich von 1 mol% und Reaktionszeiten von bis bedarf noch bis 24 Stunden. Darüber hinaus sind modifizierte Reaktionsbedingungen, einschließlich der Reaktionstemperatur, der Katalysatormenge, Basen, Lösungsmittel und Additive, z. B. gemeldet werden, was bedeutet, dass diese Protokolle nur selten ihre Anwendung bei organischen Synthesen finden wegen Mangel an Allgemeingültigkeit. Außerdem sind die meisten Katalysatoren erfordern mehrere Reaktionsschritte für die Synthese und daher zeitaufwendig und Nieder ergibt. Zusätzlich sind inerten Atmosphäre-Techniken und teure Ausgangsmaterialien schlechte Stabilität oft für ihre Herstellung verwendet werden. Dies bezieht sich auf die Notwendigkeit von neuen und verbesserten, billig und leicht zugänglich, sTisch und grün, sondern reaktiv und allgemein gültigen Heck-Katalysatoren mit hoher Toleranz gegen funktionelle Gruppen, die effizient und zuverlässig arbeitet bei geringer Katalysatorbeladung mit allgemein gültigen Reaktionsprotokolle.
Dichloro-bis (Aminophosphan)-Komplexe von Palladium wurden vor kurzem als leicht zugänglich, billig und Luft stabil, aber sehr aktiven CC Kreuzkupplungskatalysatoren mit ausgezeichneter Verträglichkeit mit funktionellen Gruppen von 30 bis 34 eingeführt, von denen Dichlor {bis [1,1 ', 1' '- (phosphinetriyl) tripiperidine]} palladium [(P (NC 5 H 10) 3) 2 Pd (Cl) 2] (1) erwies sich als sehr leistungsfähig, zuverlässig und vielseitig Heck-Katalysator, der effizient arbeitet bei 100 ° C . 1 35 wurde quantitativ innerhalb von nur wenigen Minuten mit der Behandlung von THF Suspensionen von [Pd (Cl) 2 (cod)] (cod = Cycloocta-1 ,5-dien) mit 1,1 ', 1'' vorbereitet – (phosphinetriyl ) tripiperidine unter Luftatmosphäre bei 25 °C. 1,1 ', 1'' – (phosphinetriyl) tripiperidine wurde die jeweilige Ligandensystem in einem Schritt durch die tropfenweise Zugabe eines Überschusses Piperidin gekühlt Diethylether Lösungen von PCl 3 erreicht. Die Substratkosten für die Herstellung von 1,1 ', 1'' – (phosphinetriyl) tripiperidine für 1 g Palladium-Vorläufer ist weniger als 1 € (von den Katalogpreisen eines Chemikalienlieferanten geschätzt) und daher sehr günstig.
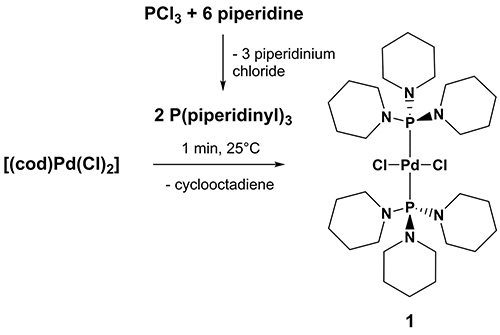
3. Synthese von Dichlor {bis [1,1 ', 1'' – (phosphinetriyl) tripiperidine]} Palladium [(P (NC 5 H 10) 3) 2 Pd (Cl) 2] (1). Klicken Sie hier für eine größere Ansicht .
Darüber hinaus trotz der simple und billige Synthese von 1 und seine ausgezeichnete katalytische Leistung, die Zugabe von wässriger Salzsäure (Aufarbeitungsbedingungen), um eine schnelle und vollständige Zersetzung des Katalysators, unter Bildung von Phosphonat-, Piperidinium-Salz, und unlösliche Palladium enthaltenden Zersetzung führen Produkte, die sich leicht aus den Kupplungsprodukten abgetrennt werden. Dies ist eine oft ignoriert, aber sehr wichtiges Thema, um (von ökologischen und wirtschaftlichen Gesichtspunkten) berücksichtigt werden und ist von besonderer Bedeutung für die Herstellung von pharmazeutisch relevanten Verbindungen.
Protocol
Representative Results
Discussion
Dichloro {bis [1,1 ', 1'' – (phosphinetriyl) tripiperidine]} Palladium (1) ist ein sehr billig und leicht zugänglich, Luft stabil und hochaktive Katalysator Heck mit einer ausgezeichneten Verträglichkeit mit funktionellen Gruppen, die effizient arbeitet unter milden Reaktions Bedingungen, um die Kupplungsprodukte sauber in sehr hohen Ausbeuten. Die ausgezeichnete katalytische Aktivität (und allgemeine Anwendbarkeit) von 1 ist aufgrund der einzigartigen Eigenschaften der Aminophosphine: während die sterischen als auch die σ-Donorstärke Aminophosphane ist im wesentlichen die gleiche im Vergleich zu ihren Phosphin-basierten Analoga vergleichbarem n – Aktivität wurden für die Komplexe des Typs [(P {(NC 5 H 10) 3 gefunden (C 6 H 11) n}) 2 Pd (Cl) 2] (n = 0-3; Abbildung 3) in Kreuzkupplungsreaktionen, bei denen molekulare Mechanismen wirksam sind. Auf der anderen Seite, die labileCharakter der PN-Bindungen in Aminophosphine (Empfindlichkeit gegenüber Protonen, in Form von Wasser zB) bietet die Möglichkeit, die Bildung von Palladium-Nanopartikeln wirksam zu kontrollieren: Immer mehr PN-Bindungen in den Liganden nacheinander erleichtert deren wasserinduzierten Abbau und damit die Bildung von Nanopartikeln von den entsprechenden Komplexen. Dementsprechend kann, da Palladium-Nanopartikel sind die katalytisch aktive Form 1 in der Heck-Reaktion 35, wie durch sigmoiden Kinetik förmigen 36, 37 oder die effiziente Hemmung der Katalyse nach der Zugabe von einem großen Überschuss an metallischem Quecksilber zu Reaktionsgemischen von Arylbromid angegeben, Olefin und Katalysator, beispielsweise 38, als auch deren Nachweis durch Analyse der Reaktionsgemische von Ausführungs Heck-Kreuzkupplungsreaktionen mit einem Transmissionselektronenmikroskop (TEM) mit einer energiedispersiven Röntgenanalyse (EDX)-Analysator 35, Substitution von 1 ausgestattet , 1 ', 1'' – (phosphinetriyl) tripiperidine von 1,1 '- (cyclohexylphosphinediyl) dipiperidin), 1 – (dicyclohexylphosphinyl) piperidin) oder tricyclohexylphosphin, die nacheinander die komplexe Stabilität und damit erhöht, verzögert die (Wasser-induziert) Bildung von Nanopartikeln davon. Als Folge, während Dichloro-bis (1 – (dicyclohexylphosphinyl) piperidin) palladium ist der Katalysator der Wahl in der Heck-Reaktion bei 140 ° C durchgeführt wird, wurde die höchste katalytische Aktivität für Dichlor {Bis-[1,1 ', 1 erhaltene '' – (phosphinetriyl) tripiperidine]} palladium [(P (NC 5 H 10) 3) 2 Pd (Cl) 2] (1) bei 100 ° C, der mindestens stabile Komplex in dieser Reihe.
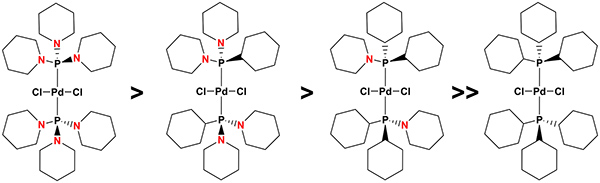
Abbildung 5. Die Wirkung von Liganden Zusammensetzung Dichlor {Bis (Aminophosphan)} palladium mit der allgemeinen Formel [({P (NC 5 H 10) 3 – n (C 6 H 11) n}) 2 Pd (Cl) 2] (n = 0-2) auf die Komplexstabilität und somit auf die Leichtigkeit der (Wasser-induzierte) Nanopartikelbildung und damit ihre katalytische Aktivität unter milden Reaktionsbedingungen in der Heck-Kreuzkupplungsreaktion. Klicken Sie hier für eine größere Ansicht.
Auch wenn die oben beschriebenen Synthesen sowie die Heck-Reaktion Protokolle sind geradlinig, sind einige der häufigsten Fehlerbehebungsverfahren: (a) sicherstellen, dass die Tetrabutylammoniumbromid neu gekauft oder richtig gelagert (Tetrabutylammoniumbromid ist hygroskopisch), (b) stellen Sie sicher, dass trockene Lösungsmittel sind für die Ligandensynthese, wenn kleine Mengen des Liganden wurden hergestellt, verwendet wird, stellen (c) ist sicher, dass einentweder frisch zubereitet oder unter einer inerten Atmosphäre gelagert, (d) sicherstellen, dass der NMP oder DMF werden neu gekauft, (e) stellen Sie sicher, dass die Chemikalien sind entweder neu gekauft oder richtig gelagert wird, (f) otro alle Glaswaren und kühl unter Vakuum.
Disclosures
The authors have nothing to disclose.
Acknowledgements
Finanzielle Unterstützung von der Zürcher Hochschule für Angewandte Wissenschaften sowie des Schweizerischen Nationalfonds (SNF) gestattet.
Materials
| Phosphorous trichloride | Sigma-Aldrich | 157791 | ReagentPlus, 99% |
| Piperidine | Sigma-Aldrich | 104094 | ReagentPlus, 99% |
| Dichloro(1,5-cyclooctadiene)palladium(II) | Sigma-Aldrich | 275891 | 99% |
| Styrene | Sigma-Aldrich | S4972 | ReagentPlus, contains 4-tert-butylcatechol as stabilizer, ≥99% |
| 1-Bromo-4-phenoxybenzene | Sigma-Aldrich | B65209 | 99% |
| Tetrabutylammonium bromide | Acros Organics | 185680025 | 99+% |
| Potassium carbonate | Sigma-Aldrich | 347825 | Reagent grade, ≥98%, powder, -325 mesh |
| Silica gel | Merck | 107734 | Silica gel 60 (0.063-0.2mm), for column chromatoraphy |
| Diethyl ether | Sigma-Aldrich | 673811 | Anhydrous, ACS reagent, ≥99.0%, contains BHT as inhibitor |
| Tetrahydrofuran (THF) | Sigma-Aldrich | 186562 | anhydrous, contains 250 ppm BHT as inhibitor, ≥99.9% |
| Pentane | Sigma-Aldrich | 158941 | reagent grade, 98% |
| N-methyl-2-pyrrolidone (NMP) | Sigma-Aldrich | M79603 | ReagentPlus, 99% |
References
- Heck, R. F., Katritzky, A. R., Meth-Cohn, O., Rees, C. W. . Palladium Reagents in Organic Syntheses. Volume 2. , (1985).
- Heck, R. F., Trost, B. M., Fleming, I. Chapter 4.3, Vinyl Substitution with Organopalladium Intermediates. Comprehensive Organic Synthesis. 4, 833 (1991).
- Malleron, J. -. L., Fiaud, J. -. C., Legros, J. -. Y. . Handbook of Palladium-Catalysed Organic Reactions. , (1997).
- Reetz, M. T., Davies, S. G., Murahashi, S. I. . Transition Metal Catalysed Reactions. , (1999).
- Link, J. T., Overman, L. E., Diederich, F., Stang, P. J. Chapter 6. Metal-Catalyzed Cross-Coupling Reactions. , (1998).
- Bräse, S., de Meijere, A., Diederich, F., Stang, P. J. Chapter 3.6. Metal-Catalyzed Cross-Coupling Reactions. , (1998).
- Nicolaou, K. C., Sorensen, E. J. Chapter 31. Classics in Total Synthesis. , (1996).
- de Vries, R. A., Vosejpka, P. C., Ash, M. L., Herkes, F. E., Dekker, M. Chapter 37. Catalysis of Organic Reactions. , (1998).
- Tietze, L. F., Kettschau, G., Heuschert, U., Nordmann, G. Highly Efficient Synthesis of Linear Pyrrole Oligomers by Twofold Heck Reactions. Chem. Eur. J. 7, 368-373 (2001).
- Brase, S., Negishi, E., et al. Chapters IV.1, IV2.1, IV.2.2, and IV.2.3. Handbook of Organopalladium Chemistry for Organic Synthesis. , 1123-1315 (2002).
- Danishefsky, S. J., et al. Total Synthesis of Baccatin III and Taxol. J. Am. Chem. Soc. 118, 2843-2859 (1996).
- Higgs, G. . Chem Ind. 827, (1997).
- Baumeister, P., Blaser, H. U., Baiker, A., Prins, R., et al. . Heterogeneous catalysis and fine chemicals. , (1997).
- Schrock, A. K. Polyorganosiloxane-bridged bisbenzocyclobutene monomers. US patent. , (1989).
- Amatore, C., Carre, E., Jutand, A. Evidence for the Ligation of Palladium(0) Complexes by Acetate Ions: Consequences on the Mechanism of Their Oxidative Addition with Phenyl Iodide and PhPd(OAc)(PPh3)2 as Intermediate in the Heck Reaction. Organometallics. 14, 5605-5614 (1995).
- Fauvarque, J. F., Pflüger, F., Troupel, M. Kinetics of oxidative addition of zerovalent palladium to aromatic iodides. J. Organomet. Chem. 208, 419-427 (1981).
- de Vries, G. J. A unifying mechanism for all high-temperature Heck reactions. The role of palladium colloids and anionic species. Dalton Trans. , 421-429 (2006).
- Ohff, M., Ohff, A., van der Boom, A. M. E., Milstein, D. Highly Active Pd(II) PCP-Type Catalysts for the Heck Reaction. J. Am. Chem. Soc. 119, 11687-11688 (1997).
- Morales-Morales, D., Redon, R., Yung, C., Jensen, C. M. High yield olefination of a wide scope of aryl chlorides catalyzed by the phosphinito palladium PCP pincer complex: PdCl{C6H3(OPPri2)2-2,6}]. . Chem. Commun. , 1619-1620 (2000).
- Peris, E., Loch, J. A., Mata, J., Crabtree, R. H. A Pd complex of a tridentate pincer CNC bis-carbene ligand as a robust homogenous Heck catalyst. Chem. Commun. , 201-202 (2001).
- Herrmann, W. A., Böhm, V. P. W., Gstöttmayr, C. W. K., Grosche, M., Reisinger, C. -. P., Weskamp, T. Synthesis, structure and catalytic application of palladium(II) complexes bearing N-heterocyclic carbenes and phosphines. J. Organomet. Chem. , 617-628 (2001).
- Benito-Garagorri, D., Bocokic, V., Mereiter, K., Kirchner, K. A Modular Approach to Achiral and Chiral Nickel(II), Palladium(II), and Platinum(II) PCP Pincer Complexes Based on Diaminobenzenes. Organometallics. 25, 3817-3823 (2006).
- Miyazaki, F., Yamaguchi, K., Shibasaki, M. The synthesis of a new palladacycle catalyst. Development of a high performance catalyst for Heck reactions. Tetrahedron Lett. 40, 7379-7383 (1999).
- Eberhard, M. R. Insights into the Heck Reaction with PCP Pincer Palladium(II) Complexes. Org. Lett. , 2125-2128 (2004).
- Bolliger, J. L., Blacque, O., Frech, C. M. Short, facile, and high-yielding synthesis of extremely efficient pincer-type Suzuki catalysts bearing aminophosphine substituents. Angew. Chem. Int. Ed. 46, 6514-6517 (2007).
- Bolliger, J. L., Frech, C. M. Rationally designed pincer-type Heck catalysts bearing aminophosphine substituents: PdIV intermediates and palladium nanoparticles. Chem. Eur. J. 14, 7969-7977 (2008).
- . For a computational study about the thermal accessibility of PdII/PdIV cycles in the Heck reaction, catalyzed by pincer-type catalysts, see Blacque, O., Frech, C. M. Pincer-type Heck Catalysts and Mechanisms Based on PdIV Intermediates – A Computational Study. Chem. Eur. J. 16, 1521-1531 (2010).
- Vicente, J., Arcas, A., Julia-Hernandez, F., Bautista, D. For the synthesis and separation of the first pincer-type PdIV complex, see. Chem. Commun. 46, 7253-7255 (2010).
- Bolliger, J. L., Frech, C. M. Dichloro-Bis(aminophosphine) Complexes of Palladium – Highly Convenient, Reliable and Extremely Active Suzuki Catalysts with outstanding functional group tolerance. Chem. Eur. J. 16, 4075-4081 (2010).
- Bolliger, J. L., Frech, C. M. Dichloro{bis[1-(dicyclohexylphosphanyl)piperidine]}palladium – A Highly Effective and Extremely Versatile Palladium-based Negishi Catalyst, that Efficiently and Reliably Operates at Low Catalyst Loadings. Chem. Eur. J. 16, 11072-11081 (2010).
- Gerber, R., Oberholzer, M., Frech, C. M. Cyanation of aryl bromides with K4[Fe(CN)6] catalyzed by dichloro{bis[1-(dicyclohexyl-phosphanyl)-piperidine]}palladium – a molecular source of nanoparticles. Reactions involved in catalyst deactivation processes. Chem. Eur. J. 18, 2978-2986 (2012).
- Bolliger, J. L., Oberholzer, M., Frech, C. M. Access to 2-aminopyridines – compounds of great biological and chemical significance. Adv. Synth. Catal. 353, 945-954 (2011).
- Oberholzer, M., Gerber, R., Frech, C. M. Mizoroki-Heck reactions catalyzed by dichloro{bis[1-(dicyclohexylphosphanyl)piperidine]}palladium. Palladium nanoparticle formation promoted by (water induced) ligand degradation. Adv. Synth. Catal. 354, 627-641 (2012).
- Oberholzer, M., Frech, C. M. Mizoroki-Heck Reactions Catalyzed by Palladium Dichloro-bis(aminophosphine) Complexes Under Mild Reaction Conditions. The Importance of Ligand Composition on the Catalytic Activity. Green Chem. 15, 1678-1686 (2013).
- Watzky, M. A., Finke, R. G. Transition Metal Nanocluster Formation Kinetic and Mechanistic Studies. A New Mechanism When Hydrogen Is the Reductant: Slow, Continuous Nucleation and Fast Autocatalytic Surface Growth. J. Am. Chem. Soc. 119, 10382-10400 (1997).
- Widegren, J. A., Bennett, M. A., Finke, R. G. Is It Homogeneous or Heterogeneous Catalysis? Identification of Bulk Ruthenium Metal as the True Catalyst in Benzene Hydrogenations Starting with the Monometallic Precursor, Ru(II)(η6-C6Me6)(OAc)2, Plus Kinetic Characterization of the Heterogeneous Nucleation, Then Autocatalytic Surface-Growth Mechanism of Metal Film Formation. 125, 10301-10310 (2003).
- Widegren, J. A., Finke, R. G. A review of the problem of distinguishing true homogeneous catalysis from soluble or other metal-particle heterogeneous catalysis under reducing conditions. J. Mol. Catal. A. 198, 317-341 (2003).

