Mizoroki-Heck Reações de acoplamento cruzado catalisado por Dicloro {bis [1,1 ', 1'' - (phosphinetriyl) tripiperidine]} paládio sob condições de reação leves
Summary
Dicloro-bis {[1,1 ', 1'' – (phosphinetriyl) tripiperidine]} paládio [(P (NC 5 H 10) 3) 2 Pd (Cl) 2] (1) é um ar acessível, barata, e fácil estável, mas altamente activa de catalisador de Heck com uma excelente tolerância grupo funcional que opera de forma eficiente, sob condições de reacção suaves para dar os produtos de acoplamento com rendimentos muito elevados.
Abstract
Dicloro-bis (aminophosphine) complexos de paládio com a fórmula geral [(P {(NC 5 H 10) 3 – N (C 6 H 11) n}) 2 Pd (CI) 2] (em que n = 0-2 ), pertence a uma família nova de fácil acesso, muito barato, e ar estável, mas CC altamente ativa e universalmente aplicável catalisadores de acoplamento cruzado com uma excelente tolerância do grupo funcional. Dicloro-bis {[1,1 ', 1'' – (phosphinetriyl) tripiperidine]} paládio [(P (NC 5 H 10) 3) 2 Pd (Cl) 2] (1), o complexo menos estável dentro desta série no sentido protões, por exemplo, sob a forma de água, permite uma formação de nanopartículas e, consequentemente, facilitada, provou ser o catalisador Heck mais activa dentro desta série a 100 ° C, e é um exemplo muito raro de um sistema catalisador eficaz e versátil, que opera de forma eficiente sob leve condições de reacção. C rápida e completadegradação atalyst sob condições de trabalho se em fosfatos, sais piperidinio e outros, produtos de decomposição contendo paládio assegurar uma fácil separação dos produtos de acoplamento de catalisador e ligantes. A síntese fácil, barato, rápido e de 1,1 ', 1 "- (phosphinetriyl) tripiperidine e 1, respectivamente, a utilização simples e conveniente, bem como a sua excelente performance catalítica na reacção de Heck, a 100 ° C tornar um para um de os mais atraentes e mais verdes catalisadores disponíveis Heck.
Apresentamos aqui os protocolos visualizadas para o ligando e catalisador de síntese, bem como o protocolo para a reacção de Heck de reacções realizadas em escala de 10 mmol a 100 ° C, e mostram que este catalisador é apropriado para a sua utilização em sínteses orgânicas.
Introduction
Reações de acoplamento cruzado catalisado por paládio CC, que foram reconhecidos pela atribuição do Prémio Nobel da Química em dezembro de 2010, hoje em dia pertencem a uma ferramenta indispensável para a síntese orientada alvo de moléculas orgânicas complexas em todos os campos de pesquisa e segmentos industriais. A reacção de Mizoroki-Heck, por exemplo, permite que o acoplamento de halogenetos de arilo com olefinas na presença de uma base e é hoje em dia o método mais popular para a preparação de vinylbenzenes (Figura 1). A reacção de Heck foi demonstrada para encontrar utilidade tanto em largura, as sínteses totais de produtos naturais na academia e síntese na indústria agroquímica e farmacêutica 1-10.
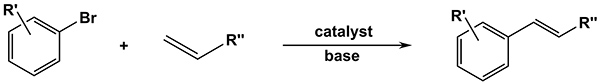
Figura 1. Heck Geral reação de acoplamento cruzado entre um brometo de aril e uma olefina. Clique aqui para ver imagem ampliada.
Taxol, um inibidor mitótico usado na quimioterapia do cancro, Singulair, uma droga da asma e da prosulfurão herbicida, bem como Cyclotene, um monómero de resinas de alto desempenho electrónicos são exemplos que foram preparados com sucesso, incluindo um passo de acoplamento cruzado de Heck-Mizoroki nas suas sínteses (Figura 2) 11-14.
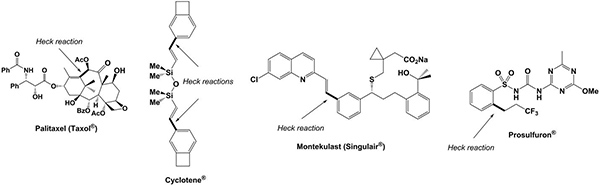
Figura 2. Exemplos de compostos orgânicos industrialmente relevantes envolvendo uma reacção de Heck de acoplamento cruzado catalisado por paládio, como passo essencial na sua síntese.ghres.jpg "TARGET =" _blank "> Clique aqui para ver imagem ampliada.
Apesar de desenvolvimentos recentes aumentaram consideravelmente a actividade dos catalisadores de Heck 15-29, um protocolo típico de reacção com brometos de arilo como substratos ainda requer temperaturas elevadas de reacção (140 ° C), cargas de catalisador no intervalo de 1% em moles e os tempos de reacção de até a 24 h. Além disso, as condições de reacção modificadas, incluindo a temperatura de reacção, as cargas de catalisadores, bases, solventes e aditivos, por exemplo, muitas vezes são relatados, o que implica que estes protocolos raramente vai encontrar a sua aplicação em sínteses orgânicas, devido à falta de generalidade. Além disso, a maioria dos catalisadores requerem vários passos de reacção para a sua síntese e, por conseguinte, são de baixo rendimento e de consumo de tempo. Além disso, as técnicas de inerte-atmosfera e matérias-primas caras de baixa estabilidade são muitas vezes utilizados para a sua preparação. Isto refere-se à necessidade de novo e melhorado, barato e de fácil acesso, smesa e catalisadores Heck aplicáveis verdes, mas reativos e gerais com tolerância grupo funcional de alta eficiência e confiabilidade que opera em cargas baixas de catalisadores com protocolos de reação aplicáveis gerais.
Dicloro-bis (aminophosphine) complexos de paládio foram recentemente introduzidas como fáceis catalisadores CC de acoplamento cruzado acessíveis, baratos e de ar estável, mas altamente ativos com excelente tolerância grupo funcional 30-34, dos quais dicloro {bis [1,1 ', 1' '- (phosphinetriyl) tripiperidine]} paládio [(P (NC 5 H 10) 3) 2 Pd (Cl) 2] (1) provou ser um catalisador de Heck altamente eficiente, seguro e versátil, que opera de forma eficiente a 100 ° C . 35 1 foi quantitativamente preparado em apenas alguns minutos de tratamento de suspensões THF de [Pd (Cl) 2 (COD)] (cod = cicloocta-1 ,5-dieno) com 1,1 ', 1'' – (phosphinetriyl ) tripiperidine sob atmosfera de ar a 25 °C. 1,1 ', 1'' – (phosphinetriyl) tripiperidine, o respectivo sistema de ligando foi realizada em um passo através da adição gota a gota de um excesso de piperidina para arrefecida soluções de éter dietílico de PCl 3. Os custos para a preparação de substrato de 1,1 ', 1'' – (phosphinetriyl) tripiperidine para 1 g de paládio precursor é inferior a 1 € (estimadas a partir de tabelas de preços de um fornecedor de produtos químicos) e, portanto, muito mais barato.
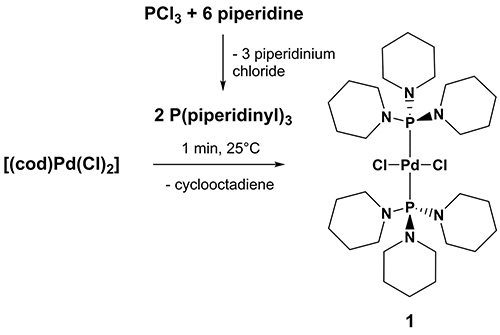
Figura 3. Síntese de dicloro {bis [1,1 ', 1'' – (phosphinetriyl) tripiperidine]} paládio [(P (NC 5 H 10) 3) 2 Pd (Cl) 2] (1). Clique aqui para ver a imagem ampliada .
Além disso, apesar de o Simple e barato de síntese 1 e o seu excelente desempenho catalítico, a adição de ácido clorídrico aquoso (condições de tratamento acima), conduzir a uma degradação do catalisador rápida e completa, acompanhada pela formação de fosfonato, o sal de piperidínio, e insolúvel decomposição contendo paládio produtos que possam ser facilmente separados dos produtos de acoplamento. Esta é uma questão muitas vezes ignorado, mas muito importante a ser considerado (a partir de pontos ecológicos e econômicos do ponto de vista) e é de particular importância para a preparação de compostos farmacologicamente relevantes.
Protocol
Representative Results
Discussion
Dicloro {bis [1,1 ', 1'' – (phosphinetriyl) tripiperidine]} paládio (1) é um acessível, ar estável e altamente ativa catalisador Heck muito barato e fácil com uma excelente tolerância grupo funcional que opera eficientemente em reação suave condições para dar os produtos de acoplamento de forma limpa com rendimentos muito elevados. A excelente actividade catalítica (e aplicabilidade geral) de 1 é devido às propriedades únicas da aminophosphines: enquanto o volume espacial, bem como a força σ-doador de aminophosphines é essencialmente o mesmo, quando comparados com os seus análogos à base de fosfina, níveis comparáveis de atividade foram encontrados para complexos do tipo [(P {(NC 5 H 10) 3 – n (C 6 H 11) n}) 2 Pd (Cl) 2] (em que n = 0-3 e a figura 3), em reacções de acoplamento cruzado em que os mecanismos moleculares são operativas. Por outro lado, a lábilcaráter de títulos PN em aminophosphines (sensibilidade para prótons, na forma de água, por exemplo), oferece a possibilidade de controlar de forma eficaz a formação de nanopartículas de paládio: aumento do número de títulos PN nos ligantes facilita sucessivamente a sua degradação provocada pela água e, consequentemente, a formação de nanopartículas dos respectivos complexos. Por conseguinte, uma vez que as nanopartículas de paládio são a forma cataliticamente activa de 1 em 35 a reacção de Heck, conforme indicado pela cinética em forma sigmoidal, 36, 37 ou a inibição eficaz de catálise após a adição de um grande excesso de mercúrio metálico para misturas de reacção de brometo de arilo, olefina e catalisador, por exemplo 38, bem como a sua detecção por análise de misturas de reacção de Heck exemplar reacções de acoplamento cruzado de um microscópio electrónico de transmissão (TEM), equipado com um raio-X de energia dispersiva (EDX) analysator 35, a substituição de um , 1 ', 1'' – (phosphinetriil) tripiperidine por 1,1 '- (cyclohexylphosphinediyl) dipiperidina), 1 – (dicyclohexylphosphinyl) piperidina) ou triciclohexilfosfina, o que aumenta sucessivamente, complexo de estabilidade e, portanto, retarda a formação (induzida por água) de nanopartículas destes. Como consequência, enquanto dicloro-bis (1 – (dicyclohexylphosphinyl) piperidina) paládio, é o catalisador de escolha na reacção de Heck realizada a 140 ° C, a maior actividade catalítica foi obtido por dicloro bis {[1,1 ', 1 '' – (phosphinetriyl) tripiperidine]} paládio [(P (NC 5 H 10) 3) 2 Pd (Cl) 2] (1), a 100 ° C, o complexo menos estável dentro desta série.
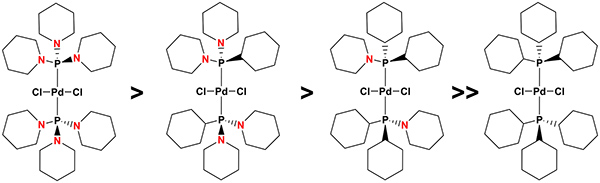
Figura 5. O efeito da composição do ligante de dicloro-bis {(aminophosphine)} palladium com a fórmula geral [(P {(NC 5 H 10) 3 – n (C 6 H 11) n}) 2 Pd (Cl) 2] (em que n = 0-2) na estabilidade do complexo e, por conseguinte, sobre a facilidade de (induzida por água) a formação de nanopartículas e, consequentemente, o seu desempenho catalítico sob leve condições de reação no Heck reação de acoplamento cruzado. Clique aqui para ver imagem ampliada.
Embora as sínteses acima descritas, bem como os protocolos de reacção de Heck são para a frente, alguns dos processos de resolução de problemas comuns são: (a) fazer-se que o brometo de tetrabutilamónio foi recentemente adquirida ou devidamente armazenados (brometo de tetrabutilamónio é higroscópico), (b) certificar-se de que os solventes secos são utilizados para a síntese de ligando quando foram preparadas pequenas quantidades de ligante, (c) fazer-se de que um estáou recém-preparados ou armazenados sob atmosfera inerte, (d) assegurar que o NMP ou DMF são recém-comprado, (e) certificar-se de que os produtos químicos são ou recém-adquirido ou devidamente armazenados, (f) forno-seque todos os vidros e legal sob vácuo.
Disclosures
The authors have nothing to disclose.
Acknowledgements
O apoio financeiro da Universidade de Ciências Aplicadas de Zurique, bem como a National Science Foundation suíço (SNSF) é reconhecido.
Materials
| Phosphorous trichloride | Sigma-Aldrich | 157791 | ReagentPlus, 99% |
| Piperidine | Sigma-Aldrich | 104094 | ReagentPlus, 99% |
| Dichloro(1,5-cyclooctadiene)palladium(II) | Sigma-Aldrich | 275891 | 99% |
| Styrene | Sigma-Aldrich | S4972 | ReagentPlus, contains 4-tert-butylcatechol as stabilizer, ≥99% |
| 1-Bromo-4-phenoxybenzene | Sigma-Aldrich | B65209 | 99% |
| Tetrabutylammonium bromide | Acros Organics | 185680025 | 99+% |
| Potassium carbonate | Sigma-Aldrich | 347825 | Reagent grade, ≥98%, powder, -325 mesh |
| Silica gel | Merck | 107734 | Silica gel 60 (0.063-0.2mm), for column chromatoraphy |
| Diethyl ether | Sigma-Aldrich | 673811 | Anhydrous, ACS reagent, ≥99.0%, contains BHT as inhibitor |
| Tetrahydrofuran (THF) | Sigma-Aldrich | 186562 | anhydrous, contains 250 ppm BHT as inhibitor, ≥99.9% |
| Pentane | Sigma-Aldrich | 158941 | reagent grade, 98% |
| N-methyl-2-pyrrolidone (NMP) | Sigma-Aldrich | M79603 | ReagentPlus, 99% |
References
- Heck, R. F., Katritzky, A. R., Meth-Cohn, O., Rees, C. W. . Palladium Reagents in Organic Syntheses. Volume 2. , (1985).
- Heck, R. F., Trost, B. M., Fleming, I. Chapter 4.3, Vinyl Substitution with Organopalladium Intermediates. Comprehensive Organic Synthesis. 4, 833 (1991).
- Malleron, J. -. L., Fiaud, J. -. C., Legros, J. -. Y. . Handbook of Palladium-Catalysed Organic Reactions. , (1997).
- Reetz, M. T., Davies, S. G., Murahashi, S. I. . Transition Metal Catalysed Reactions. , (1999).
- Link, J. T., Overman, L. E., Diederich, F., Stang, P. J. Chapter 6. Metal-Catalyzed Cross-Coupling Reactions. , (1998).
- Bräse, S., de Meijere, A., Diederich, F., Stang, P. J. Chapter 3.6. Metal-Catalyzed Cross-Coupling Reactions. , (1998).
- Nicolaou, K. C., Sorensen, E. J. Chapter 31. Classics in Total Synthesis. , (1996).
- de Vries, R. A., Vosejpka, P. C., Ash, M. L., Herkes, F. E., Dekker, M. Chapter 37. Catalysis of Organic Reactions. , (1998).
- Tietze, L. F., Kettschau, G., Heuschert, U., Nordmann, G. Highly Efficient Synthesis of Linear Pyrrole Oligomers by Twofold Heck Reactions. Chem. Eur. J. 7, 368-373 (2001).
- Brase, S., Negishi, E., et al. Chapters IV.1, IV2.1, IV.2.2, and IV.2.3. Handbook of Organopalladium Chemistry for Organic Synthesis. , 1123-1315 (2002).
- Danishefsky, S. J., et al. Total Synthesis of Baccatin III and Taxol. J. Am. Chem. Soc. 118, 2843-2859 (1996).
- Higgs, G. . Chem Ind. 827, (1997).
- Baumeister, P., Blaser, H. U., Baiker, A., Prins, R., et al. . Heterogeneous catalysis and fine chemicals. , (1997).
- Schrock, A. K. Polyorganosiloxane-bridged bisbenzocyclobutene monomers. US patent. , (1989).
- Amatore, C., Carre, E., Jutand, A. Evidence for the Ligation of Palladium(0) Complexes by Acetate Ions: Consequences on the Mechanism of Their Oxidative Addition with Phenyl Iodide and PhPd(OAc)(PPh3)2 as Intermediate in the Heck Reaction. Organometallics. 14, 5605-5614 (1995).
- Fauvarque, J. F., Pflüger, F., Troupel, M. Kinetics of oxidative addition of zerovalent palladium to aromatic iodides. J. Organomet. Chem. 208, 419-427 (1981).
- de Vries, G. J. A unifying mechanism for all high-temperature Heck reactions. The role of palladium colloids and anionic species. Dalton Trans. , 421-429 (2006).
- Ohff, M., Ohff, A., van der Boom, A. M. E., Milstein, D. Highly Active Pd(II) PCP-Type Catalysts for the Heck Reaction. J. Am. Chem. Soc. 119, 11687-11688 (1997).
- Morales-Morales, D., Redon, R., Yung, C., Jensen, C. M. High yield olefination of a wide scope of aryl chlorides catalyzed by the phosphinito palladium PCP pincer complex: PdCl{C6H3(OPPri2)2-2,6}]. . Chem. Commun. , 1619-1620 (2000).
- Peris, E., Loch, J. A., Mata, J., Crabtree, R. H. A Pd complex of a tridentate pincer CNC bis-carbene ligand as a robust homogenous Heck catalyst. Chem. Commun. , 201-202 (2001).
- Herrmann, W. A., Böhm, V. P. W., Gstöttmayr, C. W. K., Grosche, M., Reisinger, C. -. P., Weskamp, T. Synthesis, structure and catalytic application of palladium(II) complexes bearing N-heterocyclic carbenes and phosphines. J. Organomet. Chem. , 617-628 (2001).
- Benito-Garagorri, D., Bocokic, V., Mereiter, K., Kirchner, K. A Modular Approach to Achiral and Chiral Nickel(II), Palladium(II), and Platinum(II) PCP Pincer Complexes Based on Diaminobenzenes. Organometallics. 25, 3817-3823 (2006).
- Miyazaki, F., Yamaguchi, K., Shibasaki, M. The synthesis of a new palladacycle catalyst. Development of a high performance catalyst for Heck reactions. Tetrahedron Lett. 40, 7379-7383 (1999).
- Eberhard, M. R. Insights into the Heck Reaction with PCP Pincer Palladium(II) Complexes. Org. Lett. , 2125-2128 (2004).
- Bolliger, J. L., Blacque, O., Frech, C. M. Short, facile, and high-yielding synthesis of extremely efficient pincer-type Suzuki catalysts bearing aminophosphine substituents. Angew. Chem. Int. Ed. 46, 6514-6517 (2007).
- Bolliger, J. L., Frech, C. M. Rationally designed pincer-type Heck catalysts bearing aminophosphine substituents: PdIV intermediates and palladium nanoparticles. Chem. Eur. J. 14, 7969-7977 (2008).
- . For a computational study about the thermal accessibility of PdII/PdIV cycles in the Heck reaction, catalyzed by pincer-type catalysts, see Blacque, O., Frech, C. M. Pincer-type Heck Catalysts and Mechanisms Based on PdIV Intermediates – A Computational Study. Chem. Eur. J. 16, 1521-1531 (2010).
- Vicente, J., Arcas, A., Julia-Hernandez, F., Bautista, D. For the synthesis and separation of the first pincer-type PdIV complex, see. Chem. Commun. 46, 7253-7255 (2010).
- Bolliger, J. L., Frech, C. M. Dichloro-Bis(aminophosphine) Complexes of Palladium – Highly Convenient, Reliable and Extremely Active Suzuki Catalysts with outstanding functional group tolerance. Chem. Eur. J. 16, 4075-4081 (2010).
- Bolliger, J. L., Frech, C. M. Dichloro{bis[1-(dicyclohexylphosphanyl)piperidine]}palladium – A Highly Effective and Extremely Versatile Palladium-based Negishi Catalyst, that Efficiently and Reliably Operates at Low Catalyst Loadings. Chem. Eur. J. 16, 11072-11081 (2010).
- Gerber, R., Oberholzer, M., Frech, C. M. Cyanation of aryl bromides with K4[Fe(CN)6] catalyzed by dichloro{bis[1-(dicyclohexyl-phosphanyl)-piperidine]}palladium – a molecular source of nanoparticles. Reactions involved in catalyst deactivation processes. Chem. Eur. J. 18, 2978-2986 (2012).
- Bolliger, J. L., Oberholzer, M., Frech, C. M. Access to 2-aminopyridines – compounds of great biological and chemical significance. Adv. Synth. Catal. 353, 945-954 (2011).
- Oberholzer, M., Gerber, R., Frech, C. M. Mizoroki-Heck reactions catalyzed by dichloro{bis[1-(dicyclohexylphosphanyl)piperidine]}palladium. Palladium nanoparticle formation promoted by (water induced) ligand degradation. Adv. Synth. Catal. 354, 627-641 (2012).
- Oberholzer, M., Frech, C. M. Mizoroki-Heck Reactions Catalyzed by Palladium Dichloro-bis(aminophosphine) Complexes Under Mild Reaction Conditions. The Importance of Ligand Composition on the Catalytic Activity. Green Chem. 15, 1678-1686 (2013).
- Watzky, M. A., Finke, R. G. Transition Metal Nanocluster Formation Kinetic and Mechanistic Studies. A New Mechanism When Hydrogen Is the Reductant: Slow, Continuous Nucleation and Fast Autocatalytic Surface Growth. J. Am. Chem. Soc. 119, 10382-10400 (1997).
- Widegren, J. A., Bennett, M. A., Finke, R. G. Is It Homogeneous or Heterogeneous Catalysis? Identification of Bulk Ruthenium Metal as the True Catalyst in Benzene Hydrogenations Starting with the Monometallic Precursor, Ru(II)(η6-C6Me6)(OAc)2, Plus Kinetic Characterization of the Heterogeneous Nucleation, Then Autocatalytic Surface-Growth Mechanism of Metal Film Formation. 125, 10301-10310 (2003).
- Widegren, J. A., Finke, R. G. A review of the problem of distinguishing true homogeneous catalysis from soluble or other metal-particle heterogeneous catalysis under reducing conditions. J. Mol. Catal. A. 198, 317-341 (2003).

