Mizoroki-Heck-Arg-kopplingsreaktioner katalyserade av diklor {bis [1,1 ', 1'' - (phosphinetriyl) tripiperidine]} palladium under milda reaktionsbetingelser
Summary
Diklorokomplex {bis [1,1 ', 1'' – (phosphinetriyl) tripiperidine]} palladium [(P (NC 5 H 10) 3) 2 Pd (Cl) 2] (1) är ett lättillgängligt, billigt och luft stabil, men i hög grad aktiva Heck katalysator med en utmärkt funktionell grupp tolerans som effektivt fungerar under milda reaktionsbetingelser för att ge kopplings produkter i mycket höga utbyten.
Abstract
Diklor-bis (aminophosphine) komplex av palladium med den allmänna formeln [(P {(NC 5 H 10) 3 – N (C 6 H 11) n}) 2 Pd (Cl) 2] (där n = 0-2 ), tillhör en ny familj av lätt åtkomlig, mycket billigt, och luft stabil, men mycket aktiva och allmänt tillämpliga CC korskopplings katalysatorer med en utmärkt funktionell grupp tolerans. Diklor {bis [1,1 ', 1'' – (phosphinetriyl) tripiperidine]} palladium [(P (NC 5 H 10) 3) 2 Pd (Cl) 2] (1), den minst stabila komplex inom denna serie mot protoner, t ex i form av vatten, ger ett lättat nanopartikelbildning och därmed visat sig vara den mest aktiva Heck katalysator inom denna serie vid 100 ° C och är en mycket sällsynt exempel på en effektiv och mångsidig katalysatorsystem som effektivt arbetar under milda reaktionsbetingelser. Snabb och fullständig catalyst nedbrytning under arbets-up villkor i fosfonater, piperidinium salter och andra, palladiuminnehållande nedbrytningsprodukter försäkrar en enkel uppdelning av kopplingsprodukter från katalysator och ligander. Den facile, billig och snabb syntes av 1,1 ', 1 "- (phosphinetriyl) tripiperidine och en respektive, enkel och bekväm användning samt dess utmärkta katalytiska funktion vid Heck-reaktionen vid 100 ° C gör en till en av de mest attraktiva och grönaste Heck katalysatorer tillgängliga.
Vi tillhandahåller här visualiseras protokollen för ligand-och katalysatorsynteser liksom reaktionsprotokoll för Heck-reaktioner utförda vid 10 mmol-skala vid 100 ° C, och visar att denna katalysator är lämplig för dess användning i organiska synteser.
Introduction
Palladiumkatalyse CC korskopplingsreaktioner, vilket erkändes av tilldelningen av Nobelpriset i kemi i december 2010, numera hör till ett oumbärligt verktyg för målinriktad syntes av komplexa organiska molekyler inom alla forskningsområden och industriella segment. Den Mizoroki-Heck-reaktionen till exempel, gör att kopplingen av olefiner med arylhalider i närvaro av en bas och är numera den mest populära metoden för beredningen av vinylbenzenes (Figur 1). Heck-reaktionen har demonstrerats att finna bred användbarhet i både den totala syntesen av naturliga produkter i den akademiska världen och syntes i farmaceutiska och agrokemiska industrin 1-10.
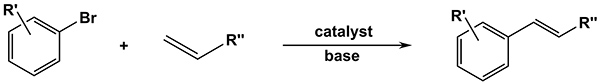
Figur 1. Allmän Heck korskopplingsreaktion mellan en arylbromid och en olefin. Klicka här för att visa en större bild.
Taxol, en mitotisk inhibitor används vid cancerkemoterapi, Singulair, astmaläkemedel och herbiciden prosulfuron liksom cykloten, en monomer för högpresterande elektroniska hartser är exempel som har med framgång framställts inklusive en Heck-Mizoroki korskopplingssteg i deras synteser (Figur 2) 11-14.
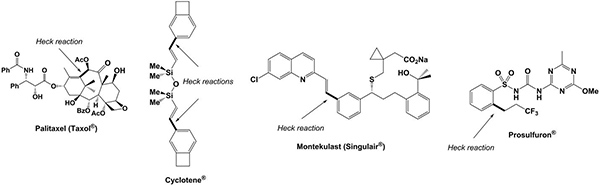
Figur 2. Exempel på industriellt relevanta organiska föreningar som innefattar en palladiumkatalyserade Heck korskopplingen som viktigt steg i deras syntes.ghres.jpg "TARGET =" _blank "> Klicka här för att visa en större bild.
Även om den senaste tidens utveckling har väsentligt ökat aktiviteten hos Heck katalysatorer 15-29, en typisk reaktion protokoll med arylbromider som substrat kräver fortfarande höga reaktionstemperaturer (140 ° C), katalysatorbelastningar i intervallet 1 mol% och reaktionstider på upp till 24 tim. Dessutom är modifierade reaktionsbetingelser, inklusive reaktionstemperatur, katalysatorbelastningar, baser, lösningsmedel och tillsatser, t ex ofta rapporterade, vilket innebär att dessa protokoll sällan kommer att finna sin tillämpning i organiska synteser grund av brist på generalitet. Dessutom är de flesta katalysatorer kräver flera reaktionssteg för deras syntes och därmed är tidsödande och låg avkastning. Dessutom är inert atmosphere tekniker och dyrbara utgångsmaterial av dålig stabilitet som ofta används för deras framställning. Detta hänvisar till behovet av nya och förbättrade, billigt och lätt tillgänglig, sbord och gröna men reaktiva och allmänna tillämpliga Heck katalysatorer med hög funktionell grupp tolerans som effektivt och tillförlitligt fungerar vid låga katalysatorbelastningar med allmänna gällande reaktionsprotokoll.
Diklor-bis (aminophosphine)-komplex av palladium har nyligen introducerats som lätt tillgängliga, billiga och flyg stabil men mycket aktiva CC korskopplings katalysatorer med utmärkt funktionell grupp tolerans 30-34, varav diklor {bis [1,1 ', 1' '- (phosphinetriyl) tripiperidine]} palladium [(P (NC 5 H 10) 3) 2 Pd (Cl) 2] (1) har visat sig vara en mycket effektiv, pålitlig och mångsidig Heck katalysator som effektivt arbetar vid 100 ° C . 35 1 kvantitativt beredd inom bara några minuter genom behandling av THF suspensioner av [Pd (Cl) 2 (COD)] (torsk = cyklookta-1 ,5-dien) med 1,1 ', 1'' – (phosphinetriyl ) tripiperidine i luftatmosfär vid 25 °C. 1,1 ', 1'' – (phosphinetriyl) tripiperidine ades respektive ligand systemet uppnås i ett steg genom droppvis tillsats av ett överskott av piperidin för att kyld dietyleter lösningar av PCI3. Substratet kostnaderna för framställning av 1,1 ', 1'' – (phosphinetriyl) tripiperidine för 1 g palladium föregångare är mindre än 1 € (beräknade från katalogpriserna för en kemikalieleverantören) och därmed, mycket billigt.
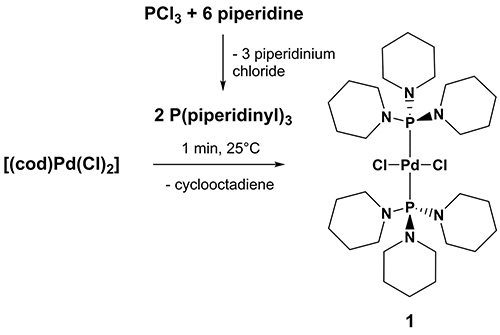
Figur 3. Syntes av diklorokomplex {bis [1,1 ', 1'' – (phosphinetriyl) tripiperidine]} palladium [(P (NC 5 H 10) 3) 2 Pd (Cl) 2] (1). Klicka här för att visa en större bild .
Dessutom, trots simple och billig syntes av 1 och dess utmärkta katalytiska prestanda, tillsats av saltsyra (arbets-up villkor), att leda till en snabb och fullständig nedbrytning katalysator, tillsammans med bildandet av fosfonat, piperidinium salt, och olösligt palladium-innehållande sönderfall produkter, som är lätta att skilja från de kopplingsprodukter. Detta är en ofta ignoreras, men mycket viktig fråga som skall beaktas (från ekologiska och ekonomiska synvinklar) och är av särskild betydelse för framställningen av farmaceutiskt relevanta föreningar.
Protocol
Representative Results
Discussion
Diklorokomplex {bis [1,1 ', 1'' – (phosphinetriyl) tripiperidine]} palladium (1) är en mycket billig och lättillgänglig, luft stabil och högaktiv Heck-katalysator med en utmärkt funktionell grupp tolerans som effektivt verkar under mild reaktion förutsättningar att ge kopplingsprodukter rent i mycket hög avkastning. Den utmärkta katalytiska aktiviteten (med allmän tillämpbarhet) av 1 är på grund av de unika egenskaperna hos aminophosphines: medan den steriska bulk liksom σ donator styrka aminophosphines är väsentligen densamma i förhållande till deras fosfin-baserade analoger, jämförbara nivåer av aktivitet hittades komplex av typen [(P {(NC 5 H 10) 3 – n (C 6 H 11) n}) 2 Pd (Cl) 2] (där n = 0-3, Figur 3) i korskopplingsreaktioner där molekylära mekanismer är verksamma. Å andra sidan, den labilakaraktär PN obligationer i aminophosphines (känslighet mot protoner, i form av vatten, t.ex.) ger möjlighet att effektivt styra bildningen av palladium nanopartiklar: allt fler PN obligationer i ligander successivt underlättar deras vatten-inducerad nedbrytning och därmed bildandet av nanopartiklar från de respektive komplex. Följaktligen, eftersom palladium nanopartiklar är den katalytiskt aktiva formen av en i Heck-reaktionen 35, såsom indikeras av sigmoidala formade kinetik 36, 37 eller en effektiv hämning av katalys efter tillsats av ett stort överskott av metalliskt kvicksilver till reaktionsblandningarna av arylbromid, olefin och katalysator, t ex 38, såväl som deras detektering genom analys av reaktionsblandningar av exemplifierande Heck-korskopplingsreaktioner med ett transmissionselektronmikroskop (TEM) som är utrustad med ett energi dispersiv X-ray (EDX) analysator 35, substitution av en , 1 ', 1'' – (phosphinetriyl) tripiperidine av 1,1 '- (cyclohexylphosphinediyl) dipiperidin), 1 – (dicyclohexylphosphinyl) piperidin) eller tricyklohexylfosfin, vilket successivt ökar komplexstabilitet och därmed fördröjer (vatten-inducerad) bildande av nanopartiklar i denna. Som en följd medan diklor-bis (1 – (dicyclohexylphosphinyl) piperidin) palladium, är katalysatorn för val i Heck-reaktionen utfördes vid 140 ° C, den högsta katalytiska aktiviteten erhölls för diklor {bis [1,1 ', 1 '' – (phosphinetriyl) tripiperidine]} palladium [(P (NC 5 H 10) 3) 2 Pd (Cl) 2] (1) vid 100 ° C, den minst stabila komplex inom denna serie.
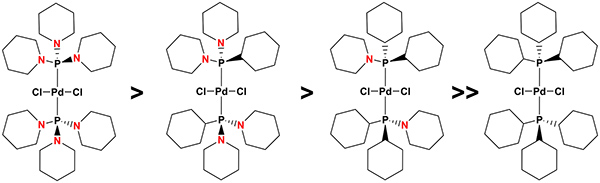
Figur 5. Effekten av ligand sammansättning diklor {bis (aminophosphine)} palladium med den allmänna formeln [(P {(NC 5 H 10) 3 – n (C 6 H 11) n}) 2 Pd (Cl) 2] (där n = 0-2) på den komplexa stabilitet och därmed om hur lätt (vatten-inducerad) nanopartikelbildning och därmed deras katalytiska prestanda under milda reaktionsbetingelser i Heck korskopplingsreaktion. Klicka här för att visa en större bild.
Även om de ovan beskrivna synteser samt Heck-reaktionen protokollen är rakt fram, några av de vanligaste felsökning är: (a) se till att tetrabutylammoniumbromid är nyligen köpt eller förvaras på rätt sätt (tetrabutylammoniumbromid är hygroskopisk), (b) se till att torra lösningsmedel används för liganden syntes när små mängder av ligand framställdes, (c) se till att en ärantingen nygjord eller förvaras i inert atmosfär, (d) se till att NMP eller DMF är nyinköpta, (e) se till att kemikalier är antingen nyinköpt eller förvaras på rätt sätt, (f) ugn-torka alla glas och sval under vakuum.
Disclosures
The authors have nothing to disclose.
Acknowledgements
Ekonomiskt stöd från Zürich yrkeshögskolan samt Swiss National Science Foundation (SNSF) erkänns.
Materials
| Phosphorous trichloride | Sigma-Aldrich | 157791 | ReagentPlus, 99% |
| Piperidine | Sigma-Aldrich | 104094 | ReagentPlus, 99% |
| Dichloro(1,5-cyclooctadiene)palladium(II) | Sigma-Aldrich | 275891 | 99% |
| Styrene | Sigma-Aldrich | S4972 | ReagentPlus, contains 4-tert-butylcatechol as stabilizer, ≥99% |
| 1-Bromo-4-phenoxybenzene | Sigma-Aldrich | B65209 | 99% |
| Tetrabutylammonium bromide | Acros Organics | 185680025 | 99+% |
| Potassium carbonate | Sigma-Aldrich | 347825 | Reagent grade, ≥98%, powder, -325 mesh |
| Silica gel | Merck | 107734 | Silica gel 60 (0.063-0.2mm), for column chromatoraphy |
| Diethyl ether | Sigma-Aldrich | 673811 | Anhydrous, ACS reagent, ≥99.0%, contains BHT as inhibitor |
| Tetrahydrofuran (THF) | Sigma-Aldrich | 186562 | anhydrous, contains 250 ppm BHT as inhibitor, ≥99.9% |
| Pentane | Sigma-Aldrich | 158941 | reagent grade, 98% |
| N-methyl-2-pyrrolidone (NMP) | Sigma-Aldrich | M79603 | ReagentPlus, 99% |
References
- Heck, R. F., Katritzky, A. R., Meth-Cohn, O., Rees, C. W. . Palladium Reagents in Organic Syntheses. Volume 2. , (1985).
- Heck, R. F., Trost, B. M., Fleming, I. Chapter 4.3, Vinyl Substitution with Organopalladium Intermediates. Comprehensive Organic Synthesis. 4, 833 (1991).
- Malleron, J. -. L., Fiaud, J. -. C., Legros, J. -. Y. . Handbook of Palladium-Catalysed Organic Reactions. , (1997).
- Reetz, M. T., Davies, S. G., Murahashi, S. I. . Transition Metal Catalysed Reactions. , (1999).
- Link, J. T., Overman, L. E., Diederich, F., Stang, P. J. Chapter 6. Metal-Catalyzed Cross-Coupling Reactions. , (1998).
- Bräse, S., de Meijere, A., Diederich, F., Stang, P. J. Chapter 3.6. Metal-Catalyzed Cross-Coupling Reactions. , (1998).
- Nicolaou, K. C., Sorensen, E. J. Chapter 31. Classics in Total Synthesis. , (1996).
- de Vries, R. A., Vosejpka, P. C., Ash, M. L., Herkes, F. E., Dekker, M. Chapter 37. Catalysis of Organic Reactions. , (1998).
- Tietze, L. F., Kettschau, G., Heuschert, U., Nordmann, G. Highly Efficient Synthesis of Linear Pyrrole Oligomers by Twofold Heck Reactions. Chem. Eur. J. 7, 368-373 (2001).
- Brase, S., Negishi, E., et al. Chapters IV.1, IV2.1, IV.2.2, and IV.2.3. Handbook of Organopalladium Chemistry for Organic Synthesis. , 1123-1315 (2002).
- Danishefsky, S. J., et al. Total Synthesis of Baccatin III and Taxol. J. Am. Chem. Soc. 118, 2843-2859 (1996).
- Higgs, G. . Chem Ind. 827, (1997).
- Baumeister, P., Blaser, H. U., Baiker, A., Prins, R., et al. . Heterogeneous catalysis and fine chemicals. , (1997).
- Schrock, A. K. Polyorganosiloxane-bridged bisbenzocyclobutene monomers. US patent. , (1989).
- Amatore, C., Carre, E., Jutand, A. Evidence for the Ligation of Palladium(0) Complexes by Acetate Ions: Consequences on the Mechanism of Their Oxidative Addition with Phenyl Iodide and PhPd(OAc)(PPh3)2 as Intermediate in the Heck Reaction. Organometallics. 14, 5605-5614 (1995).
- Fauvarque, J. F., Pflüger, F., Troupel, M. Kinetics of oxidative addition of zerovalent palladium to aromatic iodides. J. Organomet. Chem. 208, 419-427 (1981).
- de Vries, G. J. A unifying mechanism for all high-temperature Heck reactions. The role of palladium colloids and anionic species. Dalton Trans. , 421-429 (2006).
- Ohff, M., Ohff, A., van der Boom, A. M. E., Milstein, D. Highly Active Pd(II) PCP-Type Catalysts for the Heck Reaction. J. Am. Chem. Soc. 119, 11687-11688 (1997).
- Morales-Morales, D., Redon, R., Yung, C., Jensen, C. M. High yield olefination of a wide scope of aryl chlorides catalyzed by the phosphinito palladium PCP pincer complex: PdCl{C6H3(OPPri2)2-2,6}]. . Chem. Commun. , 1619-1620 (2000).
- Peris, E., Loch, J. A., Mata, J., Crabtree, R. H. A Pd complex of a tridentate pincer CNC bis-carbene ligand as a robust homogenous Heck catalyst. Chem. Commun. , 201-202 (2001).
- Herrmann, W. A., Böhm, V. P. W., Gstöttmayr, C. W. K., Grosche, M., Reisinger, C. -. P., Weskamp, T. Synthesis, structure and catalytic application of palladium(II) complexes bearing N-heterocyclic carbenes and phosphines. J. Organomet. Chem. , 617-628 (2001).
- Benito-Garagorri, D., Bocokic, V., Mereiter, K., Kirchner, K. A Modular Approach to Achiral and Chiral Nickel(II), Palladium(II), and Platinum(II) PCP Pincer Complexes Based on Diaminobenzenes. Organometallics. 25, 3817-3823 (2006).
- Miyazaki, F., Yamaguchi, K., Shibasaki, M. The synthesis of a new palladacycle catalyst. Development of a high performance catalyst for Heck reactions. Tetrahedron Lett. 40, 7379-7383 (1999).
- Eberhard, M. R. Insights into the Heck Reaction with PCP Pincer Palladium(II) Complexes. Org. Lett. , 2125-2128 (2004).
- Bolliger, J. L., Blacque, O., Frech, C. M. Short, facile, and high-yielding synthesis of extremely efficient pincer-type Suzuki catalysts bearing aminophosphine substituents. Angew. Chem. Int. Ed. 46, 6514-6517 (2007).
- Bolliger, J. L., Frech, C. M. Rationally designed pincer-type Heck catalysts bearing aminophosphine substituents: PdIV intermediates and palladium nanoparticles. Chem. Eur. J. 14, 7969-7977 (2008).
- . For a computational study about the thermal accessibility of PdII/PdIV cycles in the Heck reaction, catalyzed by pincer-type catalysts, see Blacque, O., Frech, C. M. Pincer-type Heck Catalysts and Mechanisms Based on PdIV Intermediates – A Computational Study. Chem. Eur. J. 16, 1521-1531 (2010).
- Vicente, J., Arcas, A., Julia-Hernandez, F., Bautista, D. For the synthesis and separation of the first pincer-type PdIV complex, see. Chem. Commun. 46, 7253-7255 (2010).
- Bolliger, J. L., Frech, C. M. Dichloro-Bis(aminophosphine) Complexes of Palladium – Highly Convenient, Reliable and Extremely Active Suzuki Catalysts with outstanding functional group tolerance. Chem. Eur. J. 16, 4075-4081 (2010).
- Bolliger, J. L., Frech, C. M. Dichloro{bis[1-(dicyclohexylphosphanyl)piperidine]}palladium – A Highly Effective and Extremely Versatile Palladium-based Negishi Catalyst, that Efficiently and Reliably Operates at Low Catalyst Loadings. Chem. Eur. J. 16, 11072-11081 (2010).
- Gerber, R., Oberholzer, M., Frech, C. M. Cyanation of aryl bromides with K4[Fe(CN)6] catalyzed by dichloro{bis[1-(dicyclohexyl-phosphanyl)-piperidine]}palladium – a molecular source of nanoparticles. Reactions involved in catalyst deactivation processes. Chem. Eur. J. 18, 2978-2986 (2012).
- Bolliger, J. L., Oberholzer, M., Frech, C. M. Access to 2-aminopyridines – compounds of great biological and chemical significance. Adv. Synth. Catal. 353, 945-954 (2011).
- Oberholzer, M., Gerber, R., Frech, C. M. Mizoroki-Heck reactions catalyzed by dichloro{bis[1-(dicyclohexylphosphanyl)piperidine]}palladium. Palladium nanoparticle formation promoted by (water induced) ligand degradation. Adv. Synth. Catal. 354, 627-641 (2012).
- Oberholzer, M., Frech, C. M. Mizoroki-Heck Reactions Catalyzed by Palladium Dichloro-bis(aminophosphine) Complexes Under Mild Reaction Conditions. The Importance of Ligand Composition on the Catalytic Activity. Green Chem. 15, 1678-1686 (2013).
- Watzky, M. A., Finke, R. G. Transition Metal Nanocluster Formation Kinetic and Mechanistic Studies. A New Mechanism When Hydrogen Is the Reductant: Slow, Continuous Nucleation and Fast Autocatalytic Surface Growth. J. Am. Chem. Soc. 119, 10382-10400 (1997).
- Widegren, J. A., Bennett, M. A., Finke, R. G. Is It Homogeneous or Heterogeneous Catalysis? Identification of Bulk Ruthenium Metal as the True Catalyst in Benzene Hydrogenations Starting with the Monometallic Precursor, Ru(II)(η6-C6Me6)(OAc)2, Plus Kinetic Characterization of the Heterogeneous Nucleation, Then Autocatalytic Surface-Growth Mechanism of Metal Film Formation. 125, 10301-10310 (2003).
- Widegren, J. A., Finke, R. G. A review of the problem of distinguishing true homogeneous catalysis from soluble or other metal-particle heterogeneous catalysis under reducing conditions. J. Mol. Catal. A. 198, 317-341 (2003).

