Detecção de glicogênio no sangue periférico células mononucleares com Periodic Acid Schiff Coloração
Summary
Periodic acid Schiff staining is a technique that visualizes the polysaccharide content of tissues. This article demonstrates periodic acid Schiff staining protocol adapted for use on peripheral blood mononuclear cells purified from human venous blood. Such samples are enriched for lymphocytes and other white blood cells of the immune system.
Abstract
Periodic acid Schiff (PAS) staining is an immunohistochemical technique used on muscle biopsies and as a diagnostic tool for blood samples. Polysaccharides such as glycogen, glycoproteins, and glycolipids stain bright magenta making it easy to enumerate positive and negative cells within the tissue. In muscle cells PAS staining is used to determine the glycogen content in different types of muscle cells, while in blood cell samples PAS staining has been explored as a diagnostic tool for a variety of conditions. Blood contains a proportion of white blood cells that belong to the immune system. The notion that cells of the immune system possess glycogen and use it as an energy source has not been widely explored. Here, we describe an adapted version of the PAS staining protocol that can be applied on peripheral blood mononuclear immune cells from human venous blood. Small cells with PAS-positive granules and larger cells with diffuse PAS staining were observed. Treatment of samples with amylase abrogates these patterns confirming the specificity of the stain. An alternate technique based on enzymatic digestion confirmed the presence and amount of glycogen in the samples. This protocol is useful for hematologists or immunologists studying polysaccharide content in blood-derived lymphocytes.
Introduction
Schiff (PAS) coloração ácido periódico é uma técnica de imuno-histoquímica, que é amplamente utilizado em pesquisas e diagnósticos muscular. Também é utilizada como uma ferramenta de diagnóstico em amostras de sangue. A técnica funciona através da aplicação de uma solução de ácido periódico à amostra, que oxida unidades dentro dos grupos de aldeído de polissacárido criando que reagem com o reagente de Schiff incolor produzindo assim um produto de magenta profunda. Os passos deste processo são mostrados na Figura 1. A mancha transforma nada com polissacarídeos de glicogénio magenta, incluindo, glicoproteínas, glicolipidos, mucinas, ou outras moléculas com porções de polissacáridos.
Coloração PAS é muitas vezes usado para medir os níveis de glicogênio nas fibras musculares. Cortes de tecidos músculos são ideais para a técnica como eles firmemente anexar ao slide e suportar múltiplas etapas de lavagem e de coloração. O glicogênio é mais presente em contração rápida fibras musculares tipo II, que possuem uma alta demandapara a produção de ATP rápida exigindo glicogênio para 1,2 desempenho máximo. O glicogénio é um polímero ramificado de glucose que pode ser quebrada em glicose livre através da acção de enzimas de fosforilase de glicogénio. Em tempos de descanso e nutricional-suficiência, o glicogênio é reabastecido através do processo de glycogenesis, enquanto que em tempos de insuficiência nutricional ou de alta demanda de energia; glicogênio é quebrada em glicose por glicogenólise. Já a partir de 1950 os cientistas têm explorado clínico PAS coloração em amostras de sangue para analisar o conteúdo de glicogênio em várias doenças 3-7. Por exemplo, na doença de Pompe-um armazenamento de glicogénio genuíno glóbulos brancos doen- ças acumular grandes quantidades de glicogénio que difere significativamente dos controles saudáveis 8.
Este vídeo-artigo demonstra uma versão adaptada de coloração PAS para uso em células mononucleares do sangue periférico (PBMC) a partir de amostras de sangue venoso de seres humanos saudáveis. PBMCs contêm principalmente linfócitos do linfócito T e B de linfócitos famílias, bem como outras células imunitárias, tais como as células assassinas naturais e monócitos. O primeiro passo de purificação remove os eritrócitos, neutrófilos, granulócitos e outros. Esta técnica fornece dados sobre uma parte do concentrado para a enumeração de linfócitos que permitem mais robusta de células-PAS positivo em relação ao meio de esfregaços de sangue total.
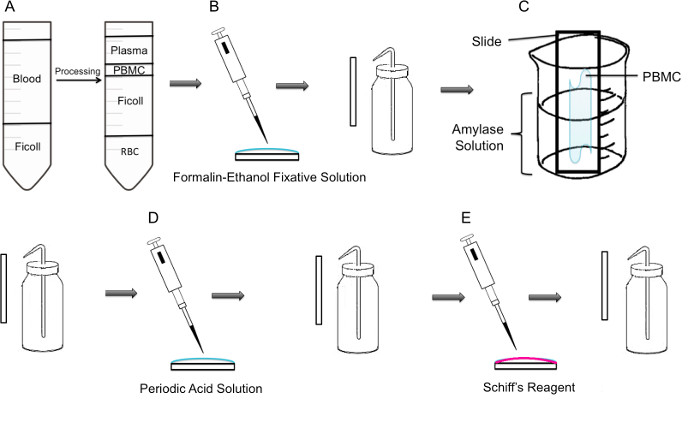
Figura 1:. Passo a metodologia passo de coloração PAS em PBMC (A) Em primeiro lugar, o isolamento de PBMC é conseguido através de um gradiente de Ficoll, no painel da esquerda mostra a preparação antes da centrifugação, o painel direito mostra que após centrifugação, onde o buffy coat contendo as PBMC Observa-se no centro do tubo. (B) isoladas PBMC são fixadas sobre a lâmina utilizando solu fixador formalina-etanolção. A lâmina é cuidadosamente enxaguada com água destilada a partir de um frasco de lavagem de plástico. (C) A lâmina é então colocada em 100 ml de um meio caminho copo cheio com solução de amilase, que irá dissolver glicogénio. A lâmina é lavada delicadamente. (D) A lâmina é tratado com solução de ácido periódico, onde oxidação de sacarídeos ocorre. As lâminas são lavadas suavemente; isto irá remover o excesso de ácido periódico e parar o passo de oxidação. (E) Quando o reagente de Schiff é adicionada às lâminas, que vai reagir com aldeídos criados durante o passo de oxidação. Este reagente incolor irá então resultar em um produto magenta vermelho escuro. As lâminas são lavadas suavemente para remover o excesso de reagente de Schiff.
Protocol
Representative Results
Discussion
Os passos críticos deste artigo de vídeo foram amilase durante a lavagem e tratamento das células. Enquanto lavava os slides, o passo fundamental estava usando uma garrafa de lavagem squeezable plástico e deixando a água correr suavemente através da amostra no slide e não visando diretamente sobre as amostras. Mesmo a menor pressão da água direto faria com que as células para sair do slide. Outro passo importante foi usar a mesma lâmina para ± condições de amilase. Após as PBMC foram aderidos à corrediç…
Disclosures
The authors have nothing to disclose.
Acknowledgements
This research was supported by a grant from the NSERC Discovery program grant number RGPIN 418522-2013. We thank R. Kilgour for helpful discussions, and Katelin Gresty and Dr. A. Berghdal for providing the mouse muscle sections.
Materials
| Periodic Acid Shiff Kit | Sigma-Aldrich | 395B | Bring to room temperature prior to use. Materials in this kit are toxic and harmful. Use caution http://www.sigmaaldrich.com/catalog/product/sigma/395b?lang=en®ion=CA |
| α-Amylase from porcine pancreas | Sigma-Aldrich | A3176 | http://www.sigmaaldrich.com/catalog/product/sigma/a3176?lang=en®ion=CA |
| Binocular Microscope | Carl Zeiss Microscopy | Axio Lab A0 | |
| Glycogen Assay Kit | Sigma-Aldrich | MAK016 | http://www.sigmaaldrich.com/catalog/product/sigma/mak016?lang=en®ion=CA |
| Ficoll-Paque PLUS | VWR, GE Healthcare | 17-1440-02 | Nonionic synthetic polymer of sucrose https://us.vwr.com/store/catalog/product.jsp?product_id=4779441 |
| Centrifuge | For PBMC isolation, swing buckets were used |
References
- Rich, P. R. The molecular machinery of keilin’s respiratory chain. Biochem. Soc. Trans. 31 (Pt 6), 1095-1105 (2003).
- Peter, J. B., Barnard, R. J., Edgerton, V. R., Gillespie, C. A., Stempel, K. E. Metabolic profiles of three fiber types of skeletal muscle in guinea pigs and rabbits). Biochemistry. 11 (14), 2627-2633 (1972).
- Jones, R. V., Goffi, G. P., Hutt, M. S. R. Lymphocyte glycogen content in various disease. J. Clin. Pathol. 15 (1), 36-39 (1962).
- Scott, R. B. Glycogen in human peripheral blood leukocytes. I. characteristics of the synthesis and turnover of glycogen in vitro. J. Clin. Invest. 47 (2), 344-352 (1968).
- Fedele, D., et al. positive index of lymphocytes and metabolic control in insulin-treated and type II diabetes mellitus. Diabete Metab. 9 (3), 188-192 (1983).
- Brelińska-Peczalska, R., Mackiewicz, S. Cytochemical studies of peripheral blood granulocytes and lymphocytes in patients with systemic lupus erythematosus. Pol.Med.Sci.Hist.Bull. 15 (2), 231-234 (1976).
- Yunis, A. A., Arimura, G. K. Enzymes of glycogen metabolism in white blood cells. I. glycogen phosphorylase in normal and leukemic human leukocytes. Cancer, Res. 24, 489-492 (1964).
- Hagemans, M. L., et al. PAS-positive lymphocyte vacuoles can be used as diagnostic screening test for pompe disease. J. Inherit. Metab. Dis. 33 (2), 133-139 (2010).
- Totsuka, Y., et al. Physical performance and soleus muscle fiber composition in wild-derived and laboratory inbred mouse strains. 95 (2), 720-727 (2003).
- Murat, J. C., Serfaty, A. Simple enzymatic determination of polysaccharide (glycogen) content of animal tissues. Clin. Chem. 20 (12), 1576-1577 (1974).
- Arrizabalaga, O., Lacerda, H. M., Zubiaga, A. M., Zugaza, J. L. Rac1 protein regulates glycogen phosphorylase activation and controls interleukin (IL)-2-dependent T cell proliferation. J. Biol. Chem. 287 (15), 11878-11890 (2012).
- Pelletier, J., G, J., Mazure, N. M. Biochemical titration of glycogen in vitro. J.Vis.Exp. (81), (2013).
- Roach, P. J., Depaoli-Roach, A. A., Hurley, T. D. Tagliabracci V.S. Glycogen and its metabolism: Some new developments and old themes. Biochem.J. 441 (3), 763-787 (2012).
- Salmoral, E. M., Tolmasky, D. S., Krisman, C. R. Evidence for the presence of glycogen in rat thymus. Cell Mol.Biol. 36 (2), 163-174 (1990).
- Darlington, P. J., et al. Diminished Th17 (not Th1) responses underlie multiple sclerosis disease abrogation after hematopoietic stem cell transplantation. Ann.Neurol. 73 (3), 341-354 (2013).

