Upptäcka Glykogen i perifera mononukleära blodceller med Periodic Acid Schiff Färgning
Summary
Periodic acid Schiff staining is a technique that visualizes the polysaccharide content of tissues. This article demonstrates periodic acid Schiff staining protocol adapted for use on peripheral blood mononuclear cells purified from human venous blood. Such samples are enriched for lymphocytes and other white blood cells of the immune system.
Abstract
Periodic acid Schiff (PAS) staining is an immunohistochemical technique used on muscle biopsies and as a diagnostic tool for blood samples. Polysaccharides such as glycogen, glycoproteins, and glycolipids stain bright magenta making it easy to enumerate positive and negative cells within the tissue. In muscle cells PAS staining is used to determine the glycogen content in different types of muscle cells, while in blood cell samples PAS staining has been explored as a diagnostic tool for a variety of conditions. Blood contains a proportion of white blood cells that belong to the immune system. The notion that cells of the immune system possess glycogen and use it as an energy source has not been widely explored. Here, we describe an adapted version of the PAS staining protocol that can be applied on peripheral blood mononuclear immune cells from human venous blood. Small cells with PAS-positive granules and larger cells with diffuse PAS staining were observed. Treatment of samples with amylase abrogates these patterns confirming the specificity of the stain. An alternate technique based on enzymatic digestion confirmed the presence and amount of glycogen in the samples. This protocol is useful for hematologists or immunologists studying polysaccharide content in blood-derived lymphocytes.
Introduction
Perjodsyra Schiff (PAS) färgning är en immunhistokemisk teknik som ofta används i muskelforskning och diagnostik. Det är också utnyttjas som ett diagnostiskt verktyg på blodprov. Tekniken fungerar genom att tillämpa periodisk syralösning till provet, som oxiderar enheter inom polysackarid skapa aldehydgrupper som reagerar med den färglösa Schiffs reagens vilket skulle skapa en djup magenta produkt. Stegen i detta förfarande visas i figur 1. Fläcken vänder allt med polysackarider magenta, inklusive glykogen, glykoproteiner, glykolipider, muciner, eller andra molekyler med polysackarid-molekyldelar.
PAS-färgning används ofta för att mäta glykogennivåer i muskelfibrerna. Muskler vävnadssnitt är idealiska för den teknik som de ordentligt fästa på bilden och tål flera tvätt- och färgningssteg. Glykogen är mest närvarande i snabb ryckning typ II muskelfibrer, som har en stor efterfråganför snabb ATP produktionen kräver glykogen för maximal prestanda 1,2. Glykogen är en grenad polymer av glukos som kan brytas till fri glukos genom verkan av glykogenfosforylas enzymer. I tider av vila och näringsförsörjningen, är glykogen fylls genom processen att glykogenes, medan det i tider av närings insufficiens eller hög energi efterfrågan; glykogen bryts ner till glukos genom glykogenolys. Från så tidigt som på 1950-talet kliniker forskare har undersökt PAS färgning på blodprov för att analysera glykogeninnehållet i olika sjukdomar 3-7. Till exempel i Pompes sjukdom-en Bonafide glykogenlagrings sjuk- doms vita blodkroppar ansamlas stora mängder glykogen som skiljer sig avsevärt från friska kontroller 8.
Denna video-artikel visar en anpassad version av PAS-färgning för användning på perifera mononukleära blodceller (PBMC) prover från venöst blod från friska humana individer. PBMCs innehåller mestadels lymfocyter i T-lymfocyter och B-lymfocyt familjer, liksom andra immunceller såsom naturliga mördarceller och monocyter. Det första reningssteget avlägsnar erytrocyter, neutrofiler och andra granulocyter. Denna teknik tillhandahåller data på en koncentrerad andel av lymfocyter som möjliggör mer robust räkning av PAS-positiva celler jämfört med användning av hela blodutstryk.
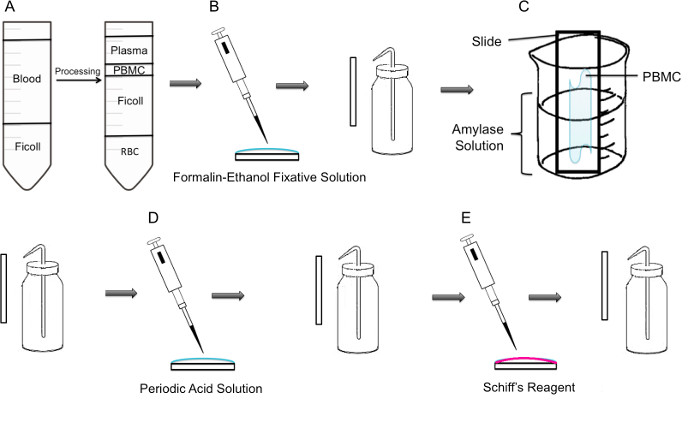
Figur 1:. Steg för steg metodik PAS färgning på PBMC (A) Först isolering av PBMC uppnås genom ficoll lutning, visar den vänstra panelen förberedelserna före centrifugering, visar den högra panelen den efter centrifugering där lättcellskoncentratet innehåller PBMC observeras i mitten av röret. (B) Isolerade PBMC fixeras på objektglaset med hjälp formalinetanolfästlösningartion. Sliden är försiktigt sköljas med destillerat vatten från en plasttvättflaska. (C) Objektglaset placeras därefter i en 100 ml bägare till hälften fylld med amylas-lösning, vilket kommer att lösa glykogen. Glid är försiktigt sköljas. (D) Glid behandlas med periodisk syralösning, där oxidation av sackarider sker. Diabilder är försiktigt sköljas; detta kommer att ta bort överskottet av perjodsyra och stoppa oxidationssteget. (E) När Schiff-reagens tillsätts till objektglasen, kommer den att reagera med aldehyder som skapats under oxidationssteget. Denna färglösa reagens kommer sedan att resultera i en djup röd magenta produkt. Slides varsamt sköljas för att avlägsna överskottet av Schiffs reagens.
Protocol
Representative Results
Discussion
De kritiska stegen i denna video artikeln var under tvättning och amylas behandling av cellerna. Medan tvätta bilderna var viktigt steg med hjälp av en plast squeezable tvättflaska och låta vattnet rinna sakta genom provet på bilden och inte siktar direkt på proverna. Även den minsta direkta vattentrycket skulle få cellerna att lossna bilden. En annan viktig steg var att använda samma bild för ± amylas förhållanden. Efter det att PBMCs vidhäftades vid sliden, var sliden placerades försiktigt i en bägare…
Disclosures
The authors have nothing to disclose.
Acknowledgements
This research was supported by a grant from the NSERC Discovery program grant number RGPIN 418522-2013. We thank R. Kilgour for helpful discussions, and Katelin Gresty and Dr. A. Berghdal for providing the mouse muscle sections.
Materials
| Periodic Acid Shiff Kit | Sigma-Aldrich | 395B | Bring to room temperature prior to use. Materials in this kit are toxic and harmful. Use caution http://www.sigmaaldrich.com/catalog/product/sigma/395b?lang=en®ion=CA |
| α-Amylase from porcine pancreas | Sigma-Aldrich | A3176 | http://www.sigmaaldrich.com/catalog/product/sigma/a3176?lang=en®ion=CA |
| Binocular Microscope | Carl Zeiss Microscopy | Axio Lab A0 | |
| Glycogen Assay Kit | Sigma-Aldrich | MAK016 | http://www.sigmaaldrich.com/catalog/product/sigma/mak016?lang=en®ion=CA |
| Ficoll-Paque PLUS | VWR, GE Healthcare | 17-1440-02 | Nonionic synthetic polymer of sucrose https://us.vwr.com/store/catalog/product.jsp?product_id=4779441 |
| Centrifuge | For PBMC isolation, swing buckets were used |
References
- Rich, P. R. The molecular machinery of keilin’s respiratory chain. Biochem. Soc. Trans. 31 (Pt 6), 1095-1105 (2003).
- Peter, J. B., Barnard, R. J., Edgerton, V. R., Gillespie, C. A., Stempel, K. E. Metabolic profiles of three fiber types of skeletal muscle in guinea pigs and rabbits). Biochemistry. 11 (14), 2627-2633 (1972).
- Jones, R. V., Goffi, G. P., Hutt, M. S. R. Lymphocyte glycogen content in various disease. J. Clin. Pathol. 15 (1), 36-39 (1962).
- Scott, R. B. Glycogen in human peripheral blood leukocytes. I. characteristics of the synthesis and turnover of glycogen in vitro. J. Clin. Invest. 47 (2), 344-352 (1968).
- Fedele, D., et al. positive index of lymphocytes and metabolic control in insulin-treated and type II diabetes mellitus. Diabete Metab. 9 (3), 188-192 (1983).
- Brelińska-Peczalska, R., Mackiewicz, S. Cytochemical studies of peripheral blood granulocytes and lymphocytes in patients with systemic lupus erythematosus. Pol.Med.Sci.Hist.Bull. 15 (2), 231-234 (1976).
- Yunis, A. A., Arimura, G. K. Enzymes of glycogen metabolism in white blood cells. I. glycogen phosphorylase in normal and leukemic human leukocytes. Cancer, Res. 24, 489-492 (1964).
- Hagemans, M. L., et al. PAS-positive lymphocyte vacuoles can be used as diagnostic screening test for pompe disease. J. Inherit. Metab. Dis. 33 (2), 133-139 (2010).
- Totsuka, Y., et al. Physical performance and soleus muscle fiber composition in wild-derived and laboratory inbred mouse strains. 95 (2), 720-727 (2003).
- Murat, J. C., Serfaty, A. Simple enzymatic determination of polysaccharide (glycogen) content of animal tissues. Clin. Chem. 20 (12), 1576-1577 (1974).
- Arrizabalaga, O., Lacerda, H. M., Zubiaga, A. M., Zugaza, J. L. Rac1 protein regulates glycogen phosphorylase activation and controls interleukin (IL)-2-dependent T cell proliferation. J. Biol. Chem. 287 (15), 11878-11890 (2012).
- Pelletier, J., G, J., Mazure, N. M. Biochemical titration of glycogen in vitro. J.Vis.Exp. (81), (2013).
- Roach, P. J., Depaoli-Roach, A. A., Hurley, T. D. Tagliabracci V.S. Glycogen and its metabolism: Some new developments and old themes. Biochem.J. 441 (3), 763-787 (2012).
- Salmoral, E. M., Tolmasky, D. S., Krisman, C. R. Evidence for the presence of glycogen in rat thymus. Cell Mol.Biol. 36 (2), 163-174 (1990).
- Darlington, P. J., et al. Diminished Th17 (not Th1) responses underlie multiple sclerosis disease abrogation after hematopoietic stem cell transplantation. Ann.Neurol. 73 (3), 341-354 (2013).

