Användning av Ramsay analys för att mäta vätskeutsöndringen och Ion Flux priser i<em> Drosophila melanogaster</em> Malpighian tubuli
Summary
Detta protokoll beskriver användningen av Ramsay-analysen för att mäta fluidsekre priser från isolerade Malpighian (renal) tubuli från Drosophila melanogaster. Dessutom till användning av jonspecifika elektroder mäta natrium- och kaliumkoncentrationer i den utsöndrade fluiden, vilket möjliggör beräkning av transepitelial jonflödet, beskrivs.
Abstract
Modulering av njur epitel jontransport tillåter organismer att upprätthålla joniska och osmotiska homeostas i ansiktet av varierande yttre förhållanden. Drosophila melanogaster Malpighian (renal) tubuli erbjuder en unik möjlighet att studera de molekylära mekanismerna för epitel jontransport, på grund av de kraftiga genetik denna organism och tillgängligheten av dess njurtubuli till fysiologisk studie. Här beskriver vi användningen av Ramsay-analysen för att mäta fluidsekre priser från isolerade gylf renala tubuli, med användning av jonspecifika elektroder för att mäta natrium- och kaliumkoncentrationer i den utsöndrade fluiden. Denna analys medger studie av transepitelial vätske- och jonflöden av ~ 20 tubuli i taget, utan att det är nödvändigt att överföra den utsöndrade fluiden till en separat anordning för att mäta jonkoncentrationer. Genetiskt distinkta tubuli kan analyseras för att bedöma betydelsen av specifika gener i transportprocesser. Dessutom bathing saltlösning kan modifieras för att undersöka effekterna av dess kemiska egenskaper, eller läkemedel eller hormoner tillsatta. Sammanfattningsvis kan denna teknik molekylär karakterisering av de grundläggande mekanismerna för epitel jontransport i Drosophila tubuli, samt reglering av dessa transportmekanismer.
Introduction
Renal epitel jontransport ligger bakom organism iono- och osmoregulation. Drosophila melanogaster Malpighian (renal) tubuli erbjuder en unik möjlighet att studera de molekylära mekanismerna för epitel jontransport. Detta beror på kombinationen av de kraftfulla genetik av Drosophila, ihopkopplade med tillgängligheten till sina njurtubuli till fysiologisk studie. The Ramsay-analysen, uppkallad efter den utredare som banat väg för tekniken 1, mäter vätska sekre priser från isolerade Malpighian tubuli, som grundades i Drosophila 1994 av Dow och kollegor 2. Detta banade väg för fortsatta studier med hjälp av Drosophila genetiska verktyg, såsom GAL4-UAS systemet 3,4, för att definiera cellspecifika signalvägar som reglerar vätskeutsöndring. Ett exempel innefattar kalciumsignalering som svar på ett peptidhormon 5, bland många andra 6,7.
ve_content "> En kombination av genteknik och klassisk fysiologisk studie har visat att urinproduktionen i farten sker genom utsöndring av en kaliumklorid rika vätska från huvud segment av tubuli. Detta sker genom parallell transepiteliala utsöndringen av katjoner, främst K + men också Na +, genom huvud cellen, och Cl -. sekre genom stelcellen 8-12 Möjligheten att separat mäta transepiteliala K + och Na + flöden tillåter en mer detaljerad beskrivning av transportmekanismer än mätning av vätskeutsöndring ensam. Till exempel i ostimulerade Drosophila tubuli, Na + / K + -ATPas-hämmare ouabain har ingen effekt på vätskeutsöndring 2, även om dess upptagning i huvud celler hämmas av den organiska anjontransportpolypeptiden hämmare taurokolat 13. dock Linton och O'Donnell visade att ouabain depolariserarden basolaterala membranpotentialen och ökar Na + flux 9. Som framgår av Representativa resultat, replikerade vi dessa resultat och visade att K + flödet är samtidigt minskade med 14; den ökade Na + flöde och minskad K + flux har motsatta effekter på vätskeutsöndring, vilket resulterar i någon nettoförändring av sekretion. Det finns alltså två resolutioner till "ouabain paradoxen", det vill säga den första observationen att ouabain har någon effekt på vätskeutsöndring i Drosophila tubuli. Först i stimulerade tubuli, är inte uppenbart att effekten av ouabain på vätskeutsöndring på grund av dess upptag av organic anion transporter 13; och andra, i ostimulerade tubuli, ouabain har motsatta effekter på transepitelial Na + och K + flöde, vilket resulterar i någon nettoförändring i vätskeutsöndring (se Representativa resultat och ref. 9). Därför primära roll Na + / K + -ATPas i ostimulerade tubuli är att sänka intracellulär Na + koncentration för att generera en positiv koncentrationsgradient för Na + -kopplade transportprocesser över basolaterala membranet. I själva verket, genom att separat mäta Na + och K + flussmedel, vi visade att tubuli saknar fly natrium-kalium-2-klorid cotransporter (NKCC) har minskat transepitelial K + flux, utan ytterligare minskning efter ouabain Dessutom, och ingen förändring i transepitelial Na * flux 14. Dessa upptäckter stödde vår slutsats att Na ^ in i cellen genom NKCC recirkuleras via Na * / K + -ATPas. I ett annat exempel, Ianowski et al. Konstaterade att sänka bad K + koncentration från 10 mM till 6 mM minskade transepiteliala K + flöde och ökad transepiteliala Na + flödet i tubuli från Rhodnius prolixus, utan nettoförändring i vätskeutsöndring <sup> 15. Särskiljande effekter på Na + flöde och K + flux över larv tubuli har också observerats i Drosophila tubuli som svar på varierande saltdieter 16 och två myggarter som svar på uppfödning salthalt 17.Den största utmaningen i mätningen av transepiteliala jonflöde i Ramsay analys preparatet är bestämningen av jonkoncentrationer inom utsöndrade vätskan. Denna utmaning har mötts med varierande lösningar, inklusive låga photometery 18, användning av radioaktiva joner 19 och elektronsond våglängd spektroskopi 20. Dessa tekniker kräver överföring av den utsöndrade vätskan sjunka till ett instrument för mätning av jonkoncentrationer. Eftersom volymen hos fluid utsöndras av ostimulerade Drosophila tubulus är liten, typiskt ~ 0,5 Nl / min, utgör detta en teknisk utmaning och dessutom införs fel om en del av den utsöndrade fluiden ärförloras vid överföring. Däremot möjliggör användning av jonspecifika elektroder mätningen av jonaktivitet (från vilken jonkoncentration kan beräknas) in situ. Den nuvarande protokollet anpassades från det som används av Maddrells och kollegor att mäta transepiteliala K + flöde över Rhodnius tubuli använder valinomycin som K + jonoforen 21, och även beskriver användningen av en 4-tert butylkalix [4] aren-tetraättiksyra tetraetylester baserade Na + specifik jon-specifik elektrod kännetecknas av Messerli et. al. 22. Jonspecifika elektroder har också använts för att mäta jonkoncentrationer i vätska som utsöndras från Malpighian tubuli i Ramsay analys i vuxen 9,23 och larver 16 Drosophila melanogaster, den nyzeeländska alpina Weta (Hemideina maori) 24 och i myggor 17.
Här beskriver vi i detalj användningen av Ramsay somsäga att mäta fluidsekrehastigheter i Malpighian tubuli från Drosophila melanogaster, liksom användning av jonspecifika elektroder för att bestämma koncentrationerna av K + och Na + inom den utsöndrade fluiden och därmed beräkningen av transepiteliala jonflöden. En översikt av analysen tillhandahålls i figur 1.
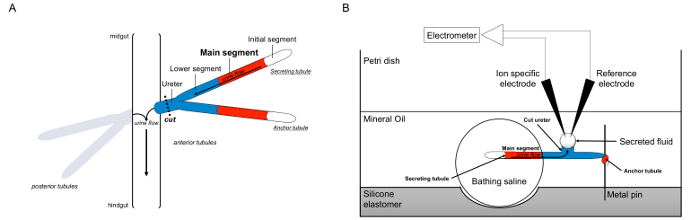
Figur 1. Skiss över Malpighian Sugrör och Ramsay analys med användning av Ion-specifika elektroder för att mäta jonkoncentrationer. Denna figur illustrerar inställningarna för den Ramsay analysen. (A) Varje fluga har fyra tubuli, ett par främre tubuli och ett par bakre kanalerna, som flyter i bukhålan omgiven av hemolymph. I varje par, de två små rören gå i urinledaren, som sedan tömmer urin vid korsningen av midgut och hindgut. Tubuli är blinda tills vidare. Urin genereras av fluid-utsöndrande huvudsegmentet (visat i rött), och strömmar mot urinledaren och ut i tarmen. Efter dissektion är tubuli paret skiljas från tarmen genom transecting urinledaren. (B) Paret av tubuli överförs sedan till en droppe av bad saltlösning inom en brunn av analys skålen. En av de två tubuli, hänvisas till här som den "ankare tubuli," lindas runt en metallstång och är inerta. Den andra tubuli är utsöndrar tubuli. Den initiala segmentet (som inte utsöndrar vätska) och huvudsegmentet av de utsöndrande tubulus förblir inom droppen av bad saltlösning. Joner och vatten skott från bad saltlösning och in i tubuli lumen i huvudsegmentet, och sedan röra sig mot urinledaren, som skulle ske in vivo. Det undre segmentet (blå) är utanför bad saltlösning och därmed inerta. Eftersom urinledaren kapas, framträder det utsöndrade fluiden som en droppe från den skurna änden av urinledaren. THan utsöndrade vätska droppe förstoras över tiden som sekre fortsätter och dess diameter mäts med hjälp av en okulär mikrometer. Ett lager av mineralolja förhindrar avdunstning av den utsöndrade vätskan. Referens- och jon specifika elektroder mäter jonkoncentrationen av den utsöndrade vätskan. Klicka här för att se en större version av denna siffra.
Protocol
Representative Results
Discussion
Användningen av Ramsay analysen tillsammans med jonspecifika elektroder möjliggör mätning av vätskeutsöndring priser och jonflöden i isolerade insekts Malpighian (renal) tubuli. Tjugo eller flera tubuli kan analyseras på en gång, vilket gör att högre genomströmning jämfört med analysen av individuella in vitro microperfused tubuli. Dessutom jonspecifika elektroder kan användas för bestämning av jonkoncentrationer inom den utsöndrade fluiden in situ begränsa fel som kan införas i öv…
Disclosures
The authors have nothing to disclose.
Acknowledgements
The authors wish to thank Drs. Sung-wan An and Mike O’Donnell for practical advice on establishing this assay, Dr. Chih-Jen Cheng for helpful discussions on the use of ion-specific electrodes, and Dr. Chou-Long Huang for his mentorship and support. This work was supported by the National Institutes of Health (K08DK091316 to ARR) and the American Society of Nephrology Gottschalk Award to ARR.
Materials
| Sylgard 184 Silicone Elastomer Kit | Ellsworth Adhesives | http://www.ellsworth.com/dow-corning-sylgard-184-silicone-encapsulant-0-5kg-kit-clear/ | May be purchased from multiple distributors |
| Petri dish, polystyrene, 100 mm x 15 mm | Fisher | FB0875712 | Specific brand is not important |
| Petri dish, polystyrene, 35 mm x 10 mm | Corning Life Sciences | Fisher 08-757-100A | Specific brand is not important |
| Scalpel Handle #3 | Fine Science Tools | 10003-12 | Specific brand is not important |
| Scalpel Blades #1 | Fine Science Tools | 10011-00 | Specific brand is not important; use appropriate sharps precautions |
| Needle, 30G x 1/2 | Becton Dickinson | 305106 | Use appropriate sharps precautions |
| Minutien pins, black anodized, 0.15 mm | Fine Science Tools | 26002-15 | |
| Stereomicroscope with ocular micrometer | Nikon | SMZ800 | Specific brand is not important; this is given as an example |
| Sheet of black stained glass, 3 mm (1/8 inch) thick | Hobby shop | Example includes Spectrum Black Opal by Spectrum Glass (http://www.delphiglass.com/spectrum-glass/opalescent/spectrum-black-opal) | |
| Glass cutting tools (glass cutter, glass cutting pliers) | Hobby shop | Examples include the Studio Pro Lightweight Running Pliers by Diamond Tech (http://www.delphiglass.com/glass-cutters-tools/pliers-nippers/studio-pro-lightweight-running-pliers) and the Studio Pro Brass Glass Cutter by Diamond Tech (http://www.delphiglass.com/glass-cutters-tools/glass-cutters/studio-pro-brass-glass-cutter). Use appropriate safety precautions when cutting glass | |
| Borosilicate glass capillary tube, unfilamented, GC120-10, OD 1.2 mm, ID 0.69 mm, length 10 cm | Warner Instruments | 30-0042 | |
| Borosilicate glass capillary tube, filamented, GC120F-10, OD 1.2 mm, ID 0.69 mm, length 10 cm | Warner Instruments | 30-0044 | |
| Nitric acid, 70% | Sigma | 438073 | CAUTION: see Material Data Safety Sheet for appropriate storage and handling guidelines. Specific brand is not important |
| Cimarec 7 in x 7 in hotplate | Fisher | 11675911Q | Specific brand is not important; caution when heated |
| Selectophore dichlorodimethylsilane | Sigma | 40136-1ML | CAUTION: see Material Data Safety Sheet for appropriate storage and handling guidelines |
| Two-step vertical pipet puller | Narishige | PC-10 | Other pipet pullers can be used; this is given as an example |
| Glass petri dish, 150 mm diameter x 15 mm height | Fisher | 08-748E | Specific brand is not important; only one dish needed |
| World Precision Instruments E210 1 mm micropipette storage jar | Fisher | 50-821-852 | May be available from other distributors. Useful to have two jars. Note that although this jar is specified for 1 mm pipets, and the pipets used here are 1.2 mm, in our experience the 1 mm jar works best for the 1.2 mm pipets. |
| Silica Gel, Tel-Tale Desiccant, indicating, 10-18 mesh | Fisher | S161-500 | Indicating silica useful for determining whether silica gel retains desiccating ability |
| World Precision Instruments MicroFil, 34G | Fisher | 50-821-914 | May be available from other distributors. |
| 1 ml syringe with luer lock | Becton Dickinson | 309659 | May be available from other distributors. |
| 3 ml syringe with luer lock | Becton Dickinson | 309657 | May be available from other distributors. |
| D300 3-way stopcock with female luer lock inlet port, male luer outlet port with rotating collar and guard | Cole-Parmer | UX-30600-02 | Specific brand is not important |
| Female Luer Locking Connector | 4 Medical Solutions | ADC 9873-10 | Specific brand is not important; barbed end is ~4 mm at narrowest point and ~7 mm at widest point. |
| Silicone Tubing I.D. x O.D. x Wall: 1/16 x 1/8 x 1/32 in. (1.59 x 3.18 x 0.79 mm) | Fisher | 14-179-110 | Specific brand is not important |
| E-3603 tubing, I.D. x O.D.: 1/32 x 3/32 in | Fisher | 14171208 | Specific brand is not important |
| Modeling clay | Specific brand is not important | ||
| Selectophore potassium ionophore I, cocktail B | Sigma | 99373 | CAUTION: see Material Data Safety Sheet for appropriate storage and handling guidelines |
| Selectophore sodium ionophore X | Sigma | 71747 | Sodium ionphore X = 4-tert-butylcalix[4]arene-tetraacetic acid tetraethylester |
| Selectophore 2-nitrophenyl octyl ether | Sigma | 73732 | |
| Selectophore sodium tetraphenylborate | Sigma | 72018 | |
| Schneider's Drosophila medium | Life Technologies | 21720024 | |
| High impedance electrometer | World Precision Instruments | FD223a | |
| Microelectrode holder 1 mm with 45° body, vented, with handle | Warner Instruments | 64-1051 | |
| Microelectrode holder 1 mm with straight body, vented | Warner Instruments | 64-1007 | |
| Silver wire | Warner Instruments | 64-1318 | |
| Micromanipulators, pair | Leitz | Various brands/models will work; this is an example | |
| Faraday cage | Technical Manufacturing Corporation | 81-334-03 | This is an example; any Faraday cage will work |
| Single gooseneck fiberoptic light | Nikon | Specific brand is not important | |
| mineral oil | Fisher | BP-2629 | Specific brand is not important |
| forceps, Dumont #5 with Biologie tip | Fine Science Tool | 11295-10 | May be available from other distributors. |
References
- Ramsay, J. A. Active Transport of Water by the Malpighian Tubules of the Stick Insect, Dixippus-Morosus (Orthoptera, Phasmidae). J Exp Biol. 31, 104-113 (1954).
- Dow, J. A., et al. The malpighian tubules of Drosophila melanogaster: a novel phenotype for studies of fluid secretion and its control. J Exp Biol. 197, 421-428 (1994).
- Brand, A. H., Perrimon, N. Targeted gene expression as a means of altering cell fates and generating dominant phenotypes. Development. 118, 401-415 (1993).
- Sozen, M. A., Armstrong, J. D., Yang, M., Kaiser, K., Dow, J. A. Functional domains are specified to single-cell resolution in a Drosophila epithelium. Proc Natl Acad Sci U S A. 94, 5207-5212 (1997).
- Rosay, P., et al. Cell-type specific calcium signalling in a Drosophila epithelium. J Cell Sci. 110 (15), 1683-1692 (1997).
- Dow, J. T., Davies, S. A. Integrative physiology and functional genomics of epithelial function in a genetic model organism. Physiol Rev. 83, 687-729 (2003).
- Beyenbach, K. W., Skaer, H., Dow, J. A. The developmental, molecular, and transport biology of Malpighian tubules. Annu Rev Entomol. 55, 351-374 (2010).
- Donnell, M. J., et al. Hormonally controlled chloride movement across Drosophila tubules is via ion channels in stellate cells. Am J Physiol. 274, 1039-1049 (1998).
- Linton, S. M., O’Donnell, M. J. Contributions of K+:Cl- cotransport and Na+/K+-ATPase to basolateral ion transport in malpighian tubules of Drosophila melanogaster. J Exp Biol. 202, 1561-1570 (1999).
- Rheault, M. R., O’Donnell, M. J. Analysis of epithelial K(+) transport in Malpighian tubules of Drosophila melanogaster: evidence for spatial and temporal heterogeneity. J Exp Biol. 204, 2289-2299 (2001).
- Donnell, M. J., Dow, J. A., Huesmann, G. R., Tublitz, N. J., Maddrell, S. H. Separate control of anion and cation transport in malpighian tubules of Drosophila Melanogaster. J Exp Biol. 199, 1163-1175 (1996).
- Cabrero, P., et al. Chloride channels in stellate cells are essential for uniquely high secretion rates in neuropeptide-stimulated Drosophila diuresis. Proc Natl Acad Sci U S A. 111, 14301-14306 (2014).
- Torrie, L. S., et al. Resolution of the insect ouabain paradox. Proc Natl Acad Sci U S A. 101, 13689-13693 (2004).
- Rodan, A. R., Baum, M., Huang, C. L. The Drosophila NKCC Ncc69 is required for normal renal tubule function. Am J Physiol Cell Physiol. 303, 883-894 (2012).
- Ianowski, J. P., Christensen, R. J., O’Donnell, M. J. Na+ competes with K+ in bumetanide-sensitive transport by Malpighian tubules of Rhodnius prolixus. J Exp Biol. 207, 3707-3716 (2004).
- Naikkhwah, W., O’Donnell, M. J. Salt stress alters fluid and ion transport by Malpighian tubules of Drosophila melanogaster: evidence for phenotypic plasticity. J Exp Biol. 214, 3443-3454 (2011).
- Donini, A., et al. Secretion of water and ions by malpighian tubules of larval mosquitoes: effects of diuretic factors, second messengers, and salinity. Physiol Biochem Zool. 79, 645-655 (2006).
- Maddrell, S. H. Secretion by Malpighian Tubules of Rhodnius movements of Ions and Water. J Exp Biol. 51, 71-97 (1969).
- Maddrell, S. H., Overton, J. A. Stimulation of sodium transport and fluid secretion by ouabain in an insect malpighian tubule. J Exp Biol. 137, 265-276 (1988).
- Williams, J. C., Beyenbach, K. W. Differential effects of secretagogues on Na and K secretion in the Malpighian tubules of Aedes Aegypti (L). J Comp Physiol. 149, 511-517 (1983).
- Maddrell, S. H., O’Donnell, M. J., Caffrey, R. The regulation of haemolymph potassium activity during initiation and maintenance of diuresis in fed Rhodnius prolixus. J Exp Biol. 177, 273-285 (1993).
- Messerli, M. A., Kurtz, I., Smith, P. J. Characterization of optimized Na+ and Cl- liquid membranes for use with extracellular, self-referencing microelectrodes. Anal Bioanal Chem. 390, 1355-1359 (2008).
- Ianowski, J. P., O’Donnell, M. J. Basolateral ion transport mechanisms during fluid secretion by Drosophila Malpighian tubules: Na+ recycling, Na+:K+:2Cl- cotransport and Cl- conductance. J Exp Biol. 207, 2599-2609 (2004).
- Neufeld, D. S., Leader, J. P. Electrochemical characteristics of ion secretion in malpighian tubules of the New Zealand alpine weta (Hemideina maori). J Insect Physiol. 44, 39-48 (1997).
- Greenspan, R. J. . Fly Pushing: The Theory and Practice of Drosophila Genetics. , (1997).
- Jayakannan, M., Babourina, O., Rengel, Z. Improved measurements of Na+ fluxes in plants using calixarene-based microelectrodes. J Plant Physiol. 168, 1045-1051 (2011).
- Wu, Y., Schellinger, J. N., Huang, C. L., Rodan, A. R. Hypotonicity Stimulates Potassium Flux through the WNK-SPAK/OSR1 Kinase Cascade and the Ncc69 Sodium-Potassium-2-Chloride Cotransporter in the Drosophila Renal Tubule. J Biol Chem. 289, 26131-26142 (2014).
- Blumenthal, E. M. Modulation of tyramine signaling by osmolality in an insect secretory epithelium. Am J Physiol Cell Physiol. 289, 1261-1267 (2005).
- Dow, J. A., Maddrell, S. H., Davies, S. A., Skaer, N. J., Kaiser, K. A novel role for the nitric oxide-cGMP signaling pathway: the control of epithelial function in Drosophila. Am J Physiol. 266, 1716-1719 (1994).
- Dube, K., McDonald, D. G., O’Donnell, M. J. Calcium transport by isolated anterior and posterior Malpighian tubules of Drosophila melanogaster: roles of sequestration and secretion. J Insect Physiol. 46, 1449-1460 (2000).
- Efetova, M., et al. Separate roles of PKA and EPAC in renal function unraveled by the optogenetic control of cAMP levels in vivo. J Cell Sci. 126, 778-788 (2013).
- Rheault, M. R., O’Donnell, M. J. Organic cation transport by Malpighian tubules of Drosophila melanogaster: application of two novel electrophysiological methods. J Exp Biol. 207, 2173-2184 (2004).
- Donnell, M. J. Too much of a good thing: how insects cope with excess ions or toxins in the diet. J Exp Biol. 212, 363-372 (2009).
- Cheng, C. J., Truong, T., Baum, M., Huang, C. L. Kidney-specific WNK1 inhibits sodium reabsorption in the cortical thick ascending limb. Am J Physiol Renal Physiol. 303, 667-673 (2012).
- Cheng, C. J., Yoon, J., Baum, M., Huang, C. L. STE20/SPS1-related Proline/alanine-rich Kinase (SPAK) is Critical for Sodium Reabsorption in Isolated Perfused Thick Ascending Limb. Am J Physiol Renal Physiol. , (2014).

