L'utilizzo del Ramsay Assay misurare la secrezione di fluidi e Ion Flux Prezzi in<em> Drosophila melanogaster</em> Tubulo Malpighi
Summary
Questo protocollo descrive l'uso del test Ramsay di misurare i tassi di secrezione di fluido dal isolate Malpighian (renale) tubuli da Drosophila melanogaster. Inoltre, l'uso di elettrodi ione-specifico per misurare le concentrazioni di sodio e potassio nel fluido secreto, consentendo il calcolo del flusso transepiteliale di ioni, è descritto.
Abstract
Modulazione di trasporto renale di ioni epiteliale permette organismi di mantenere l'omeostasi ionica e osmotico di fronte alle diverse condizioni esterne. La Drosophila melanogaster Malpighi (renale) tubulo offre un'opportunità senza precedenti per studiare i meccanismi molecolari del trasporto di ioni epiteliale, a causa delle potenti genetica di questo organismo e l'accessibilità dei suoi tubuli renali allo studio fisiologico. Qui, descriviamo l'uso del test Ramsay di misurare i tassi di secrezione di fluido dal isolato mosca tubuli renali, con l'uso di elettrodi ione-specifico per misurare le concentrazioni di sodio e potassio nel fluido secreto. Questo test consente di studio fluidi transepiteliale di ioni e flussi di ~ 20 tubuli alla volta, senza la necessità di trasferire il fluido secreto di apparecchiatura separata per misurare concentrazioni di ioni. Geneticamente tubuli distinti possono essere analizzati per valutare il ruolo di specifici geni nei processi di trasporto. Inoltre, il bsalina athing può essere modificato per esaminare gli effetti delle sue caratteristiche chimiche, o farmaci o ormoni aggiunti. In sintesi, questa tecnica permette la caratterizzazione molecolare dei meccanismi di base di trasporto ionico epiteliale nel tubulo Drosophila, nonché regolazione di questi meccanismi di trasporto.
Introduction
Renale trasporto di ioni epiteliale sottende organismal iono- e osmoregolazione. La Drosophila melanogaster Malpighi (renale) tubulo offre un'opportunità senza precedenti per studiare i meccanismi molecolari del trasporto di ioni epiteliale. Ciò è dovuto alla combinazione delle potenti genetica di Drosophila, accoppiati con l'accessibilità dei suoi tubuli renali allo studio fisiologico. Il saggio Ramsay, dal nome del ricercatore che ha aperto la strada alla tecnica 1, misura i tassi di secrezione di fluidi da isolate tubuli malpighiani, ed è stato fondato nel Drosophila nel 1994 da Dow e colleghi 2. Questo ha spianato la strada a ulteriori studi utilizzando Drosophila strumenti genetici, come il sistema GAL4-UAS 3,4, per definire vie di segnalazione specifici delle cellule che regolano la secrezione di fluidi. Un esempio include segnalazione di calcio in risposta ad un ormone peptidico 5, tra molti altri 6,7.
ve_content "> una combinazione di tecniche genetiche e studio fisiologico classica ha dimostrato che la produzione di urina nella mosca avviene attraverso la secrezione di un potassio ricco cloruro fluido dal segmento principale del tubulo. Ciò avviene attraverso la secrezione transepiteliale parallelo di cationi, soprattutto K + ma anche Na +, attraverso la cella principale e Cl -. secrezione attraverso la cella stellate 8-12 La capacità di misurare separatamente transepiteliali K + e Na + flussi consente una caratterizzazione più dettagliata dei meccanismi di trasporto rispetto alla misurazione della secrezione di fluido alone. Ad esempio, in unstimulated tubuli Drosophila, Na + / K + -ATPasi inibitore ouabain non ha alcun effetto sulla secrezione di fluido 2, anche quando il suo assorbimento nelle cellule principali è inibito dal trasportatore anionico organico inibitore taurocolato 13. Tuttavia, Linton e O'Donnell ha mostrato che ouabain depolarizzail potenziale di membrana basolaterale, e aumenta Na + flusso 9. Come mostrato nelle Rappresentante dei risultati, abbiamo replicato questi risultati, e ha mostrato che K + flusso è contemporaneamente diminuito 14; l'aumento del flusso di Na + e diminuita K + flusso avere effetti opposti sulla secrezione di liquidi, con conseguente nessun cambiamento netto della secrezione. Così, ci sono due soluzioni a "paradosso ouabaina", cioè, l'osservazione iniziale che uabaina non ha alcun effetto sulla secrezione di fluido nel tubulo Drosophila:. Primo, in tubuli stimolato, l'effetto di ouabain sulla secrezione di fluido non è evidente a causa il suo assorbimento da parte del trasportatore anionico organico 13; e in secondo luogo, nei tubuli unstimulated, ouabain ha opposti effetti sulla transepiteliale Na + e K + flusso, con conseguente nessun variazione netta secrezione di fluidi (vedi Rappresentante dei risultati e rif. 9). Pertanto, il ruolo primario della Na + / K + -ATPase in tubuli non stimolati è quello di ridurre la concentrazione intracellulare di Na + per generare un gradiente di concentrazione favorevole per Na + -coupled processi di trasporto attraverso la membrana basolaterale. Infatti, misurando separatamente Na + e K + flussi, abbiamo dimostrato che tubuli manca la cotrasportatore fly sodio-potassio-2-cloruro (NKCC) sono diminuiti K transepiteliale + flusso, senza ulteriore calo dopo ouabaina aggiunta, e nessun cambiamento in transepiteliale Na + Flusso 14. Questi risultati supportati nostra conclusione che Na + di entrare nella cellula attraverso la NKCC viene riciclato attraverso il Na + / K + ATPasi. In un altro esempio, Ianowski et al. Ha osservato che l'abbassamento bagno K + concentrazione da 10 a 6 mm è diminuito transepiteliale K + flusso e aumento transepiteliale Na + flusso nel tubuli da Rhodnius prolixus, senza variazione netta secrezione di fluidi <sup> 15. Diversi effetti sulla Na + K + flusso e flusso attraverso tubuli larvali sono stati osservati anche nei tubuli Drosophila in risposta alle diverse diete sale 16 e in due specie di zanzare in risposta ad allevamento salinità 17.La sfida più grande nella misurazione del flusso transepiteliale di ioni nella preparazione dosaggio Ramsay è la determinazione delle concentrazioni di ioni all'interno del fluido secreto. Questa sfida è stata accolta con soluzioni diverse, tra cui la fiamma photometery 18, l'uso di ioni radioattivi 19, ed elettrone sonda lunghezza d'onda spettroscopia dispersiva 20. Queste tecniche richiedono trasferimento della goccia liquido secreto a uno strumento di misura della concentrazione di ioni. Poiché il volume di fluido secreto dalla non stimolato Drosophila tubulo è piccolo, tipicamente ~ 0,5 Nl / min, questo pone una sfida tecnica e introduce anche errore se parte del fluido è secretoperso al momento del trasferimento. Al contrario, l'uso di elettrodi ione-specifico permette la misura dell'attività ionica (da cui la concentrazione di ioni può essere calcolato) in situ. Il protocollo attuale è stato adattato da quella utilizzata da Maddrell e colleghi per misurare transepiteliale K + flusso attraverso il tubulo Rhodnius utilizzando valinomicina come il K + ionoforo 21, e descrive anche l'uso di un -butylcalix 4- ter [4] acido arene-tetraacetico tetraetile estere basato Na + -specifica elettrodi specifici ioni di litio caratterizzata da Messerli et. al. 22. Elettrodi Ion-specifici sono stati utilizzati anche per misurare le concentrazioni di ioni nel fluido secreto dalle tubuli malpighiani nel test Ramsay negli adulti 9,23 e larvale 16 Drosophila melanogaster, la Nuova Zelanda Alpine Weta (Hemideina maori) 24 e 17 zanzare.
Qui, descriviamo in dettaglio l'uso del Ramsaydire di misurare i tassi di fluido secrezione nei tubuli malpighiani da Drosophila melanogaster, nonché l'uso di elettrodi ione-specifico per determinare le concentrazioni di K + e Na + nel liquido secreto e quindi il calcolo dei flussi transepiteliale di ioni. Una panoramica del test è fornito in Figura 1.
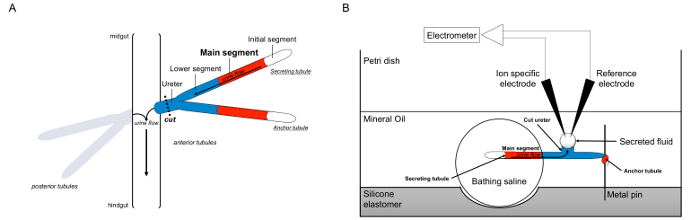
Figura 1. Schema del Malpighi tubuli e la Ramsay test con l'uso di ioni a specifici elettrodi per misurare concentrazioni di ioni. Questa figura illustra la configurazione per il saggio Ramsay. (A) Ogni mosca ha quattro tubuli, un paio di tubuli anteriori e una coppia di tubuli posteriori, che galleggiano nella cavità addominale circondato da emolinfa. In ogni coppia, i due si uniscono a tubuli l'uretere, che poi svuota l'urina all'incrocio tra midgut e hindgut. I tubuli sono ciechi a tempo indeterminato. L'urina viene generato attraverso il segmento principale del fluido-secernente (mostrato in rosso), e scorre verso l'uretere e fuori nell'intestino. Dopo la dissezione, la coppia tubulo è dissociata dall'intestino da sezionare l'uretere. (B) La coppia di tubuli viene poi trasferita in una goccia di soluzione salina in un bagno ben del piatto dosaggio. Uno dei due tubuli, qui definito il "ancoraggio tubulo," è avvolto attorno ad un perno di metallo ed è inerte. L'altro è il tubulo tubulo secernente. Il segmento iniziale (che non secernono liquido) e il segmento principale del tubulo secernono rimangono entro la goccia di soluzione salina balneazione. Ioni e spostare l'acqua dalla salina di balneazione e nel lume del tubulo del segmento principale, e poi si muovono verso l'uretere, come accadrebbe in vivo. Il segmento inferiore (blu) è fuori dalla salina di balneazione e quindi inerte. Poiché l'uretere è tagliato, il liquido secreto emerge come una gocciolina dall'estremità tagliata dell'uretere. Tegli secreto fluido gocciolina allarga nel tempo la secrezione continua, e il suo diametro viene misurato con un micrometro oculare. Uno strato di olio minerale impedisce l'evaporazione del fluido secreto. Gli elettrodi di riferimento specifici e ioni misurano la concentrazione di ioni di liquido secreto. Cliccate qui per vedere una versione più grande di questa figura.
Protocol
Representative Results
Discussion
L'uso del saggio Ramsay, insieme con elettrodi ione-specifico, permette la misura dei tassi di secrezione di fluido e flussi ionici in isolato insetti malpighiani (renali) tubuli. Venti o più tubuli possono essere dosati in un momento, consentendo un throughput più elevato rispetto al dosaggio dei singoli tubuli in vitro microperfused. Inoltre, gli elettrodi ione-specifico consentono la determinazione delle concentrazioni di ioni all'interno del fluido secreto in situ, limitando errori che po…
Disclosures
The authors have nothing to disclose.
Acknowledgements
The authors wish to thank Drs. Sung-wan An and Mike O’Donnell for practical advice on establishing this assay, Dr. Chih-Jen Cheng for helpful discussions on the use of ion-specific electrodes, and Dr. Chou-Long Huang for his mentorship and support. This work was supported by the National Institutes of Health (K08DK091316 to ARR) and the American Society of Nephrology Gottschalk Award to ARR.
Materials
| Sylgard 184 Silicone Elastomer Kit | Ellsworth Adhesives | http://www.ellsworth.com/dow-corning-sylgard-184-silicone-encapsulant-0-5kg-kit-clear/ | May be purchased from multiple distributors |
| Petri dish, polystyrene, 100 mm x 15 mm | Fisher | FB0875712 | Specific brand is not important |
| Petri dish, polystyrene, 35 mm x 10 mm | Corning Life Sciences | Fisher 08-757-100A | Specific brand is not important |
| Scalpel Handle #3 | Fine Science Tools | 10003-12 | Specific brand is not important |
| Scalpel Blades #1 | Fine Science Tools | 10011-00 | Specific brand is not important; use appropriate sharps precautions |
| Needle, 30G x 1/2 | Becton Dickinson | 305106 | Use appropriate sharps precautions |
| Minutien pins, black anodized, 0.15 mm | Fine Science Tools | 26002-15 | |
| Stereomicroscope with ocular micrometer | Nikon | SMZ800 | Specific brand is not important; this is given as an example |
| Sheet of black stained glass, 3 mm (1/8 inch) thick | Hobby shop | Example includes Spectrum Black Opal by Spectrum Glass (http://www.delphiglass.com/spectrum-glass/opalescent/spectrum-black-opal) | |
| Glass cutting tools (glass cutter, glass cutting pliers) | Hobby shop | Examples include the Studio Pro Lightweight Running Pliers by Diamond Tech (http://www.delphiglass.com/glass-cutters-tools/pliers-nippers/studio-pro-lightweight-running-pliers) and the Studio Pro Brass Glass Cutter by Diamond Tech (http://www.delphiglass.com/glass-cutters-tools/glass-cutters/studio-pro-brass-glass-cutter). Use appropriate safety precautions when cutting glass | |
| Borosilicate glass capillary tube, unfilamented, GC120-10, OD 1.2 mm, ID 0.69 mm, length 10 cm | Warner Instruments | 30-0042 | |
| Borosilicate glass capillary tube, filamented, GC120F-10, OD 1.2 mm, ID 0.69 mm, length 10 cm | Warner Instruments | 30-0044 | |
| Nitric acid, 70% | Sigma | 438073 | CAUTION: see Material Data Safety Sheet for appropriate storage and handling guidelines. Specific brand is not important |
| Cimarec 7 in x 7 in hotplate | Fisher | 11675911Q | Specific brand is not important; caution when heated |
| Selectophore dichlorodimethylsilane | Sigma | 40136-1ML | CAUTION: see Material Data Safety Sheet for appropriate storage and handling guidelines |
| Two-step vertical pipet puller | Narishige | PC-10 | Other pipet pullers can be used; this is given as an example |
| Glass petri dish, 150 mm diameter x 15 mm height | Fisher | 08-748E | Specific brand is not important; only one dish needed |
| World Precision Instruments E210 1 mm micropipette storage jar | Fisher | 50-821-852 | May be available from other distributors. Useful to have two jars. Note that although this jar is specified for 1 mm pipets, and the pipets used here are 1.2 mm, in our experience the 1 mm jar works best for the 1.2 mm pipets. |
| Silica Gel, Tel-Tale Desiccant, indicating, 10-18 mesh | Fisher | S161-500 | Indicating silica useful for determining whether silica gel retains desiccating ability |
| World Precision Instruments MicroFil, 34G | Fisher | 50-821-914 | May be available from other distributors. |
| 1 ml syringe with luer lock | Becton Dickinson | 309659 | May be available from other distributors. |
| 3 ml syringe with luer lock | Becton Dickinson | 309657 | May be available from other distributors. |
| D300 3-way stopcock with female luer lock inlet port, male luer outlet port with rotating collar and guard | Cole-Parmer | UX-30600-02 | Specific brand is not important |
| Female Luer Locking Connector | 4 Medical Solutions | ADC 9873-10 | Specific brand is not important; barbed end is ~4 mm at narrowest point and ~7 mm at widest point. |
| Silicone Tubing I.D. x O.D. x Wall: 1/16 x 1/8 x 1/32 in. (1.59 x 3.18 x 0.79 mm) | Fisher | 14-179-110 | Specific brand is not important |
| E-3603 tubing, I.D. x O.D.: 1/32 x 3/32 in | Fisher | 14171208 | Specific brand is not important |
| Modeling clay | Specific brand is not important | ||
| Selectophore potassium ionophore I, cocktail B | Sigma | 99373 | CAUTION: see Material Data Safety Sheet for appropriate storage and handling guidelines |
| Selectophore sodium ionophore X | Sigma | 71747 | Sodium ionphore X = 4-tert-butylcalix[4]arene-tetraacetic acid tetraethylester |
| Selectophore 2-nitrophenyl octyl ether | Sigma | 73732 | |
| Selectophore sodium tetraphenylborate | Sigma | 72018 | |
| Schneider's Drosophila medium | Life Technologies | 21720024 | |
| High impedance electrometer | World Precision Instruments | FD223a | |
| Microelectrode holder 1 mm with 45° body, vented, with handle | Warner Instruments | 64-1051 | |
| Microelectrode holder 1 mm with straight body, vented | Warner Instruments | 64-1007 | |
| Silver wire | Warner Instruments | 64-1318 | |
| Micromanipulators, pair | Leitz | Various brands/models will work; this is an example | |
| Faraday cage | Technical Manufacturing Corporation | 81-334-03 | This is an example; any Faraday cage will work |
| Single gooseneck fiberoptic light | Nikon | Specific brand is not important | |
| mineral oil | Fisher | BP-2629 | Specific brand is not important |
| forceps, Dumont #5 with Biologie tip | Fine Science Tool | 11295-10 | May be available from other distributors. |
References
- Ramsay, J. A. Active Transport of Water by the Malpighian Tubules of the Stick Insect, Dixippus-Morosus (Orthoptera, Phasmidae). J Exp Biol. 31, 104-113 (1954).
- Dow, J. A., et al. The malpighian tubules of Drosophila melanogaster: a novel phenotype for studies of fluid secretion and its control. J Exp Biol. 197, 421-428 (1994).
- Brand, A. H., Perrimon, N. Targeted gene expression as a means of altering cell fates and generating dominant phenotypes. Development. 118, 401-415 (1993).
- Sozen, M. A., Armstrong, J. D., Yang, M., Kaiser, K., Dow, J. A. Functional domains are specified to single-cell resolution in a Drosophila epithelium. Proc Natl Acad Sci U S A. 94, 5207-5212 (1997).
- Rosay, P., et al. Cell-type specific calcium signalling in a Drosophila epithelium. J Cell Sci. 110 (15), 1683-1692 (1997).
- Dow, J. T., Davies, S. A. Integrative physiology and functional genomics of epithelial function in a genetic model organism. Physiol Rev. 83, 687-729 (2003).
- Beyenbach, K. W., Skaer, H., Dow, J. A. The developmental, molecular, and transport biology of Malpighian tubules. Annu Rev Entomol. 55, 351-374 (2010).
- Donnell, M. J., et al. Hormonally controlled chloride movement across Drosophila tubules is via ion channels in stellate cells. Am J Physiol. 274, 1039-1049 (1998).
- Linton, S. M., O’Donnell, M. J. Contributions of K+:Cl- cotransport and Na+/K+-ATPase to basolateral ion transport in malpighian tubules of Drosophila melanogaster. J Exp Biol. 202, 1561-1570 (1999).
- Rheault, M. R., O’Donnell, M. J. Analysis of epithelial K(+) transport in Malpighian tubules of Drosophila melanogaster: evidence for spatial and temporal heterogeneity. J Exp Biol. 204, 2289-2299 (2001).
- Donnell, M. J., Dow, J. A., Huesmann, G. R., Tublitz, N. J., Maddrell, S. H. Separate control of anion and cation transport in malpighian tubules of Drosophila Melanogaster. J Exp Biol. 199, 1163-1175 (1996).
- Cabrero, P., et al. Chloride channels in stellate cells are essential for uniquely high secretion rates in neuropeptide-stimulated Drosophila diuresis. Proc Natl Acad Sci U S A. 111, 14301-14306 (2014).
- Torrie, L. S., et al. Resolution of the insect ouabain paradox. Proc Natl Acad Sci U S A. 101, 13689-13693 (2004).
- Rodan, A. R., Baum, M., Huang, C. L. The Drosophila NKCC Ncc69 is required for normal renal tubule function. Am J Physiol Cell Physiol. 303, 883-894 (2012).
- Ianowski, J. P., Christensen, R. J., O’Donnell, M. J. Na+ competes with K+ in bumetanide-sensitive transport by Malpighian tubules of Rhodnius prolixus. J Exp Biol. 207, 3707-3716 (2004).
- Naikkhwah, W., O’Donnell, M. J. Salt stress alters fluid and ion transport by Malpighian tubules of Drosophila melanogaster: evidence for phenotypic plasticity. J Exp Biol. 214, 3443-3454 (2011).
- Donini, A., et al. Secretion of water and ions by malpighian tubules of larval mosquitoes: effects of diuretic factors, second messengers, and salinity. Physiol Biochem Zool. 79, 645-655 (2006).
- Maddrell, S. H. Secretion by Malpighian Tubules of Rhodnius movements of Ions and Water. J Exp Biol. 51, 71-97 (1969).
- Maddrell, S. H., Overton, J. A. Stimulation of sodium transport and fluid secretion by ouabain in an insect malpighian tubule. J Exp Biol. 137, 265-276 (1988).
- Williams, J. C., Beyenbach, K. W. Differential effects of secretagogues on Na and K secretion in the Malpighian tubules of Aedes Aegypti (L). J Comp Physiol. 149, 511-517 (1983).
- Maddrell, S. H., O’Donnell, M. J., Caffrey, R. The regulation of haemolymph potassium activity during initiation and maintenance of diuresis in fed Rhodnius prolixus. J Exp Biol. 177, 273-285 (1993).
- Messerli, M. A., Kurtz, I., Smith, P. J. Characterization of optimized Na+ and Cl- liquid membranes for use with extracellular, self-referencing microelectrodes. Anal Bioanal Chem. 390, 1355-1359 (2008).
- Ianowski, J. P., O’Donnell, M. J. Basolateral ion transport mechanisms during fluid secretion by Drosophila Malpighian tubules: Na+ recycling, Na+:K+:2Cl- cotransport and Cl- conductance. J Exp Biol. 207, 2599-2609 (2004).
- Neufeld, D. S., Leader, J. P. Electrochemical characteristics of ion secretion in malpighian tubules of the New Zealand alpine weta (Hemideina maori). J Insect Physiol. 44, 39-48 (1997).
- Greenspan, R. J. . Fly Pushing: The Theory and Practice of Drosophila Genetics. , (1997).
- Jayakannan, M., Babourina, O., Rengel, Z. Improved measurements of Na+ fluxes in plants using calixarene-based microelectrodes. J Plant Physiol. 168, 1045-1051 (2011).
- Wu, Y., Schellinger, J. N., Huang, C. L., Rodan, A. R. Hypotonicity Stimulates Potassium Flux through the WNK-SPAK/OSR1 Kinase Cascade and the Ncc69 Sodium-Potassium-2-Chloride Cotransporter in the Drosophila Renal Tubule. J Biol Chem. 289, 26131-26142 (2014).
- Blumenthal, E. M. Modulation of tyramine signaling by osmolality in an insect secretory epithelium. Am J Physiol Cell Physiol. 289, 1261-1267 (2005).
- Dow, J. A., Maddrell, S. H., Davies, S. A., Skaer, N. J., Kaiser, K. A novel role for the nitric oxide-cGMP signaling pathway: the control of epithelial function in Drosophila. Am J Physiol. 266, 1716-1719 (1994).
- Dube, K., McDonald, D. G., O’Donnell, M. J. Calcium transport by isolated anterior and posterior Malpighian tubules of Drosophila melanogaster: roles of sequestration and secretion. J Insect Physiol. 46, 1449-1460 (2000).
- Efetova, M., et al. Separate roles of PKA and EPAC in renal function unraveled by the optogenetic control of cAMP levels in vivo. J Cell Sci. 126, 778-788 (2013).
- Rheault, M. R., O’Donnell, M. J. Organic cation transport by Malpighian tubules of Drosophila melanogaster: application of two novel electrophysiological methods. J Exp Biol. 207, 2173-2184 (2004).
- Donnell, M. J. Too much of a good thing: how insects cope with excess ions or toxins in the diet. J Exp Biol. 212, 363-372 (2009).
- Cheng, C. J., Truong, T., Baum, M., Huang, C. L. Kidney-specific WNK1 inhibits sodium reabsorption in the cortical thick ascending limb. Am J Physiol Renal Physiol. 303, 667-673 (2012).
- Cheng, C. J., Yoon, J., Baum, M., Huang, C. L. STE20/SPS1-related Proline/alanine-rich Kinase (SPAK) is Critical for Sodium Reabsorption in Isolated Perfused Thick Ascending Limb. Am J Physiol Renal Physiol. , (2014).

